

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K. Протекает следующая реакция: 2Н+ + 2e− = H2
ЭДС гальванического элемента может быть представлена как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродов. Зависимость электродного потенциала от концентраций веществ выражается уравнением Нернста:

Здесь φ0 – стандартный электродный потенциал; R – газовая постоянная; T – абсолютная температура; F – постоянная Фарадея (96500Кл/моль); n – число электронов, участвующих в электродном процессе; [Ox] и [Red] – произведения концентраций веществ, принимающих участие в соответствующей полуреакции в окисленной и восстановленной формах.
Если пластину металла, погруженного в раствор его соли с концентрацией 1 моль/л, соединить в гальванический элемент с водородным электродом, то возникшая разность потенциалов называется стандартным электродным потенциалом металла и обозначается как E°.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов.
Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au
1) Каждый металл может вытеснять (восстанавливать) из растворов их солей те металлы, которые стоят в ряду напряжений после него.
2) Все металлы, имеющие отрицательный электродный потенциал (то есть те, которые стоят в ряду напряжений до водорода), могут вытеснять (восстанавливать) его из растворов кислот.
|
|
Как нетрудно догадаться, понятие стандартного электродного потенциала приложимо не только к системе металл/ион металла, но и к любой реакции, проходящей с участием электронов.
38. Направление реакций обмена в растворах электролитов. Примеры.
При работе гальванического элемента электрохимическая система с более высоким значением электродного потенциала выступает в качестве окислителя, а с более низким – в качестве восстановителя.
Как и при любых самопроизвольно идущих процессах, реакция, протекающая в гальваническом элементе, сопровождается уменьшением энергии Гиббса. Но это означает, что при непосредственном взаимодействии реагирующих веществ реакция будет протекать в том же направлении. Таким образом, сопоставляя электродные потенциалы соответствующих систем, можно заранее определять направление, в котором будет протекать окислительно-восстановительная реакция.
Пример:


Стандартные электродные потенциалы:
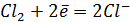 ;
; 
 ;
;  = 0,77В
= 0,77В
Поскольку  , то окислителем будет хлор, а восстановителем – ион Fe2+, реакция будет протекать справа налево.
, то окислителем будет хлор, а восстановителем – ион Fe2+, реакция будет протекать справа налево.
Когда сравниваемые значения φ0 близки, направление протекания реакции может изменяться в зависимости от концентраций участков реакции.
Например:
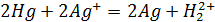
 ;
; 
 ;
;  = 0,80В
= 0,80В
При концентрациях:
-  ;
; 


 , реакция протекает справа налево.
, реакция протекает справа налево.
-  ;
;  .
.


 , реакция протекает слева направо.
, реакция протекает слева направо.
39. Водородный показатель. Методы определения рН растворов.
Так как вода относится к слабым электролитам, то для реакции диссоциации в состоянии равновесия справедливо выражение:

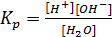 - константа равновесия
- константа равновесия
Так как 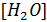 =55,0 моль/л при температуре 22 C, постоянная величина
=55,0 моль/л при температуре 22 C, постоянная величина
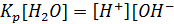 ]
]
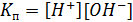 – ионное произведение воды, =10-7 при температуре 22С.
– ионное произведение воды, =10-7 при температуре 22С.
|
|
Для расчета концентрации ионов Н+ используют значение отрицательного логарифма, который называется водородным показателем соответственно
рН = –lg[H+]
pH=-lg[H+]. От 1 до 7 – кислая среда, равное 7 – нейтральная, от 7 до 14 – щелочная.
· С помощью кислотно-основных индикаторов
Кислотно-оновных индикаторы – это органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1—2 единицы.
Изменение окраски индикатора связано с тем, что эти вещества могут существовать в двух по-разному окрашенных формах – либо в кислотной (HInd), либо в основной (Ind-), между которыми существует кислотно-основное равновесие:
HInd 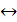 H++ Ind-.
H++ Ind-.
Очевидно, что положение равновесия, а значит, и окраска раствора, зависят от pH.Точка нейтрализации индикаторов, при которых [Hind]=[Ind-], может отвечать различным значениям pH. Практически изменение цвета индикатора происходит в некотором интервале кислотности – в 1-2 единицы pH.
| Индикатор | Кислая, pH<7 | Нейтральная, pH=7 | Щелочная, pH>7 |
| Лакмус синий | красный | фиолетовый | синий |
| Метиловый оранжевый | розовый | оранжевый | жёлтый |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Универсальный лакмус | красный | Жёлто-зелёный | Сине-зелёный, бурый |
· С помощью pH-метра – прибора, измеряющего электродвижущую силу гальванического элемента, один из электродов которого изготовлен из специального стекла. Потенциал стеклянного электрода линейно зависит от pH раствора, окружающего электрод. pH-метры позволяют измерять pH растворов в широком интервале (0-14) более точно (до 0,01 pH), чем с помощью индикаторов, и, что не менее важно, без изменения состава раствора, без каких бы то ни было добавок к нему.
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!