

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Комплексные ионы способны диссоциировать на образующие их частицы: уосплексообразователь и лиганды. Этот процесс обратим. В результате в растворах комплексных электролитов устанавливается равновесие между комплексными ионами и образующими их частицами. Например:
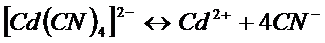

Константа этого равновесия называется константой нестойкости. Ею характеризуется степень устойчивости уосплекса. Чем меньше константа нестойкости, тем прочнее комплекс. Например:


Эти константы показывают, что комплексный ион  во много раз прочнее второго комплексного иона.
во много раз прочнее второго комплексного иона.
При большом значении константы нестойкости комплексный ион в водном растворе почти послностью распадается на образующие его комплекснообразователь и лиганды. С этой точки зрения можно рассматривать двойные соли как комплексные соединения очень малой стойкости.
Устойчивость комплексных соединений. Константа нестойкости: В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Диссоциация комплексных соединений протекает по стадиям. На первой стадии комплексное соединение диссоциирует как сильный электролит, т. е. практически полностью. Далее, комплексный ион диссоциирует как слабый электролит по ступеням, т. е. лиганды отделяются от комплексообразователя постепенно. Например, диссоциация комплексной соли [Ag(NH3)2]Cl протекает по следующим стадиям:
|
|
Первая стадия: [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl-
Вторая стадия:1. Ag(NH3)2]+ AgNH3+ + NH3

2. AgNH3+ Ag+ + NH3
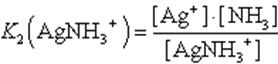
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
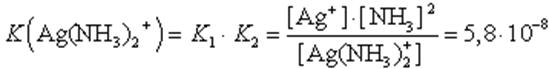 (9.1)
(9.1)
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости:
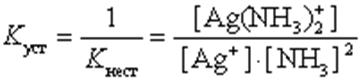 (9.2)
(9.2)
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса. Наиболее устойчивые в растворах комплексные ионы имеют наименьшие константы нестойкости. Так, среди соединений
[Ag(NO2)2]- [Ag(NH3)2]+ [Ag(S2O3)]- [Ag(CN)2]-
K нест 1,3 · 10-3 5,8 · 10 -8 1,5 · 10 -9 1,4 · 10-20
устойчивость комплекса возрастает при переходе от [Ag(NO2)2] - к [Ag(CN)2] -.
Значения констант нестойкости и устойчивости приводятся в справочниках по химии. С помощью этих величин можно предсказать течение реакций между комплексными соединениями: при сильном различии констант устойчивости реакция пойдет в сторону образования комплекса с большей константой устойчивости или, что равноценно, с меньшей константой нестойкости. Например, для иона [Ag(NH3)2] + Kнест = 5,8 · 10 -8, а для иона [Ag(CN)2] - Kнест = 1,4 · 10 -20, поэтому при действии раствора КСN аммиакат серебра разрушается с образованием иона [Ag(CN)2] -:
[Ag(NH3)2]Cl = 2KCN = K[Ag(CN)2] + 2NH3 = KCl
Зная константы нестойкости различных комплексов, можно теоретически вычислить концентрацию соответствующих простых ионов в растворах комплексных солей.
Применение теории кристаллического поля (ТКП), или теории поля лигандов для описания строения комплексных соединений. Расщепление энергетических подуровней d-элементов в поле лигандов. Лиганды сильного и слабого поля.
Заполнение d-орбиталей электронами. Высоко- и низкоспиновые комплексы, магнитные свойства комплексов.
|
|
Теория поля лигандов – квантовохимическая теория электронного строения координационных соединений. Описывает взаимодействие центров атома (или группы атомов) и лигандов на основе представлений о молекулярных орбиталях в рамках молекулярных орбиталей методов. Как и в кристаллического поля теории, в поля лигандов теория принимается, что состояние электронов центр.атома определяется электростатическим полем, созданным лигандами, однако учитывается также изменение электронного распределения лигандов под воздействием центр. атома. Соответственно расширяются и задачи, решаемые методами поля лигандов теория: помимо описания строения, реакционной способности, расчета спектральных и термодинамических характеристик координационных соединений и изменений их свойств при замене центров атома или, лигандов, становится возможным теоретический анализ таких ситуаций, когда взаимодействие центрального атома и лигандов настолько существенно, что может привести, например, к образованию прочных химических связей. Так, поля лигандов теория позволяет, в частности, описать смещения электронной плотности s- и p-электронных подсистем в группах СО карбонильных комплексов металлов.
Согласно теория поля лигандов, изменение электронного распределений в комплексном соединении по сравнению со свободными (изолированными) центральным атомом и лигандами наиболее существенно для валентной оболочки центрального атома, высших заполненных и низших незаполненных (виртуальных) орбиталейлигандов; именно из этих орбиталей конструируются молекулярные орбитали комплекса в целом. Остальные орбитали центрального атома и лигандов считаются неизменными. Экспериментальные результаты, получаемые методами фотоэлектронной и рентгеновской спектроскопии, а также расчеты с помощью неэмпирических методов квантовой химии свидетельствуют о том, что потенциалы ионизации с внутренних орбиталей комплексов и электронные распределения зависят от природы лигандов. Однако при описании электронного строения валентной оболочки комплекса этой зависимостью можно пренебречь. Поля лигандов теория наиболее плодотворна для анализа комплексных соединений, образованных d- и f-элементами, в частности переходными металлами, для которых характерна близость расположения атомных уровней типа 3d, 4s и 4р.
|
|
Расположение энергетических уровней комплекса и его орбитали можно определить непосредственно одним из методов молекулярных орбиталей (наиболее надежные результаты получают при применении метода самосогласованного поля ССП-Хa) либо рассчитать приближенно, например в предположении, что изменение взаимодействия орбиталей центрального атома и лигандов в зависимости от геометрии расположения лигандов может быть описано с использованием лишь угловой части интегралов перекрывания. Радиальная часть интегралов перекрывания более чувствительна к расстояниям между центральным атомом и лигандами, поэтому изменение радиальной части обычно связывают с некоторыми эффективными параметрами, характеризующими степень ковалентности связи.
Ограничения поля лигандов теория относятся прежде всего к анализу возбужденных состояний комплексов (особенно в случае средних и слабых полей лигандов). В этих случаях для получения надежных данных о распределении электронов в комплексах следует учитывать не только расположение и порядок одноэлектронных уровней энергии, но и корреляц. эффекты, обусловленные межэлектронным отталкиванием. При анализе комплексов, образованных тяжелыми металлами, необходим учет спин-орбитального взаимодействия и некоторых других эффектов.
Применение теории валентных связей для описания строения комплексных соединений. Гибридизация орбиталей центрального иона и геометрия
окружения лигандов.
Теория валентных связей была первой из квантовомеханических теорий, использованной для приближенного объяснения характера химических связей в комплексных соединениях. В основе ее применения лежала идея о донорно-акцепторном механизме образования ковалентных связей между лигандом и комплексообразователем. Лиганд считается донорной частицей, способной передать пару электронов акцептору – комплексообразователю, предоставляющему для образования связи свободные квантовые ячейки (атомные орбитали) своих энергетических уровней.
|
|
Для образования ковалентных связей между комплексообразователем и лигандами необходимо, чтобы вакантные s-, p- или d-атомные орбитали комплексообразователя подверглись гибридизации определенного типа. Гибридные орбитали занимают в пространстве определенное положение, причем их число соответствует координационному числу комплексообразователя.
При этом часто происходит объединение неспаренных электронов комплексообразователя в пары, что позволяет высвободить некоторое число квантовых ячеек – атомных орбиталей, которые затем участвуют в гибридизации и образовании химических связей.
Неподеленные пары электронов лигандов взаимодействуют с гибриднымиорбиталями комплексообразователя, и происходит перекрывание соответствующих орбиталей комплексообразователя и лиганда с появлением в межъядерном пространстве повышенной электронной плотности. Электронные пары комплексообразователя, в свою очередь, взаимодействуют с вакантными атомными орбиталямилиганда, упрочняя связь по дативному механизму. Таким образом, химическая связь в комплексных соединениях является обычной ковалентной связью, достаточной прочной и энергетически выгодной.
Электронные пары, находящиеся нагибридныхорбиталях комплексообразователя, стремятся занять в пространстве такое положение, при котором их взаимное отталкивание будет минимально. Это приводит к тому, что структура комплексных ионов и молекул оказывается в определенной зависимости от типа гибридизации.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
Гибридизация и геометрия молекул: Представления о гибридизации атомных орбиталей лежат в основе теории отталкивания электронных пар Гиллеспи-Найхолма. Каждому типу гибридизации соответствует строго определённая пространственная ориентация гибридных орбиталей центрального атома, что позволяет её использовать как основу стереохимических представлений в неорганической химии.
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!