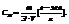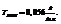Раствор - гомогенная система, в которой одно вещество равномерно распределено в среде другого.
Понятие раствор может относиться к любому агрегатному состоянию (газ, жидкий раствор, твердый раствор – смешанные кристаллы).
Раствор - гомогенная система, состоящая из двух или более самостоятельных веществ - компонетнов.
В растворе различают растворитель и растворяемое вещество.
Растворы газа в газе или жидкости в жидкости называют смесями.
Разбавленный раствор – раствор, в котором содержание одного из компонентов намного меньше содержания другого компонента.
Концентрированный раствор - раствор, в котором относительные количества растворенного вещества и растворителя одного порядка.
Насыщенный раствор – раствор, в котором растворенное вещество при данных условиях более не растворяется, даже при продолжительном перемешивании.
Примечание автора. Не стоит путать два понятия – концентрированный и насыщенный.
Концентрация насыщенного раствора - мера растворимости вещества при данных условиях.
Раствор называют пересыщенным, если содержание растворенного вещества значительно превышает предел насыщения данного раствора.
Пример. При  можно приготовить 20%-ный раствор
можно приготовить 20%-ный раствор  (довольно концентрированный, но еще не насыщенный). Концентрация насыщенного раствора при данной температуре составляет 31.5%.
(довольно концентрированный, но еще не насыщенный). Концентрация насыщенного раствора при данной температуре составляет 31.5%.
Способы выражения концентраций растворов.
Концентрация раствора – количественное выражение его состава.
1. Молярные доли (дроби) показывают какую долю составляет число молей данного компонента от общего числа молей всех компонентов.
Пример. Компоненты А и В. Массы компонентов  Число молей компонентов -
Число молей компонентов - 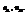
Молярная доля компонента А 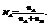
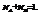
2. Процентное выражение концентрации 
3. Концентрация, выражаемая через плотность раствора.
Вычисляется с помощью приборов (ареометр, пикнометр, лактометр) и специальных таблиц значений.
4. Молярная концентрация 
показывает сколько молей растворенного вещества в одном литре раствора.
 М – молекулярная масса вещества.
М – молекулярная масса вещества.
5. Моляльная концентрация 
показывает сколько молей растворенного вещества приходится на 1000 грамм растворителя 
6. Нормальная концентрация 
показывает сколько грамм-эквивалентов растворенного вещества содержится в 1 литре раствора 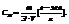
7. Титр – число граммов раствренного вещества в 1 мл раствора.
Пример. 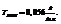
Физические и химические процессы при при растворении. Растворимость твердых тел и жидкостей в жидкостях.
Растворам присущи признаки как химического (однородность раствора) соединения, так и механической (изменение состава раствора в широких пределах, а также возможность обнаружения в свойствах раствора свойтсв отдельных слагающих его компонентов) смеси.



 можно приготовить 20%-ный раствор
можно приготовить 20%-ный раствор  (довольно концентрированный, но еще не насыщенный). Концентрация насыщенного раствора при данной температуре составляет 31.5%.
(довольно концентрированный, но еще не насыщенный). Концентрация насыщенного раствора при данной температуре составляет 31.5%. Число молей компонентов -
Число молей компонентов - 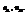
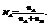
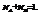


 М – молекулярная масса вещества.
М – молекулярная масса вещества.