Какая соль аммония гидролизуется как по катиону так и по аниону?карбонат
Какая формула выражает относительную молекулярную массу вещества?  ; 2bo
; 2bo
Какая формула отражает молярную массу?  ;
;
Какие вещества, взятые в количестве 5 моль (при н.у.) занимают одинаковый объем:хлор, аммиак
Какие значения всех квантовых чисел (n, l, ml, ms) возможны для валентного электрона атома калия: 4, 0, 0, +  :
:
Какие из защитных покрытий являются анодными по отношению к защищаемому металлу:Fe покрыто Al;
Какие из перечисленных обозначений орбиталей не верны: 1p, 2d
Какие изменения температуры Т и давления Р способствует образованию СО по реакции С(тв.) + СО2(г.)  2СО (г.) -119,8 кДж:повышение Т и понижение Р;
2СО (г.) -119,8 кДж:повышение Т и понижение Р;
Какие продукты образуются при сливании растворов AlCI3 и Na2CO3: Al(ОН)3 + NaCI + СО2
Какой металл при взаимодействии с концентрированной азотной кислотой может
Какой объем при н.у. займет хлор массой 177,5 г? 56 л;
Какой оксид соответствует сернистой кислоте. SO2 ;
Какой оксид соответствует хромовой кислоте(H2CrO4) Cr2O3;
Какой признак не отвечает химической стороне процесса растворения:диффузия частиц растворенного вещества.
Какой продукт образуется при взаимодействии цинка с очень разбавленной азотной кислотой: NH4NO3;
Какой ряд включает только переходные элементы:элементы 24, 39, 74, 80;
Какой ряд содержит лишь кислотные оксиды: V2O5; CrO3; TeO3; Mn2O7
Какой ряд содержит только сильные электролиты: H2SO4, HCIO4
Какой ряд содержит только слабые электролиты: HCN, NH4OH
Какой ряд элементов представлен в порядке возрастания атомного радиуса:О, S, Se, Te;
Какой случай является условием самопроизвольного протекания химической реакции в прямом направлении: ∆ G< О
Какой химический элемент образует основание с наиболее ярко выраженными свойствамикалий
Какой элемент имеет наименьший ионизационный потенциал: Bi
Какую массу воды (кг) надо подвергнуть разложению, чтобы получить 4 кг кислорода: 4,5
Какую пространственную конфигурацию имеет молекула при sp2 гибридизации АО:плоская тригональная
Качественно характер среды определяют с помощью:индикаторов
Квантовые числа последнего электрона в атоме элемента, равны n = 5, l = 1, m = -1, ms = -  . Где находится этот элемент в периодической системе? 5 период, шестая группа главная подгруппа
. Где находится этот элемент в периодической системе? 5 период, шестая группа главная подгруппа
кДж при понижении температуры:Равновесие сместится в правую сторону;
Кислотный оксид: MoO3
Количественно характер среды определяют с помощью:прибора рН – метра
Константа скорости реакции является скоростью реакции при концентрациях реагирующих веществ, равных: 1 моль/л
Концентрация ионов водорода в растворе равна [Н+] = 2,5·10-4 моль/л. Чему равна pH раствора? 3,6
Концентрация ионов водорода в растворе равна [Н+] = 5·10-6 моль/л. Чему равна pH раствора? 5,3
М
С как
им веществом будет реагировать гидроксид калия? BaSO4;
С каким металлом реагирует соляная кислота? Ni.
С помощью стеклянной трубки выдыхают углекислый газ в растворы. В каком из растворов будет изменение: Ca(OH)2
С ростом порядкового номера элемента кислотные свойства оксидов N2O3 - P2O3 - As2O3 - Sb2O3 - Bi2O3 ослабевают;
С точки зрения протолитической теории кислоты –это:вещества, которые способны отдавать протоны
С точки зрения протолитической теории основания –это:вещества, которые способны принимать протоны
Самая высшая степень окисления хрома в соединениях равна: +6;
Сколько энергетических уровней занимают электроны в атоме вольфрама? 6
Сколько граммов NаОН содержится в 1 литре 0,5 н. раствора: 20 г
Сколько граммов воды содержится в 200 г 5 % - ного раствора NaCl: 190 г
Сколько граммов Н2SО4 содержится в 1 литре 1 н. раствора: 49 г
Сколько из нижеприведенных газов будут взаимодействовать с соляной кислотой: углекислый газ, кислород, водород, азот, аммиак? 1;
Сколько молей кислорода образуется из 3 моль хлората калия при его полном термическом разложении: 4,5
Сколько нейтронов в ядре атома наиболее распространенного изотопа свинца 207Pb? 125
Сколько подуровней включает уровень с n = 4? 4
Сколько протонов в ядре атома осмия? 76
Сколько электронов максимально находится на уровне n = 3? 18
Современная теория строения атома основана на представлениях:квантовой механики;
Соотношение смешиваемых массовых частей 19 %-ного и 4 %-ного растворов вещества соответственно, необходимое для получения 10 %-ного раствора: 2:3
Соотношение смешиваемых массовых частей 30 %-ного и 2 %-ного растворов вещества соответственно, необходимое для получения 10 %-ного раствора: 2:5
Соотношение смешиваемых массовых частей 40 %-ного и 10 %-ного растворов вещества соответственно, необходимое для получения 20 %-ного раствора: 1:2
Соотношение смешиваемых массовых частей 60 %-ного и 10 %-ного растворов вещества соответственно, необходимое для получения 20 %-ного раствора: 1:4
Соотношение смешиваемых массовых частей 60 %-ного и 20 %-ного растворов вещества соответственно, необходимое для получения 30 %-ного раствора: 1:3
Сродством к электрону называют:выделение энергии при присоединении электрона к атому или иону;
Существование каких из приведенных элементов было предсказано Д.И. Менделеевым: Sc, Ga, Ge;
Т
Температурный коэффициент скорости показывает, во сколько раз возрастает скорость реакции при повышении температуры на: 10 0С
Тепловой эффект химической реакции при постоянном давлении равен:изменению энтальпии
У
У какой кислоты нет кислой соли: HPO3;
увеличивается
Укажите 3 газа, имеющих одинаковую плотность по любому другому газу: CO, C2H4, N2
Укажите анионный комплекс:гексацианоферрат (III) калия;
Укажите группу веществ, в которой все вещества реагируют с соляной кислотой… NaOH, AgNO3, Mg;
Укажите заряд ядра атома, у которого конфигурация валентных электронов в основном состоянии …4d25s2: 40
Укажите значение относительной плотности оксида азота (II) по водороду: 15
Укажите катионный комплекс: [Cr(H2O)6] CI3;
Укажите комплексный неэлектролит: [Pt(NH3)2CI2];
Укажите комплексный неэлектролит:тетрахлородиамминплатина (IV);
Укажите необратимую реакцию: NaCl + AgNO3 → AgCl + NaNO3
Укажите объем (н.у.) содержащий 1 моль вещества: 22,4 л.аммиака
В процессе восстановления степень окисления элемента, входящего в состав вещества:Понижается
В процессе окисления степень окисления элемента:Повышается;
В растворах какой соли синеет лакмусовая бумажка: Na3PO4;
В растворе какой соли метилоранж приобретает розовую окраску: MgCI2;
В растворе какой соли рН=7: Ba(NO3)2;
В растворе какой соли фенолфталеин приобретает малиновую окраску: K2CO3;
В результате ядерной реакции  образуется изотоп:
образуется изотоп: 
В ряду от Li к Fr: усиливаются металлические свойства;
В ряду молекул LiF – BeF2-BF3- CF4-NF3-OF2-F2: ковалентный характер связи усиливается;
В ряду С-Si-Ge-Sn-Pb неметаллические признаки элементов:ослабевают;
В трех пробирках находятся сухие вещества CaO, Al2O3, P2O5. При помощи каких реагентов можно различить эти вещества? CuSO4 и NaOH
В уравнении реакции K2Cr2O7+H2O2+H2SO4 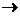 Cr2(SO4)3+O2+K2SO4+H2O
Cr2(SO4)3+O2+K2SO4+H2O
В уравнении реакции K2Cr2O7+KNO2+H2SO4 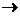 KNO3+K2SO4+Cr2(SO4)3+H2O расставьте коэффициенты и укажите коэффициент перед серной кислотой: 4
KNO3+K2SO4+Cr2(SO4)3+H2O расставьте коэффициенты и укажите коэффициент перед серной кислотой: 4
Валентные орбитали атома бериллия в молекуле гидрида бериллия гибридизованы по типу:sp
Валентные орбитали атома бора в молекуле BF3 гибридизованы по типу: sp2
Валентные орбитали у атома кремния в молекуле силана SiH4 можно описать на основе представления о гибридизации типа (sp; sp2; sp3; d2sp3; dsp2). Поэтому молекула силана имеет форму:тетраэдричесую;
Валентные орбитали у атома углерода в молекуле метана СН4 можно описать на основе представлений о гибридизации типа (sp; sp2; sp3; d2sp3; dsp2). При этом молекула метана имеет форму:тетраэдрическую;
Величина константы равновесия зависит:от природы реагирующих веществ и температуры
Величина константы скорости химической реакции не зависит от концентрации веществ
Взаимодействие неметалла с водородом приводит к образованию… бескислородной кислоты;
Внутри периода увеличение порядкового номера элемента обычно сопровождается:уменьшением атомного радиуса и возрастанием электроотрицательности атома;
Во сколько раз нужно увеличить концентрацию анионов гидроксида в растворе, чтобы рН увеличить на 1: 10;
Во сколько раз нужно увеличить концентрацию катионов водорода, чтобы рН раствора уменьшился на 1: 10;
Водородным показателем называют:десятичный логарифм концентрации водородных ионов, взятый с обратным знаком
Возрастание скорости реакции с ростом температуры принято характеризовать:температурным коэффициентом скорости реакции
Восстановители – это:Вещества, содержащие в своем составе элемент, степень окисления которого в результате реакции повышается
восстановить ее до NO2: Cu;
Выражение теплового эффекта изобарного процесса: ∆ Н = ∆ U + А
Выражение теплового эффекта изохорного процесса: Q V = ∆ U
Вычислить молярную массу нитрата бария. 261 г/моль;
Вычислить молярную массу нитрата магния. 148 г/моль;
Вычислить молярную массу сульфида калия. 110 г/моль
Вычислить молярную массу хлорида магния. 95 г/моль;
Г
Газ массой 14 г(н.у.) занимает объем 11,2 л.Определить молярную массу газа. 28 г/моль;
Газ массой 220 г.(н.у.) занимает объем 112л. Определить молярную массу газа. 44 г/моль;
Газ массой 64 г(н.у.) занимает объем 44,8 л. Определить молярную массу газа. 32 г/моль;
Газ массой 7,8г(н.у.) занимает объем 6,72л. Определить молярную массу газа. 26 г/моль.
Газ массой 8 г (н.у.) занимает объем 5,6 л. Определить молярную массу газа. 32 г/моль;
Гидроксид какого металла можно получить растворением в воде соответствующих оксидов: KOH
Гидроксид калия массой 2,8 г взаимодействует с кислотой массой 1,825 г. Молярная масса эквивалента кислоты: 36,5 г/моль
Гидроксид кальция и серная кислота реагируют друг с другом с образованием гидросульфата кальция. Соответственно молярные массы их эквивалентов: 37 г/моль и 98 г/моль
Гидроксид магния и серная кислота реагируют друг с другом с образованием сульфата гидроксомагния. Соответственно молярные массы их эквивалентов: 58 г/моль и 49 г/моль
Гидроксид натрия массой 2,0 г взаимодействует с кислотой массой 3,15 г. Молярная масса эквивалента кислоты: 63 г/моль
Гидролиз какой соли протекает полнее (при одинаковом разбавлении растворов): AI2S3;
Д
Дальтониды – вещества имеющие:постоянный состав
Даны следующие вещества: AgNO3, HNO3, Na2O, SO2, Hg. Количество соединений, взаимодействующих с соляной кислотой, равно: 3;
Даны следующие вещества: Na2O, Hg, SO2, Ca, Cu (OH)2. Количество соединений, взаимодействующих с соляной кислотой, равно… 4.
Даны следующие вещества: Na2O, Hg, SO2, Ca, Cu (OH)2. Количество соединений, взаимодействующих с соляной кислотой, равно… 4.
Даны следующие вещества: Zn(OH)2, Na2O, Cu(OH)2, Cu(NO3)2, CaO. Количество соединений, взаимодействующих с гидроксидом натрия, равно… 2;
Даны следующие вещества: сульфид натрия, сульфит натрия, сульфат натрия, нитрат натрия, фосфат натрия. Количество соединений, взаимодействующих с нитратом бария, равно… 4;
Даны следующие вещества: фосфат калия, гидроксид натрия, сульфид натрия, нитрат калия, ацетат натрия. Количество соединений, взаимодействующих с хлоридом меди (II) равно… 3;
Даны следующие вещества:, HNO3, Na2O, СO2, Hg, AgNO3. Количество соединений, взаимодействующих с соляной кислотой, равно… А) 5;3;
Даны следующие соединения: HCl, HNO3, H2O, H2SO4, HBr. Количество соединений, взаимодействующих с Fe2O3, равно… 4;
Даны следующие соединения: СО2, Al2O3. H2O, CuO, HCl. Количество соединений, взаимодействующих с SO3, равно… 3.
Двадцать первый электрон атома скандия располагается на 3 d – подуровне, а не на 4 р – подуровне. Это соответствует содержанию: 2-гоправила Клечковского.
Двухосновной кислотой является:селеновая.
Для гетерогенных реакций скорость реакции зависит также от:площади поверхности соприкосновения твердых веществ;
Для какого из перечисленных ниже веществ характерно образование атомной решетки:алмаз;
Для какого из перечисленных ниже веществ характерно образование ионной решетки:иодид цезия;
Для какого из подуровней сумма (n+l) больше: 4p
До и после протекания любой химической реакции не изменяются:массы веществ
Добавление одноименных ионов:уменьшает степень диссоциации
Е
Единственный электрон атома водорода в основном состоянии располагается на первом энергетическом уровне. Это соответствует содержанию:Принципа наименьшей энергии;
Если в составе вещества элемент находится в своей самой низшей степени окисления, то данное вещество является:Только восстановителем; 2bl
З
Зависимость константы скорости реакции от температуры выражается: уравнением Аррениуса
Закон действия масс был открыт:К. Гульдбергом и П. Вааге
Закон действия масс показывает зависимость скорости реакции от:концентрации реагирующих веществ;
Закон постоянства состава веществ справедлив для веществ:с молекулярным строением
Запись на этикетке склянки «0,5%-ный» показывает что:В 100 граммах раствора находится 0,5 грамм растворенного вещества
Запись на этикетке склянки «0,5н.» показывает что:В 1 литре раствора находится 0,5 моль эквивалентов растворенного вещества
Заряд какого комплексного иона равен +1: [Co+3(H2O)4Cl2];
Заряд какого комплексного иона равен (-2): [ Hq+2(SCN)4];
Заряд комплексного иона равен:алгебраической сумме зарядов комплексообразователя и лигандов
Заряд электрона: 1,602 ∙ 10-19 Кл
Значение константы скорости реакции не зависит от: концентрации реагирующих веществ
И
Из двух атомных 2s – орбиталей образуются следующие молекулярные орбитали: σсв (2s) и σразр (2s)
Из двух атомных 2рy – орбиталей образуются следующие молекулярные орбитали: π св (2рy) и π разр (2рy)
Из двух атомных 2рz – орбиталей образуются следующие молекулярные орбитали: π св (2рz) и π разр (2рz)
Из двух атомных 2рх – орбиталей образуются следующие молекулярные орбитали: σсв (2рх) и σразр (2рх)
Из перечисленных ниже характеристик атомов элементов периодически изменяются:число электронов на внешнем энергетическом уровне;
Из приведенного перечня элементов - Li, Na, Ag, Au, Ca, Ba- к щелочным металлам относятся:Li, Na;
Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра, равным: +16
Испускание ядром α-частицы происходит в случае:  U→
U→  Th
Th
Испускание ядром позитрона происходит в случае:  F →
F →  О
О
К
К какому классу комплексных соединений относится желтая кровяная соль: К ацидокомплексам;
К какому классу комплексных соединений относится красная кровяная соль:К ацидокомплексам
К какому классу комплексных соединений относится медный купорос:Гидратам;
К металлам не относится последовательность элементов: B, As, Te;
Как изменяется сила галогено–водородных кислот с увеличением порядкового номера галогена:
Как можно осуществить превращение в растворе: AI3+ → [AI(OH)6]3- добавлением избытка щелочи
Как можно осуществить превращение в растворе: Zn2+ → Zn (OH)42- добавлением избытка щелочи
Как называется тепловой эффект процесса, протекающего при постоянном давлении:Энтальпией;
Как называются реакции, в которых одно вещество является окислителем,а другое–восстановителем: Межмолекулярные окислительно – восстановительные реакции;
Как называются реакции, в результате которых один и тот же элемент и окисляется и восстанавливается: Реакции диспропорционирования
Как по электронной формуле элемента определить период, в котором находится данный элемент:по значению главного квантового числа внешнего энергетического уровня;
Какая группа веществ может реагировать с гидроксидом натрия? SO2. BaSO4, H3PO4;
Какая группа гидроксидов проявляет амфотерные свойства? Zn(OH)2, Al(OH)3;
Какая запись выражает количество вещества аммиака? v(NH3) = 1 моль;
Какая запись отражает относительную молекулярную массу серной кислоты? M(H2 SO4)=98
Какая из атомных орбиталей имеет наибольшее значение суммы (n + l): 4f
Какая из атомных орбиталей имеет наименьшее значение суммы (n + l): 4s
Какая из молекул является наиболее прочной? N2
Какая из приведенных кислот может образовывать кислые соли: H3PO4
Какая из солей подвергается полному гидролизу: (NH4)2S;
Какая из солей подвергается полному гидролизу: MqS;
Какая из указанных молекул имеет наибольший диполь? HF
Какая из указанных реакций является эндотермической? ZnSO4 = ZnO + SO3;∆H0 = +234,0 кДж
Какая из указанных систем является гомогеннойраствор хлорида натрия
Какая из указанных частиц является типичным комплексообразователем:Fe3+
Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона: Са2+
Какая кислота двухосновная?угольная;
Какая кислота не образует кислых солей:метафосфорная кислота;
Какая кислота образует два типа кислых солей:ортофосфорная кислота;
Какая кислота трехосновная?фосфорная;
Какая масса известняка необходима для получения 112 кг не гашенной извести: 200
Какая масса (г) карбоната кальция будет израсходована для получения 44,8 л углекислого газа, измеренного при н.у.: 200,0
Какая масса хлорида натрия необходима для получения при электролизе 44,8 л Cl2: 234 г;
Какая постоянная величина характеризует устойчивость комплексного иона в растворе:Константа нестойкости;
Какая реакция не будет протекать? CuO + H2O→



 ; 2bo
; 2bo ;
; :
: 2СО (г.) -119,8 кДж:повышение Т и понижение Р;
2СО (г.) -119,8 кДж:повышение Т и понижение Р; . Где находится этот элемент в периодической системе? 5 период, шестая группа главная подгруппа
. Где находится этот элемент в периодической системе? 5 период, шестая группа главная подгруппа образуется изотоп:
образуется изотоп: 
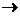 Cr2(SO4)3+O2+K2SO4+H2O
Cr2(SO4)3+O2+K2SO4+H2O U→
U→  Th
Th F →
F →  О
О


