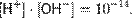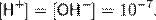Слева направо по периоду у элементов происходит ослабление металлических свойств, и усиление неметаллических свойств, основные свойства оксидов ослабевают, а кислотные свойства оксидов возрастают.По главным подгруппам неметаллические свойства элементов ослабевают, а металлические усиливаются, поэтому: сверху вниз по главной подгруппе возрастают основанные свойства оксидов, а кислотные ослабевают.
Обратите внимание! Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Например:  и
и  – первый оксид основной, а второй амфотерный.
– первый оксид основной, а второй амфотерный. 
 ,
,  – первый оксид основной, второй – амфотерный, последний – кислотный.
– первый оксид основной, второй – амфотерный, последний – кислотный.
. Характер изменения свойств оснований в зависимости от положения металла в периодической системе и его степени окисления
По периоду слева направо наблюдается постепенное ослабление основных свойств гидроксидов.
Например, 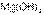 более слабое основание, чем
более слабое основание, чем  , но более сильное основание, чем
, но более сильное основание, чем 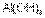 .
.
По главным подгруппам сверху вниз сила оснований возрастает. Так,  – более сильное основание, чем
– более сильное основание, чем  , но
, но 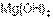 – более сильное основание, чем
– более сильное основание, чем  .
.
Если металл образует несколько гидроксидов, находясь в различной степени окисления, то чем выше степень окисления металла, тем более слабыми основными свойствами обладает гидроксид.
Так,  более слабое основание, чем
более слабое основание, чем  .
.
. Зависимость силы кислот от положения элемента в периодической системе и его степени окисления
По периоду для кислородосодержащих кислот слева направо возрастает сила кислот.
Так,  более сильная, чем
более сильная, чем  ; в свою очередь,
; в свою очередь,  более сильная, чем
более сильная, чем  .
.
По группе кислородосодержащих кислот сверху вниз сила кислот уменьшается. Так угольная 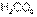 более сильная, чем кремниевая
более сильная, чем кремниевая 
Чем выше степень окисления кислотообразующего элемента, тем сильнее кислота:
 ,серная кислота сильнее, чем сернистая.
,серная кислота сильнее, чем сернистая.
Сила бескислородных кислот в главных подгруппах с ростом атомного номера элемента возрастает:
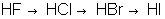 ,
,

 СИЛА КИСЛОТ РАСТЕТ
СИЛА КИСЛОТ РАСТЕТ
По периоду слева направо сила бескислородных кислот возрастает. Так  более сильная кислота, чем
более сильная кислота, чем  , а
, а  – чем
– чем 
20 Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенной называется реакция протекающая в однородной среде. Гетерогенной называется реакция, протекающая на границе раздела фаз, например твердой и жидкой, твердой и газообразной. Vпрям= -dc\dτ Vобр= dc\dτ. Vпрям=Кпр[А]^а*[В]^в Vобр= Кобр[D]^d*[L]^l. Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществвзятых в коэффициентах перед формулами-закон действующих масс.. Концентрация-это количество вещества в единице массы или объема.
Химические реакции очень редко бывают простыми. Большинство из них включает сложную последовательность отдельных стадий - так называемых элементарных реакций. Что представляют собой элементарные реакции? На простейшем уровне можно сказать, что реакция, которую нельзя разбить на более простые, называется элементарной. Существует и другое определение, имеющее более ясный химический смысл:
Элементарная химическая реакция - это единичный акт разрыва и (или) образования химических связей.
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Для простых реакций равен стехиометрическому коэффициенту.
21 Скорость любой реакции возрастает при увеличении температуры. По п равилу Ван-Гоффа - С повышением температуры на 10С скорость реакций возрастает в 2-4 раза.
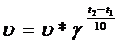 увеличение скорости объясняется, тем, что возрастает скорость движения молекул, а следовательно и количество столкновений в единицу времени. Энергией активации – наз. избыток энергии по сравнению со средней энергией молекул при данной температуре, которым они должны обладать, чтобы произошла реакция между ними, энергия, необходимая для перехода вещества в состояние активированного комплекса. Возможность образования активированного комплекса, а соответственно и хим. взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. С ростом температуры растёт доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции Уравнение Аррениуса описывает более строгую зависимость скорости от температуры.
увеличение скорости объясняется, тем, что возрастает скорость движения молекул, а следовательно и количество столкновений в единицу времени. Энергией активации – наз. избыток энергии по сравнению со средней энергией молекул при данной температуре, которым они должны обладать, чтобы произошла реакция между ними, энергия, необходимая для перехода вещества в состояние активированного комплекса. Возможность образования активированного комплекса, а соответственно и хим. взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. С ростом температуры растёт доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции Уравнение Аррениуса описывает более строгую зависимость скорости от температуры.  , k – константа скорости, Т – абсолютная температура, K; R – газовая постоянная, А – стерический множитель, который пропорционален количеству столкновений. Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)
, k – константа скорости, Т – абсолютная температура, K; R – газовая постоянная, А – стерический множитель, который пропорционален количеству столкновений. Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)
NO2+SO2=SO3 (продукт)+NO(катализатор). Геторогенный катализ. Реагирующие вещества и катализатор составляют неоднородную, многофазную систему, в которой катализатор находится в виде отдельной фазы. Примеры: синтез аммиака 
Реакции делятся на экзотермические (энергия выд.) и эндотермические (энергия погл)

22 Закон действующих масс для обратимых реакций.
Реакцию называют обратимой, если её направление зависит от концентраций веществ — участников реакции. Например, в случае гетерогенно-каталитической реакции. N2 + 3H2 = 2NH3. Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость

Химическое равновесие – состояние системы при котором скорости прямой и обратной реакции равны.  Выводится из равенства скоростей прямой и обратной реакций и выражается константой равновесия К. Для обратимой реакции в общем виде
Выводится из равенства скоростей прямой и обратной реакций и выражается константой равновесия К. Для обратимой реакции в общем виде 
Принцип Ле-Шателье-Брауна. Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие сдвигается в направлении, ослабляющем это воздействие. Реакции с участием газообразных веществ. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема.
 уменьшение объема
уменьшение объема
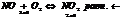 увеличение объема
увеличение объема
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении в сторону экзотермической.  Повышение Т
Повышение Т
 понижение Т. При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ - в сторону обратной реакции.
понижение Т. При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ - в сторону обратной реакции.
23-24
Внутренняя энергия (U) – функция состояния системы, являющаяся совокупностью всех видов энергии составляющих ее частиц. Складывается из кинетической энергии и потенциальной энергии. Закон сохранения энергии – энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой. Изменение энергии изолированной системы = 0. Теплота сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил. 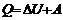 . Для реакций протекающих при постоянном объеме (изохорные), тепло поступающее в систему идет на увеличение внутренней энергии
. Для реакций протекающих при постоянном объеме (изохорные), тепло поступающее в систему идет на увеличение внутренней энергии  . При постоянном давлении (изобарные) тепло идет на увеличение внутренней энергии, расширение системы. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.
. При постоянном давлении (изобарные) тепло идет на увеличение внутренней энергии, расширение системы. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.  . При постоянном давлении
. При постоянном давлении  . Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение D U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии. Законы термохимии:
. Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение D U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии. Законы термохимии:
1. Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения.
2. Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
следствие Гесса. Изменение энтальпии хим. реакции = разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных.веществ. 
Стандартной энтальпией образования называется изобарный тепловой эффект реакции получения одного моля сложного вещества из простых веществ, взятых в их наиболее устойчивой форме при стандартных условиях (T=298К, p=1 атм., С=1 моль/л). Энтальпия образования простых веществ в их устойчивом состоянии при стандартных условиях принимается равной 0.
25.
Энтропия. (S, дж./моль К) функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности.  , где W – термодинамическая вероятность- число возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние, К – постоянная Больцмана (К = 1,38*10-23). В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии
, где W – термодинамическая вероятность- число возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние, К – постоянная Больцмана (К = 1,38*10-23). В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии

26
Свободная энергия Гиббса. Направление течения процесса. Анализ уравнения энергии Гиббса. Влияние энтальпийного и энтропийного факторов на направление протекания процессов.
Энергия Гиббса – функция состояния системы, = максимальной ее работе в изобарном изотермическом процессе. Связана с энтальпией и энтропией  , где Т абсолютная температура,К. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.
, где Т абсолютная температура,К. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.  . Энтропия -функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности. В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии. Для процессов, протекающих при постоянной температуре и давлениидавлении энергия Гиббса
. Энтропия -функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности. В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии. Для процессов, протекающих при постоянной температуре и давлениидавлении энергия Гиббса  . Общим критерием самопроизвольного протекания химического процесса является уменьшение энергии Гиббса
. Общим критерием самопроизвольного протекания химического процесса является уменьшение энергии Гиббса  анализ показывает, что для эндотермических реакций
анализ показывает, что для эндотермических реакций 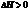 сопровождающихся увеличением беспорядка в системе при высоких температурах. В случае экзотермических реакций
сопровождающихся увеличением беспорядка в системе при высоких температурах. В случае экзотермических реакций  сопровождающихся уменьшением беспорядка при низких температурах. Если
сопровождающихся уменьшением беспорядка при низких температурах. Если  ,то процесс в прямом направлении невозможен, идет обратная реакция.
,то процесс в прямом направлении невозможен, идет обратная реакция.
Для  , как функции состояния
, как функции состояния  .
.
27
При  процесс идет самопроизвольно в прямом направление, если потенциал уменьшается следовательно константа равновесия больше 1. Концентрация продуктов > концентрации исходных веществ. Если наоборот, то реакция практически не шла. При повышении температуры равновесие сместиться в сторону эндотермической реакции, при понижении в сторону экзотермической. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции.
процесс идет самопроизвольно в прямом направление, если потенциал уменьшается следовательно константа равновесия больше 1. Концентрация продуктов > концентрации исходных веществ. Если наоборот, то реакция практически не шла. При повышении температуры равновесие сместиться в сторону эндотермической реакции, при понижении в сторону экзотермической. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции.
28
Растворы – однородные системы, состоящие из двух и более компонентов и продуктов их взаимодействия. Растворы бывают Насыщенный раствор находится в равновесии с твердой фазой растворенного вещества. Ненасыщенный – концентрация раствора меньше концентрации насыщенного раствора. Перенасыщенный – содержит вещества больше чем надо для насыщения раствора (неустойчивая система). Образование раствора происходит самопроизвольно. Величина уменьшения термодинамического потенциала зависит от состава раствора. Растворение – химические взаимодействие между молекулами растворителя и растворяемого вещества. Концентрация раствора – количество растворенного вещества, содержащиеся в определенном количестве раствора. Массовая доля – отношение массы вещества к массе раствора.  в долях единицы. Молярная доля – отношение количества вещества компонента системы к сумме количеств веществ компонентов
в долях единицы. Молярная доля – отношение количества вещества компонента системы к сумме количеств веществ компонентов  Моляльная концентрация – отношение количества вещества растворенного соединения к массе растворителя
Моляльная концентрация – отношение количества вещества растворенного соединения к массе растворителя 
Молярная концентрация – отношение количества вещества растворенного соединения к объему раствора.  . Молярная концентрация эквивалента – отношение количества вещества эквивалента растворенного соединения к объему раствора.
. Молярная концентрация эквивалента – отношение количества вещества эквивалента растворенного соединения к объему раствора.  . В случае когда реагируют в равных объемах С1/Z*1V1= С1/Z*2V2
. В случае когда реагируют в равных объемах С1/Z*1V1= С1/Z*2V2
Идеальный раствор. Законы Рауля. Понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения растворов неэлектролитов.
Растворы - это однородные системы, состоящие из двух и более компонентов и продуктов их взаимодействии. Давлениемнасыщенного пара жидкости наз. давление, которое установилось над жидкостью, когда скорость испарения жидкости = скорости конденсации пара в жидкость. 1 закон Рауля. Относительное понижение давления пара растворителя над раствором = мольной доле растворенного вещества  Растворы подчиняющиеся этому закону называются идеальными. Растворы всегда кипят при более высокой температуре, чем чистый растворитель, при увеличении концентрации растворенного вещества повышается температура кипения. 2 закон Рауля. Эбулиоскопический. Повышение температуры кипения раствора неэлектролита пропорционально моляльной концентрации растворенного вещества.
Растворы подчиняющиеся этому закону называются идеальными. Растворы всегда кипят при более высокой температуре, чем чистый растворитель, при увеличении концентрации растворенного вещества повышается температура кипения. 2 закон Рауля. Эбулиоскопический. Повышение температуры кипения раствора неэлектролита пропорционально моляльной концентрации растворенного вещества.  , Е эбуллиоскопическая константа. Постоянна для каждого растворителя и не зависит от того, какой неэлектролит растворен. Е= повышению температуры кипения, вызываемому 1 молем вещества, растворенным в 1000 г. растворителя. Криоскопический. Понижение температуры замерзания раствора неэлектролита пропорционально мольльной концентрации растворенного вещества.
, Е эбуллиоскопическая константа. Постоянна для каждого растворителя и не зависит от того, какой неэлектролит растворен. Е= повышению температуры кипения, вызываемому 1 молем вещества, растворенным в 1000 г. растворителя. Криоскопический. Понижение температуры замерзания раствора неэлектролита пропорционально мольльной концентрации растворенного вещества.  , К криоскопическая константа постоянна для каждого растворителя и = понижению температуры замерзания растворов в которых на 1000 г. растворителя приходится 1 моль растворенного неэлектролита.
, К криоскопическая константа постоянна для каждого растворителя и = понижению температуры замерзания растворов в которых на 1000 г. растворителя приходится 1 моль растворенного неэлектролита.
Общими являются свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных веществ. Они также называются коллигативными. Такие свойства могут появлятся в полной мере в идеальных растворах. Идеальным называют раствор, в котором не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Соответственно, образование этих растворов не сопровождается тепловым эффектом (/\Н=0) и каждый компонент ведет себя в растворе независимо от других компонентов. К идеальным растворам относятся лишь очень разбавленные растворы, т.е. растворы с очень низкой концентрацией растворенного вещества. К общим свойствам растворов относится понижение давления насыщенного пара растворителя над раствором и температуры замерзания, повышение температуры кипения и осмотическое давление. Эти свойства проявляются в случае растворов нелетучих растворенных веществ, т.е. веществ, давлением паров которых можно пренебречь
Если процесссольватации протекает до стадии АВ(n+m)Sß à Ap+nS+Bq-mS, то система является раствором электролита, т.е имеет место электролитическая диссоциация с образованием ионов Уравнение электролитической реакции можно записать, опустив промежуточные стадии, указав лишь начальные и конечные продукты реакции. АВ(n+m)Sß à Ap+nS+Bq-mS Например, процесс диссоциации уксусной кислоты в воде протекает следующим образом: CH3COOH+(n+m)H2OàßCH3COOH- * nH2O+H+*mH2O. При растворении ионного соединения процесс сольвации, в результате которого происходит электролитическая диссоциация, может протекать практически необратимо: Ap+ Bq-+(n+m)Sà Ap+nS+ Bq-mS.
Однако часто в подобных уравнениях опускают молекулы растворителя (n+m)S, записывая х в таком виде Ap+ Bq-à Ap++ Bq-/ Электролитическая диссоциация это распад молекулы с полярным или ионным типом связи под действием полярных молекул растворителя. Сильные электролиты это электролиты степень диссоциации которых составляет (100-30%) HCL KOH LiOH NaOH соли. Слабые электролиты альфа <0,3% HF HiS NH4OH H2CO3
Сильные электролиты. Активность. Ионная сила растворов.
Такие соединения как правило, диссоциируют нацело. Классификация. Кислота электролит диссоциирующий в растворе с образованием катионов. Основания электролит диссоциирующий в растворе с образованиемгидроксид-онионов. Соль электролит диссоциирующий в растворе с образованиемкатионов металла и анионов кислотного осадка. Активность – эффективная концентрация вещества в растворе в соответствии с которой оно участвует в различных процессах а=f/С, где f - коэффициент активности, С – концентрация. Ионная сила. 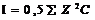 ,
,  .
.
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Отношение числа молекул, диссоциированных на ионы, к общему числу молекул растворённого электролита называется степенью диссоциации α.
Электролиты, степень диссоциации которых в растворах меньше единицы и уменьшается с ростом концентрации, называют слабыми электролитами. К ним относят воду, ряд кислот, основания p-, d-, f-элементов. В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации кислоты HA ↔ H + A константа равновесия Кс равна Кс = Кд = ([H][A])/[HA].
Константа равновесия для процесса диссоциации называется константой диссоциации Кд. Например, константа диссоциации уксусной кислоты CH3COOH равна
Кд = ([H][CH3COO])/[CH3COOH]. C повышением температуры константа диссоциации обычно уменьшается, что в соответствие с принципов Ле-Шателье свидетельствует об экзотермическим характере реакции. Константа диссоциации указывает на прочность молекул в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Степень диссоциации α изменяется с концентрацией раствора. Рассмотрим зависимость степень диссоциации от концентрации слабого электролита на примере уксусной кислоты.
CH3COOH ↔ CH3COO + H. Принимая исходную концентрацию кислоты равной c, а степень диссоциации α, получаем, что концентрация части кислоты, которая диссоциирована, будет равна αc. Концентрация кислоты, оставшейся в недиссоциированном состоянии, будет равна c – αс = c(1 – α). Подставив значения равновесных концентраций ионов и кислоты в уравнение константы диссоциации, получим: Кд = (α²c²)/c(1 – α) = (α²c)/(1-α) = α²/(1-α)V, где V = 1/c. Это уравнение было получено Оствальдом и называется законом Оствальда. Если α << 1, то уравнение упрощается: Кд ≈ α²c и α≈√Кд/c. Это уравнение называется законом разбавления Оствальда. Из него следует, что степень диссоциации уменьшается с увеличением концентрации слабого электролита. Изотонический коэффициент характерезует отклонение от законов идеальных растворов вследствие электролитической диссоциации электролитов.
Диссоциация воды
Вода представляет собой слабый электролит, диссоциирующий в соответствии с уравнением

Константа диссоциации воды при 25 °C составляет

Считая, что в большинстве растворов вода находится в молекулярном виде (концентрация ионов H+ и OH− мала), и учитывая, что молярная масса воды составляет 18,0153 г/моль, а плотность при температуре 25 °C — 997,07 г/л, чистой воде соответствует концентрация [H2O] = 55,346 моль/л. Поэтому предыдущее уравнение можно переписать в виде
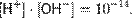
Эта величина называется ионным произведением воды. Так как для чистой воды [H+] = [OH−], можно записать
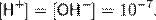
Водородный показатель воды, таким образом, равен

33.
Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находят осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадать со скоростью обратного процесса кристаллизации.
AnBm(т) ↔ nAm+ + mBn-.
Произведение активностей ионов электролита, содержащихся в его насыщенном растворе при данной температуре, есть величина постоянная. Эту величину называют произведением растворимости электролита и обозначают ПР. как константа равновесия, произведение растворимости зависит от природы растворённого вещества и растворителя, а также от температуры и не зависит от активностей ионов в растворе.
Связь между ПР и растворимостью cp выразиться уравнением:
ПР=(nCрgАm+)n(mCрgBn-)m
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли растворе появляется некоторое избыточное количество ионов H+ и OH¯, сообщающее раствору кислотные или щелочные свойства. Таким образом, процесс гидролиза соли во многом обратен процессу нейтрализации, т.е. процессу взаимодействия кислот с основаниями. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например KCl.
Гальванический элемент Даниэля – Якоби состоит из медной пластины, погружённой в раствор CuSO4, и цинковой пластины, погружённой в раствор ZnSO4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой. На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие Zn ↔ Zn2+ + 2e¯. В результате протекания этого процесса возникает электродный потенциал цинка. На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие Cu ↔ Cu2+ + 2e¯ поэтому возникает электродный потенциал меди. Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т.е. при соединении цинка с медью металлическим проводником электроны будут переходить от цинка к меди. В результате перехода электронов от цинка к меди равновесие на цинковом электроде сместится вправо, поэтому в раствор перейдёт дополнительное количество ионов цинка. В то же время равновесие на медном электроде сместится влево и произойдёт разряд ионов меди. При работе гальванического элемента Даниэля – Якоби протекают след. процессы: 1. реакция окисления цинка Zn – 2e → Zn2+. Процессы окисления в химии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами; 2. реакция восстановления ионов меди Cu2+ + 2e → Cu. Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами; 3. движение электронов во внешней цепи; 4. движение ионов в растворе: анионов (SO42-) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем
Zn + Cu2+ = Cu + Zn2+. Вследствие этой хим. реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток, поэтому суммарная хим. реакция, протекающая в гальваническом элементе, называется токообразующей.
Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой (ЭДС). Стандартной называется ЭДС элемента, если парциальное относительное давление исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакций равны единице. Еэ=-[ΔG/(n*F)]
ΔG= ΔG0-R*T*ln (aBb*aDd/aLl*aQq).
Устройства, в которых электрическая энергия превращается в химическую, а химическая снова в электрическую называют аккумуляторами. В аккумуляторах под воздействием внешнего источника тока накапливается химическая энергия, которая затем переходит в электрическую. Процесс накопления химической энергии называют зарядом аккумулятора, процесс превращения химической энергии в электрическую называют разрядом аккумулятора. При заряде аккумулятор работает как электролизер при разряде как гальванический элемент. Процессы заряда и разряда осуществляются многократно. Аккумулятор имеет два электрода (катод и анод) и ионный проводник между ними. На аноде как при разряде, так и при заряде протекают реакции окисления, на катоде реакции восстановления. В настоящее время наиболее распространенными являются свинцовые аккумуляторы, в которых в качестве электролита используется раствор Н2SO4, поэтому они называются еще кислотными. Электроды кислотного аккумулятора обычно представляют собой свинцовые решетки. Решетки вначале заполняют оксидом свинца, который при взаимодействии с серной кислотой превращается в PbSO4. Электроды разделены друг от друга раствором серной кислоты и пористыми сепараторами. Аккумуляторы соединяют в батарею, которая помещается в банки из эбонита или полипропилена. Свинцовый аккумулятор обладает существенными достоинствами: высокий КПД (около 80%) высокий ЭДС с относительно малым изменением его при разряде. Простой и не дорогой. высокий ЭДС с относительно малым изменением его при разряде. Простой и не дорогой. Недостатки саморазряд срок службы 2-5 лет. Промышленность выпускает щелочные аккумуляторы. Наиболее распространенные из них никель-кадмиевые и никель-железные аккумуляторы. Положительный электрод содержит гидроксид никеля а отрицательный кадмий или железо. Ионным проводником служит 20-30% раствор КОН. К достоинствам никель-кадмиевых и никель-железных аккумуляторов относится большой срок службы 10 лет. И высокая механическая прочность, к недостаткам – невысокие КПД и напряжение. Они применяются для питания электрокаров.



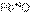 и
и 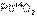 – первый оксид основной, а второй амфотерный.
– первый оксид основной, а второй амфотерный. 
 ,
,  – первый оксид основной, второй – амфотерный, последний – кислотный.
– первый оксид основной, второй – амфотерный, последний – кислотный.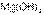 более слабое основание, чем
более слабое основание, чем  , но более сильное основание, чем
, но более сильное основание, чем 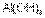 .
. – более сильное основание, чем
– более сильное основание, чем  , но
, но 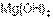 – более сильное основание, чем
– более сильное основание, чем  .
. более слабое основание, чем
более слабое основание, чем  .
. более сильная, чем
более сильная, чем  ; в свою очередь,
; в свою очередь,  более сильная, чем
более сильная, чем  .
.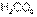 более сильная, чем кремниевая
более сильная, чем кремниевая 
 ,серная кислота сильнее, чем сернистая.
,серная кислота сильнее, чем сернистая.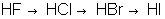 ,
,
 СИЛА КИСЛОТ РАСТЕТ
СИЛА КИСЛОТ РАСТЕТ более сильная кислота, чем
более сильная кислота, чем  , а
, а  – чем
– чем 
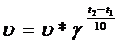 увеличение скорости объясняется, тем, что возрастает скорость движения молекул, а следовательно и количество столкновений в единицу времени. Энергией активации – наз. избыток энергии по сравнению со средней энергией молекул при данной температуре, которым они должны обладать, чтобы произошла реакция между ними, энергия, необходимая для перехода вещества в состояние активированного комплекса. Возможность образования активированного комплекса, а соответственно и хим. взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. С ростом температуры растёт доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции Уравнение Аррениуса описывает более строгую зависимость скорости от температуры.
увеличение скорости объясняется, тем, что возрастает скорость движения молекул, а следовательно и количество столкновений в единицу времени. Энергией активации – наз. избыток энергии по сравнению со средней энергией молекул при данной температуре, которым они должны обладать, чтобы произошла реакция между ними, энергия, необходимая для перехода вещества в состояние активированного комплекса. Возможность образования активированного комплекса, а соответственно и хим. взаимодействия, определяется энергией молекул. Молекула, энергия которой достаточна для образования активированного комплекса, называется активной. С ростом температуры растёт доля этих частиц и соответственно скорость реакции. С увеличением энергии активации уменьшается доля активных молекул и скорость реакции Уравнение Аррениуса описывает более строгую зависимость скорости от температуры.  , k – константа скорости, Т – абсолютная температура, K; R – газовая постоянная, А – стерический множитель, который пропорционален количеству столкновений. Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)
, k – константа скорости, Т – абсолютная температура, K; R – газовая постоянная, А – стерический множитель, который пропорционален количеству столкновений. Катализаторы – вещества, изменяющие скорость реакции, но не расходующиеся в процессе реакции. Могут увеличивать скорость реакции (активаторы) или замедлять (ингибиторы). Бывают твердыми, жидкими и газообразными. Гомогенный катализ. Реагирующие вещества и катализатор образуют однородную, однофазную систему. Например: 2SO2+O2=2SO3 Механизм катализа объясняется образованием промежуточного соединения катализатора с одним из реагирующих веществ. Схема действия катализатора в две стадии O2+2NO(катализатор)=2NO(пром. соединение)


 Выводится из равенства скоростей прямой и обратной реакций и выражается константой равновесия К. Для обратимой реакции в общем виде
Выводится из равенства скоростей прямой и обратной реакций и выражается константой равновесия К. Для обратимой реакции в общем виде 
 уменьшение объема
уменьшение объема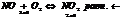 увеличение объема
увеличение объема Повышение Т
Повышение Т понижение Т. При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ - в сторону обратной реакции.
понижение Т. При увеличении концентрации исходных веществ или уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции или уменьшении концентрации исходных веществ - в сторону обратной реакции.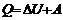 . Для реакций протекающих при постоянном объеме (изохорные), тепло поступающее в систему идет на увеличение внутренней энергии
. Для реакций протекающих при постоянном объеме (изохорные), тепло поступающее в систему идет на увеличение внутренней энергии  . При постоянном давлении (изобарные) тепло идет на увеличение внутренней энергии, расширение системы. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.
. При постоянном давлении (изобарные) тепло идет на увеличение внутренней энергии, расширение системы. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.  . При постоянном давлении
. При постоянном давлении  . Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение D U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии. Законы термохимии:
. Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменение D U), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпии. Законы термохимии:
 , где W – термодинамическая вероятность- число возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние, К – постоянная Больцмана (К = 1,38*10-23). В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии
, где W – термодинамическая вероятность- число возможных микросостояний (способов) с помощью которых можно перейти в данное макроскопическое состояние, К – постоянная Больцмана (К = 1,38*10-23). В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии
 , где Т абсолютная температура,К. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.
, где Т абсолютная температура,К. Энтальпия – функция состояния равная внутренней энергии системы + работа расширения.  . Энтропия -функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности. В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии. Для процессов, протекающих при постоянной температуре и давлениидавлении энергия Гиббса
. Энтропия -функция состояния системы, являющаяся термодинамической мерой ее неупорядоченности. В изолированной системе самопроизвольные процессы могут протекать только в направлении увеличения энтропии. Для процессов, протекающих при постоянной температуре и давлениидавлении энергия Гиббса  . Общим критерием самопроизвольного протекания химического процесса является уменьшение энергии Гиббса
. Общим критерием самопроизвольного протекания химического процесса является уменьшение энергии Гиббса  анализ показывает, что для эндотермических реакций
анализ показывает, что для эндотермических реакций 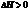 сопровождающихся увеличением беспорядка в системе при высоких температурах. В случае экзотермических реакций
сопровождающихся увеличением беспорядка в системе при высоких температурах. В случае экзотермических реакций  сопровождающихся уменьшением беспорядка при низких температурах. Если
сопровождающихся уменьшением беспорядка при низких температурах. Если  ,то процесс в прямом направлении невозможен, идет обратная реакция.
,то процесс в прямом направлении невозможен, идет обратная реакция. , как функции состояния
, как функции состояния  .
. процесс идет самопроизвольно в прямом направление, если потенциал уменьшается следовательно константа равновесия больше 1. Концентрация продуктов > концентрации исходных веществ. Если наоборот, то реакция практически не шла. При повышении температуры равновесие сместиться в сторону эндотермической реакции, при понижении в сторону экзотермической. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции.
процесс идет самопроизвольно в прямом направление, если потенциал уменьшается следовательно константа равновесия больше 1. Концентрация продуктов > концентрации исходных веществ. Если наоборот, то реакция практически не шла. При повышении температуры равновесие сместиться в сторону эндотермической реакции, при понижении в сторону экзотермической. При увеличении давления равновесие смещается в направлении реакции, идущей с уменьшением объема газообразных веществ, при понижении давления в сторону реакции идущей с увеличением объема. При увеличении концентрации исходных веществ равновесие смещается в сторону прямой реакции. в долях единицы. Молярная доля – отношение количества вещества компонента системы к сумме количеств веществ компонентов
в долях единицы. Молярная доля – отношение количества вещества компонента системы к сумме количеств веществ компонентов  Моляльная концентрация – отношение количества вещества растворенного соединения к массе растворителя
Моляльная концентрация – отношение количества вещества растворенного соединения к массе растворителя 
 . Молярная концентрация эквивалента – отношение количества вещества эквивалента растворенного соединения к объему раствора.
. Молярная концентрация эквивалента – отношение количества вещества эквивалента растворенного соединения к объему раствора.  . В случае когда реагируют в равных объемах С1/Z*1V1= С1/Z*2V2
. В случае когда реагируют в равных объемах С1/Z*1V1= С1/Z*2V2 Растворы подчиняющиеся этому закону называются идеальными. Растворы всегда кипят при более высокой температуре, чем чистый растворитель, при увеличении концентрации растворенного вещества повышается температура кипения. 2 закон Рауля. Эбулиоскопический. Повышение температуры кипения раствора неэлектролита пропорционально моляльной концентрации растворенного вещества.
Растворы подчиняющиеся этому закону называются идеальными. Растворы всегда кипят при более высокой температуре, чем чистый растворитель, при увеличении концентрации растворенного вещества повышается температура кипения. 2 закон Рауля. Эбулиоскопический. Повышение температуры кипения раствора неэлектролита пропорционально моляльной концентрации растворенного вещества.  , Е эбуллиоскопическая константа. Постоянна для каждого растворителя и не зависит от того, какой неэлектролит растворен. Е= повышению температуры кипения, вызываемому 1 молем вещества, растворенным в 1000 г. растворителя. Криоскопический. Понижение температуры замерзания раствора неэлектролита пропорционально мольльной концентрации растворенного вещества.
, Е эбуллиоскопическая константа. Постоянна для каждого растворителя и не зависит от того, какой неэлектролит растворен. Е= повышению температуры кипения, вызываемому 1 молем вещества, растворенным в 1000 г. растворителя. Криоскопический. Понижение температуры замерзания раствора неэлектролита пропорционально мольльной концентрации растворенного вещества.  , К криоскопическая константа постоянна для каждого растворителя и = понижению температуры замерзания растворов в которых на 1000 г. растворителя приходится 1 моль растворенного неэлектролита.
, К криоскопическая константа постоянна для каждого растворителя и = понижению температуры замерзания растворов в которых на 1000 г. растворителя приходится 1 моль растворенного неэлектролита.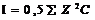 ,
,  .
.