Современные представления о строении атома. Состояние электрона в атоме. Квантовые числа. Строение электронных оболочек атомов.
Строение атома
Резерфорд предложил ядерную модель атома, согласно которой атом состоит из сравнительно небольшого положительно заряженного ядра, в котором сосредоточена практически вся масса атома, и расположенных вокруг ядра электронов, составляющих электронную оболочку атома, которая занимает практически весь его объем.
Мозли установил, что заряд ядра численно равен порядковому номеру элемента в периодической системе.
Таким образом, заряд ядра атома стал главной характеристикой химического элемента.
Химический элемент — это множество атомов с одинаковым зарядом ядра.
Отсюда следует современная формулировка периодического за-кона: Свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядер их атомов.
Состояние электрона
Теория Бора позволила точно вычислить частоты в спектрах атома водорода и других одноэлектронных систем, т. е. таких ионов, как гелий, литий, берилий.
Квантово-механическая теория содержит два основных положения.
1. Электрон имеет двойственную природу. Он обладает свойствами и частицы, и волны одновременно. Как частица электрон имеет массу и заряд, однако движение электронов - это волновой процесс. Электронам свойственно явление дифракции (поток электронов огибает препятствие).
2. Положение электрона в атоме неопределенно. Это означает, что невозможно одновременно точно определить и скорость электрона, и его координаты в пространстве.
— энергию электрона в атоме (точнее, энергию системы, со-стоящей из этого электрона, других электронов и ядра;
— форму образуемого данным электроном электронного облака.
Квантовое число
Главное квантовое число (п) характеризует энергетический уровень и определяет размер электронного облака, т. е. среднее расстояние электрона от ядра; принимает целочисленные значения 1, 2, 3,..., п, которые соответствуют номеру энергетического уровня. Чем больше п, тем выше энергия электрона, следовательно, минимальная энергия соответствует первому уровню (п = 1).
Орбитальное или побочное квантовое число (l) характеризует энергетический подуровень и определяет форму электронного облака; принимает целочисленные значения от 0 до (п - 1). Его значения обычно обозначаются буквами: s p d f
Магнитное квантовое число (ml) характеризует ориентацию электронного облака в магнитном поле; принимает целочисленные значения от – l до +l:
ml = – l,..., 0,..., +l (всего 2l + 1 значений).
ml = 2l + 1
Исследование атомных спектров показало, что помимо квантовых чисел n, l, ml, электрон характеризуется ещё одной квантованной величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное движение. Эта величина получила название спинового квантового числа (ms). У электрона спиновое квантовое число может принимать два значения: ms = +1/2 и ms = -1/2.
строение оболочки
| Энергетический
уровень,
n
| Энергетический
подуровень,
l
| Орбиталь,
n, l, ml
| К-во
электронов на уровне
|
n=1

| l=0, (S)
| 1S (1 орбит.)
| 2 электр.
|
n=2

| l=0, (S)
l=1, (p)
| 2S (1 орбит.)
2p (3 орбит.)
| 2 электр.+
6 электр.=
8 электр.
|
n=3

| l=0, (S)
l=1, (p)
l=2 (d)
| 3S (1 орбит.)
3p (2 орбит.)
3d (5 орбит.)
| 2 электр.+
6 электр.+
10 электр.=
18 электр.
|
n=4

| l=0, (S)
l=1, (p)
l=2 (d)
l=3 (f)
| 4S (1 орбит.)
4p (2 орбит.)
4d (5 орбит.)
4f (7 орбит.)
| 2 электр.+
6 электр.+
10 электр.+
14 электр.= 32 электр.
|
3. Периодический закон и периодическая система Д.И.Менделеева.
Периодический закон был открыт Д. И. Менделеевым в 1869 г.
Первоначальная формулировка Периодического закона:
Свойства элементов, а также свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины атомных масс элементов.
Открытие периодического закона дало Менделееву основу для системы классификации химических элементов и созданию Периодической системы.
Менделеев смог создать объективную основу для классификации элементов. Этой основой оказалась атомная масса химических элементов, которая в то время была изучена. Он расположил известные в то время 63 элемента в порядке возрастания их атомных масс и обратил внимание на то, что в рядах через определенное число элементов их свойства периодически повторяются.
Расположив столбцами группы элементов, Менделеев обнаружил сходство элементов друг с другом. При этом были учтены не только физические и химические свойства соответствующих простых веществ, но также формы (формулы) их оксидов, гидроксидов и других соединений. В результате чего, Менделеев получил таблицу, выражающую периодичность изменения свойств элементов и их соединений - Периодическую таблицу, в которой каждый элемент занимал определенное место.
Отсюда следует современная формулировка периодического за-кона: –
Свойства элементов, а также свойства образуемых ими простых и сложных веществ находятся в периодической зависимости от величины заряда ядер их атомов.
Периодическая система состоит из семи периодов, расположенных в таблице горизонтально, и восьми групп, расположенных вертикально.
Период — это горизонтальный ряд элементов, начинающийся (за исключением 1-го периода) щелочным металлом и заканчивающийся инертным (благородным) газом.
Группа — это вертикальный ряд элементов.
В периодах слева направо неметаллические свойства элементов монотонно усиливаются, а металлические — ослабевают.
В периодах слева направо кислотные свойства оксидов элементов и их гидратов усиливаются, а основные — ослабевают.
В главных подгруппах сверху вниз металлические свойства элементов усиливаются, а неметаллические - ослабевают.
В главных подгруппах сверху вниз основные свойства оксидов и их гидратов усиливаются, а кислотные - ослабевают.
4. Природа химической связи. Типы химических связей: ионная, ковалентная, донорно-акцепторная, водородная.
Химическая связь – это совокупность взаимодействий между атомами приводящие к образованию устойчивых структур (молекул, ионов, кристаллов, комплексов и др.)
ионная
Ионная связь – связь, образующаяся между атомами, электроотрицательность которых сильно различается.
Ионная связь наиболее характерна для неорганических соединений. Отличительными чертами ионных соединений являются: мгновенность протекания реакций, диссоциация в водных растворах, высокие температуры плавления и кипения, растворимость в полярных растворителях, электрическая проводимость растворов и расплавов.
ковалентная
Ковалентная связь образуется парой или несколькими парами электронов, обобществляемых между двумя соседними атомами.
Образования общей электронной пары может осуществляться по двум механизмам:
1)обменному, когда каждый из соединяющихся атомов имеет на валентном уровне неспаренный электрон, который он предоставляет для образования общей электронной пары;
2)донорно-акцепторному, когда один из соединяющихся атомов предоставляет электронную пару, а другой — вакантную орбиталь, на которой она может разместиться.
Ковалентная связь может быть полярной и неполярной.
Электроотрицательность элемента это способность атомов данного элемента оттягивать к себе общую электронную пару при образовании химической связи с атомами других элементов.
Таким образом, электроотрицательность характеризует способность атомов элемента удерживать электроны (как электроны своей электронной оболочки, так и дополнительные электроны — в случае неметаллов).
Если молекула образована двумя атомами с близкими значениями электроотрицательности, то распределение отрицательного заряда общего электронного облака более или менее симметрично. В предельном случае, если молекула образована двумя одинаковыми атомами, то отрицательный заряд электронов распределяется между ними поровну. В этом случае возникающая в молекуле связь неполярная.
Если соединяются два атома с различными значениями электроотрицательности, то облако отрицательного заряда общей электронной пары смещается в сторону более электроотрицательного атома, а образующаяся связь является полярной.
Атомы могут быть связаны между собой более чем одной электронной парой. Число электронных пар, связывающих два атома, называется кратностью связи между этими атомами. Простой (ординарной) связи соответствует одна общая электронная пара, двойной или тройной связи — соответственно две или три общие электронные пары.
донорно-акцепторная
Кроме обменного механизма возможен донорно-акцепторный механизм образования ковалентной связи, отличие которого можно показать на примере образования иона аммония. Атом азота в молекуле аммиака связан с тремя атомами водорода тремя ковалентными связями, образованными по обменному механизму (крестиками в формуле аммиака показаны электроны, изначально принадлежавшие атомам водорода). Кроме того, у атома азота есть два спаренных электрона. Такая пара электронов тоже может участвовать в образовании ковалентной связи с другим атомом, если во внешнем электронном слое этого атома есть свободная орбиталь. Незаполненная орбиталь есть у иона водорода. При взаимодействии молекулы аммиака с ионом водорода ковалентная связь возникает вследствие того, что неподелённая пара электронов атома азота, перекрываясь со свободной орбиталью иона H+, становится общей для обоих атомов. В результате этого взаимодействия образуется ион аммония.
Водородная
Многочисленные экспериментальные данные свидетельствуют о том, что атом водорода способен соединяться одновременно с двумя другими атомами, входящими в состав разных молекул или одной и той же молекулы. С одним из атомов (А) водород обычно связан значительно сильнее (за счет ковалентной связи), чем с другим (В).

Активными называются атомы водорода, связанные с другим атомом сильно полярной ковалентной связью.
Константа диссоциации
К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия.
Ниже приводится выражение константы равновесия для процесса диссоциации уксусной кислоты CH3COOH⇆CH3COO– + H+.
 Константа равновесия, соответствующая процессу диссоциации слабого электролита, называется константой диссоциации.
Константа равновесия, соответствующая процессу диссоциации слабого электролита, называется константой диссоциации.
Величина константы диссоциации зависит от природы электролита и растворителя, температуры, но не зависит от концентрации электролита в растворе.
Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем легче электролит диссоциирует на ионы, тем больше константа диссоциации.
Константа диссоциации является справочной величиной.
Степень гидролиза
Степень гидролиза (h) – это отношение числа молекул соли, подвергшихся гидролизу к общему числу молекул соли введенных в раствор. Степень гидролиза может быть выражена в долях от нуля до единицы или в процентах.

Типы ОВР
Различают четыре типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные, реакции диспропорционирования и конпропорционирования.
1. Межмолекулярные ОВР - это реакции, которые идут с изменением степени окисления атомов в молекулах разных веществ:
2. Внутримолекулярные ОВР - это реакции, которые идут с изменением степени окисления разных атомов в одной молекуле. При этом атом элемента с более высокой степенью окисления является окислителем и окисляет атом элемента с меньшей степенью окисления.
3.Реакции диспропорционирования (дисмутации) - это реакции, которые идут с изменением степени окисления одинаковых атомов в молекуле (или молекулах) одного и того же вещества
4.Реакции конпропорционирования (конмутации) — это реакции, обратные реакциям диспропорционирования. В результате этих реакций атомы одного элемента, находящиеся в разных степенях окисления, переходят к общей степени окисления, промежуточной между исходными степенями.
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
В качестве окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей из возможных для них степеней окисления, а поэтому могут понижать свою степень окисления.
В качестве типичных окислителей могут выступать:
1) простые вещества, образуемые атомами с большой электроотрицательностью, т. е. типичные неметаллы, расположенные, прежде всего, в главных подгруппах шестой и седьмой групп периодической системы;
2) вещества, содержащие элементы в высших и промежуточных положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fе3+), так и кислородсодержащих, оксоанионов (перманганат-ион);
3) перекисные соединения (пероксиды, супероксиды и т. д.);
4) Кислородсодержащие анионы, содержащие атом неметалла в высшей положительной степени окисления (SO4 (степень окисления серы +6), NO3 (степень окисления азота +5)
Конкретными веществами, применяемыми на практике в качестве окислителей, являются, например, кислород и озон, хлор, бром, пероксид водорода и пероксиды металлов, хроматы, дихроматы и перманганаты, кислородные кислоты хлора и их соли, азотная кислота, концентрированная серная кислота, диоксид марганца.
В качестве восстановителей могут выступать простые или сложные вещества, содержащие атомы, которые находятся не в высшей из возможных для них степени окисления, а потому могут повышать свою степень окисления.
В качестве типичных восстановителей могут выступать:
1) простые вещества, атомы которых имеют низкую электроотрицательность («активные» металлы);
2) катионы металлов в низших степенях окисления (Fе2+);
3) простые, элементарные анионы, например сульфид-ион;
4) кислородсодержащие анионы (оксоанионы), соответствующие низшим положительным степеням окисления элемента (нитрит, сульфит);
5) катод электролизной ячейки.
Вещества, применяемыми на практике в качестве восстановителей, являются, щелочные и щелочноземельные металлы, сульфиды, сульфиты, галогеноводороды (кроме НF), соли двухвалентного железа, органические вещества - формальдегид, глюкоза, щавелевая кислота, а также водород, углерод, монооксид углерода и алюминий при высоких температурах.
Метод полуреакции
Mетод полуреакций (ионно-молекулярный метод) основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и малорастворимые вещества - в виде молекул. Степень окисления атомов не используют, а учитывают заряды реальных ионов и характер среды, в которой идет процесс окисления или восстановления. Алгебраическую сумму зарядов в левой и правой частях полуреакций (процессов окисления и восстановления) уравнивают с помощью определенного числа электронов, которые участвуют в процессе. После записи полуреакций окисления и восстановления уравнивают число электронов, отданных восстановителем и принятых окислителем с помощью дополнительных коэффициентов (как в методе электронного баланса). С учетом этих коэффициентов записывают сокращенное ионно-молекулярное уравнение, а затем и молекулярное уравнение ОВР.
Используем метод полуреакций для той же реакции:


Теперь уравниваем число электронов в полуреакциях окисления и восстановления и получаем» сокращенное ионно молекулярное уравнение ОВР:
Записываем молекулярное уравнение ОВР:

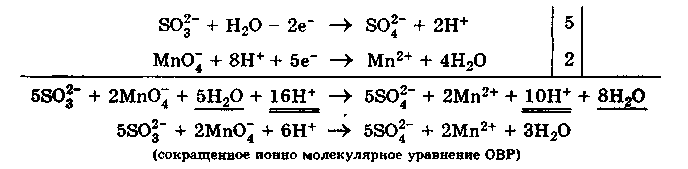
15. Предмет органической химии. Исторический обзор развития органической химии. Первые теоретические воззрения. Теория строения А.М.Бутлерова.
Предмет органической химии
Органическая химия – наука, изучающая соединения углерода, называемые органическими веществами. В связи с этим органическую химию называют также химией соединений углерода
Важнейшие причины выделения органической химии в отдельную науку заключаются в следующем.
1.Многочисленность органических соединений по сравнению с неорганическими соединениями.
2.Органические вещества имеют исключительное значение как вследствие их крайне многообразного практического применения, так и потому, что они играют важнейшую роль в процессах жизнедеятельности организмов.
3. Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических, вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
Предметом органической химии является изучение способов получения, состава, строения и областей применения важнейших классов органических соединений.
Теория типов
Основоположником теории типов был Жерар. 
Он предложил строить органические соединения подобно неорганическим, посредством замены атомов в последних, органическими остатками. Всю органическую химию он предлагал разделить на несколько типов: тип воды, тип хлористого водорода, тип аммиака, тип метана и т.д.
Бутлеров
Основные идеи теории А. М. Бутлерова могут быть кратко изложены следующим образом:
1. Все атомы, образующие молекулу органического вещества, связаны в определенной последовательности, причем на соединение их друг с другом затрачивается определенная доля химического сродства.
Четырехвалентность углерода и способность его образовывать цепи вошла в теорию как составные части. Химическое сродство - валентность. Все это привело к написанию химических формул, которыми мы пользуемся в настоящее время, т.е. открытые цени углеродных атомов, замкнутая в кольцо цепь углеродных атомов.

2. От химического строения вещества зависят его химические и физические свойства. Это положение теории объяснило явление изомерии.
3. Изучение свойств вещества позволяет определить его строение, а, следовательно, и свойства.
4. Химические свойства атомов и атомных групп неизменны и меняются только под влиянием присутствующих атомов и атомных групп, особенно непосредственно связанных друг с другом.
16. Основы номенклатуры в органической химии. Классификация органических соединений.
НОМЕНКЛАТУРА
Правила, по которым образуются названия органических соединений, составляют номенклатуру. В настоящее время в органической химии применяют несколько систем номенклатуры.
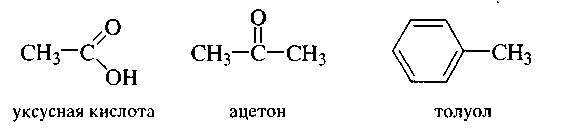 1. Тривиальная номенклатура
1. Тривиальная номенклатура
2.Рациональная номенклатура. По правилам рациональной номенклатуры за основу названия органического соединения принимают название наиболее простого (чаще первого) члена данного гомологического ряда. Все остальные соединения рассматривают как его производные
3. Систематическая номенклатура ИЮПАК (Международный союз теоретической и прикладной химии).
Для того чтобы назвать органическое соединение по систематической номенклатуре ИЮПАК, нужно:
1) выбрать родоначальную структуру;
2) выявить все имеющиеся в соединении функциональные группы;
3) установить, какая группа является старшей (см. табл. 1.4);
название этой группы отражается в названии соединения в виде суффикса и его ставят в конце названия соединения; все остальные группы дают в названии в виде префиксов (приставок);
4) обозначить ненасыщенность соответствующим суффиксом (-ен или -ин), а также префиксом (дегидро-, тетрагидро- и др.);
5) пронумеровать главную цепь, придавая старшей группе наименьший из номеров;
6) перечислить префиксы (приставки) в алфавитном порядке (при этом умножающие префиксы ди-, три- и т. д. не учитываются);
7) составить полное название соединения.
Родоначальная структура - главная цепь в ациклической молекуле; циклическая или гетероциклическая система (или ее часть), лежащая в основе соединения.
В ациклических соединениях главной цепью называют цепь углеродных атомов, составляющую основу названия и нумерации.

В случае кратных связей при одинаковых цифровых индексах двойных и тройных связей предпочтение отдается двойной связи.
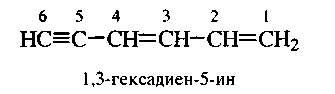
В алициклических соединениях главной цепью считают замкнутую цепь углеродных атомов. В названии этой цепи применяют префикс цикла-.

Углеводороды, содержащие два цикла, у которых один атом углерода -общий, имеют в названии префикс спиро-.
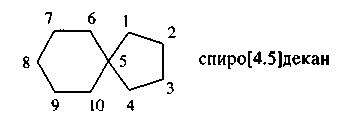
4. Радикало-функциональная номенклатура

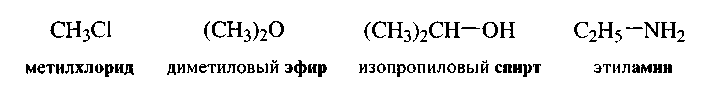 Эта система использует те же приемы, что и рациональная, но не содержит суффиксов. По этой номенклатуре роль суффикса играет название класса соединения.
Эта система использует те же приемы, что и рациональная, но не содержит суффиксов. По этой номенклатуре роль суффикса играет название класса соединения.


17. Углеводороды алифатического ряда (алканы). Общая характеристика: строение, изомерия, номенклатура. Понятие о гомологическом ряде. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм.
Простейшим представителем класса является метан (CH4).
Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета. Гомологическая разница — —CH2—. Алканы, число атомов углерода в которых больше трёх, имеют изомеры. Число этих изомеров возрастает с огромной скоростью по мере увеличения числа атомов углерода.
| Гомологический ряд алканов (первые 10 членов)
|
| Метан
| CH4
| CH4
|
| Этан
| CH3—CH3
| C2H6
|
| Пропан
| CH3—CH2—CH3
| C3H8
|
| Бутан
| CH3—CH2—CH2—CH3
| C4H10
|
| Пентан
| CH3—CH2—CH2—CH2—CH3
| C5H12
|
| Гексан
| CH3—CH2—CH2—CH2—CH2—CH3
| C6H14
|
| Гептан
| CH3—CH2—CH2—CH2—CH2—CH2—CH3
| C7H16
|
| Октан
| CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH3
| C8H18
|
| Нонан
| CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
| C9H20
|
| Декан
| CH3—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH3
| C10H22
|
Номенклатура
По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему корню от названия углеводорода. Выбирается наиболее длинная неразветвлённая углеводородная цепь так, чтобы у наибольшего числа заместителей был минимальный номер в цепи. В названии соединения цифрой указывают номер углеродного атома, при котором находится замещающая группа или гетероатом, затем название группы или гетероатома и название главной цепи. Если группы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых групп указывают приставками ди-, три-, тетра-. Если группы неодинаковые, то их названия перечисляются в алфавитном порядке.
Физические свойства
1. Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
2. При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые вещества.
3. Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Химические свойства
1. Галогенирование:
Галогенирование — это одна из реакций замещения. Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
А) CH4 + Cl2 → CH3Cl + HCl (хлорметан)
Б) CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
В) CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
Г) CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
2. Нитрование:
RH + HNO3 → RNO2 + H2O.
3. Реакции окисления:
a) Горение
CH4 + 2O2 → CO2 + 2H2O + Q.
b)Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
§ метиловый спирт: 2СН4 + О2 → 2СН3ОН;
§ формальдегид: СН4 + О2 → СН2О + Н2O;
§ муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
4. Термические превращения алканов:
a) Разложение
CH4 → C + 2H2 (t > 1000 °C).
C2H6 → 2C + 3H2.
b) Крекинг
CH4 → С + 2H2 — при 1000 °C.
Частичный крекинг:
2CH4 → C2H2 + 3H2 — при 1500 °C.
c) Дегидрирование
а)CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б)CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
в)CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3).
Получение
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
1. Восстановление галогенпроизводных алканов:
R—CH2Cl + H2 → R—CH3 + HCl
R—CH2I + HI → R—CH3 + I2
2. Восстановление спиртов:
H3C—CH2—CH2—CH2OH → H3C—CH2—CH2—CH3 + H2O
3. Восстановление карбонильных соединений
Реакция Кижнера—Вольфа:

Реакция Клемменсена[8]:

4.Гидрирование непредельных углеводородов
§ Из алкенов
CnH2n + H2 → CnH2n+2
§ Из алкинов
CnH2n-2 + 2H2 → CnH2n+2
5. Реакция Вюрца
2R—Br + 2Na = R—R + 2NaBr
18. Углеводороды алифатического ряда (алкены). Общая характеристика: строение, изомерия, номенклатура. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомамиуглерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.
Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2—«аллил».
Физические свойства
§ Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
§ При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
1. Галогенирование

2. Гидрогалогенирование
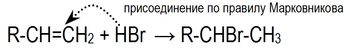
3. Гидратация
 , реакция протекает по правилу Марковникова.
, реакция протекает по правилу Марковникова.
4. Присоединение спиртов
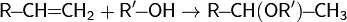
5. Реакции радикального присоединения
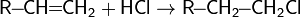
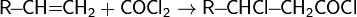

6. Реакции радикального замещения

7. Окисление

8. Реакции полимеризации

Методы получения алкенов
Дегидрирование алканов
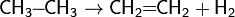

Дегидратация спиртов


Гидрирование алкинов
 (цис-изомер)
(цис-изомер)
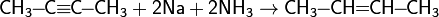 (транс-изомер)
(транс-изомер) 
Идентификация алкенов
Часто для идентификации алкенов используют реакцию Вагнера: обесцвечивание раствора перманганата калия в слабощелочной среде (окисление алкенов до гликолей). Другой вариант — обесцвечивание раствора брома в четыреххлористом углероде при отсутствии выделения бромоводорода (реакция присоединения)[44].
19.Диеновые углеводороды (диены). Общая характеристика: строение, классификация, номенклатура. Эффект сопряжения. Физические и химические свойства. Методы получения и идентификации. Отдельные представители.
Дие́ны — органические соединения, содержащие две двойных связи углерод-углерод. В зависимости от взаимного расположения двойных связей диены подразделяются на три группы: сопряженные диены, в которых двойные связи разделены одинарной (1,3-диены), аллены скумулированными двойными связями (1,2-диены) и диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными. Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён гетероатомом, называютсягетеродиенами[1].
Обычно к диенам относят ациклические и циклические 1,3-диены, образующие гомологические ряды общих формул 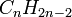 и
и 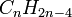 соответственно, ациклические диены являются структурными изомерами алкинов.
соответственно, ациклические диены являются структурными изомерами алкинов.
Физические свойства
Низшие диены - бесцветные легкокипящие жидкости (температуры кипения изопрена - 34 °C, 2,2-диметил-1,3-бутадиена — 68.78 °C, 1,3-циклопентадиена — 41.5 °C). 1,3-Бутадиен иаллен (1,2-пропадиен) — газы (Tкип −4,5 °C и −34 °C соответственно).
Сопряженные диены существуют в виде двух конформаций - цисоидной (s-цис-форма) и трансоидной (s-транс-форма), способных переходить друг в друга, более устойчивой является s-транс-форма:

Реакционная способность
Реакционная способнось диенов определяется спецификой сопряжения двойных связей - если для диенов с изолированными двойными связями реакционная способность аналогична реакционной способности алкенов, то в случае алленов и 1,3-диенов эффекты сопряжения ведут к специфике реакционной способности этих классов соединений.
1. Реакции алленов
CH2=C=CH2 + PhSH  CH2=C(SPh)-CH3 + CH2=CH-CH2SPh
CH2=C(SPh)-CH3 + CH2=CH-CH2SPh
RCH2CH=C=CH2  RCH=CHCH=CH2
RCH=CHCH=CH2
2. Реакции 1,3-диенов
Специфика реакционной способности 1,3-диенов обусловлена мезомерией вследствие сопряжения двойных связей:

Результатом является то, что в случае электрофильного присоединения к сопряженным диенам типичны реакции 1,4-присоединения, идушие через промежуточное образование резонансно стабилизированных аллильных карбокатионов:
CH2=CH-CH=CH2 + X+  XCH2-CH=CH-CH2+
XCH2-CH=CH-CH2+
XCH2-CH=CH-CH2+ + Y-  XCH2-CH=CH-CH2Y
XCH2-CH=CH-CH2Y
Х = Hal, H, Y = Hal, OH
Сопряженные диены легко полимеризуются по механизму 1,4-присоединения, реакция полимеризации 1,3-диенов лежат в основе синтеза диеновых каучуков.
Диены также реагируют с алкенами и другими соединениями - диеновилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения (реакция Дильса — Альдера)

Получение
Синтез Лебедева:
2CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2
Физические свойства.
Бензол и его ближайшие гомологи – бесцветные жидкие вещества (см. табл.), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях.








 Константа равновесия, соответствующая процессу диссоциации слабого электролита, называется константой диссоциации.
Константа равновесия, соответствующая процессу диссоциации слабого электролита, называется константой диссоциации.



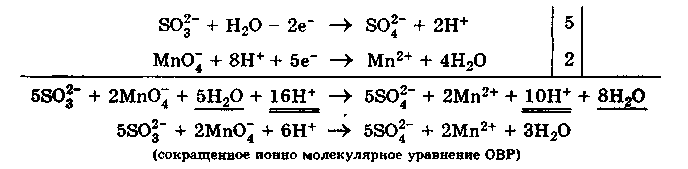


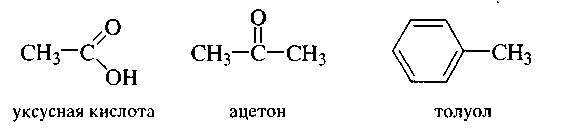 1. Тривиальная номенклатура
1. Тривиальная номенклатура 
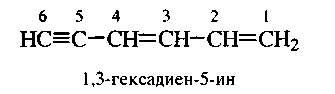

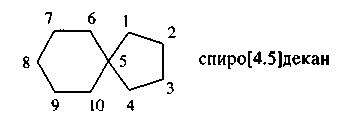

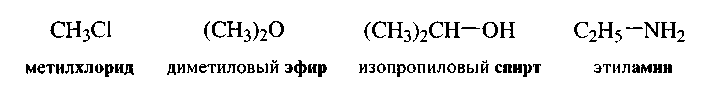 Эта система использует те же приемы, что и рациональная, но не содержит суффиксов. По этой номенклатуре роль суффикса играет название класса соединения.
Эта система использует те же приемы, что и рациональная, но не содержит суффиксов. По этой номенклатуре роль суффикса играет название класса соединения.





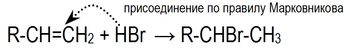
 , реакция протекает по правилу Марковникова.
, реакция протекает по правилу Марковникова.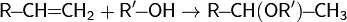
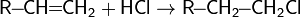
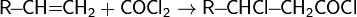




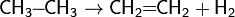



 (цис-изомер)
(цис-изомер)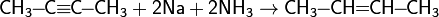 (транс-изомер)
(транс-изомер) 
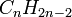 и
и 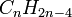 соответственно, ациклические диены являются структурными изомерами алкинов.
соответственно, ациклические диены являются структурными изомерами алкинов.
 CH2=C(SPh)-CH3 + CH2=CH-CH2SPh
CH2=C(SPh)-CH3 + CH2=CH-CH2SPh




