

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
направление подготовки бакалавра
Продукты питания животного происхождения
Уфа - 2013
УДК
Рекомендовано к изданию методической комиссией
факультета пищевых технологий
(протокол №_______ от «______» ________________________ 2013 г.)
\
Составитель: доцент Ганиева Е.С.
Рецензент:
доцент кафедры химии Шабаева Г.Б.
Ответственный за выпуск:
заведующий кафедрой химии профессор Исламова Р.М.
ВВЕДЕНИЕ
Данное методическое указание составлено для студентов 1 курса факультета пищевых технологий направления подготовки 260200 Продукты питания животного происхождения для выполнения домашней работы (эссе) по дисциплине Б2.В.1 Основы общей и неорганической химии. Оно включает в себя теоретический материал и контрольные задачи по темам «Эквивалент. Моль - эквивалент. Молярная масса эквивалента» и «Основные закономерности химических процессов», которые входят в «Модуль 1. Теоретические основы общей химии». Данные задания помогут усвоить теоретический материал и подготовиться к рубежной контрольной работе по модулю 1.
Для выполнения этих заданий необходимо проработать лекционный материал и учебные пособия. Студент выполняет задания своего варианта, номер которого укажет преподаватель. Работа оформляется на бумаге формата А4, причем приводится условие задачи и подробное решение задачи. В конце работы необходимо привести список использованной литературы.
Модуль 1 Теоретические основы общей химии
СОДЕРЖАНИЕ
Эквивалент. Моль - эквивалент. Молярная масса эквивалента.
Закон эквивалентов. с.5
Основные закономерности химических процессов с.14
|
|
Основы химической термодинамики с.14
Основы химической кинетики с.21
Основы химического равновесия с.24
Основы фазового равновесия с.27
ПРИЛОЖЕНИЕ с.35
ЛИТЕРАТУРА с.37
Эквивалент. Моль - эквивалент. Молярная масса эквивалента.
Закон эквивалентов.
Эквивалент - одно из стехиометрических понятий химии, указывает на равноценность количественных отношений исходных и образующихся веществ в химической реакции. Такая равноценность обуславливается равенством числа разрывающихся химических связей в исходных веществах и образующихся - в продуктах реакции.
Пример:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
1 моль 3 моль 1 моль 3 моль
В графической форме:

1Fe(OH)3, 1HCl, 1FeCl3, 1HOН содержат различное число реакционно-способных химических связей и в этом смысле указанные количества этих веществ не равноценны, не эквивалентны.
Реакция произойдет, если на 3 разрывающиеся химические связи в Fe(OH)3 будет приходиться 3 связи в HCl, что соответствует 3HCl. Как показывает приведенное выше уравнение, равноценными (другими словами, эквивалентными) по числу связей будут 1Fe(OH)3, 3HCl, 1FeCl3, 3HOН. Эквивалентными будут и такие доли молекул веществ, которые соответствуют возможности образования одной химической связи. Для 1 моля сложного вещества эта доля определит 1 моль-экв.

Масса одного моль – эквивалента сложного вещества, называемая молярной массой эквивалента, равна:

Число реакционноспособных химических связей в зависимости от состава и строения вещества можно выразить более конкретно:
| Типы соединений | nх. св. |
| Кислоты | nH+ |
| Основания | nOH- |
| Соли | nkt · Zkt = nAn · ZAn |
| Оксиды | nэлем. · Zэлем. = nO · ZO |
В рассматриваемой реакции:
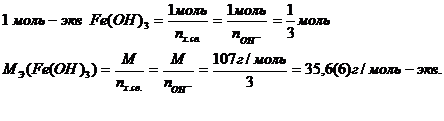

Значения масс эквивалентов сложных веществ можно выразить через массы эквивалентов, элементов или ионов его составляющих. Заменив в выражении  молярную массу на численно равную относительную молекулярную (Мr), молярную массу эквивалента – на эквивалентную (Э), получим:
молярную массу на численно равную относительную молекулярную (Мr), молярную массу эквивалента – на эквивалентную (Э), получим:
|
|

Эквивалентность реагирующих и образующихся веществ отражает закон эквивалентов, которому можно придать различные математические выражения:
1) nЭ,1 = nЭ,2 = nэ,3 = …
nЭ – число моль-эквивалентов

m – масса;
V – объем;
VЭ – объем одного моль-эквивалента газообразного вещества.
2) 
3) 
Объем 1 моль - эквивалента газов имеет различные значения:


 1 моль Н2 22,4 л х = 11,2 л
1 моль Н2 22,4 л х = 11,2 л
 1 моль-экв→ ½ моль х л
1 моль-экв→ ½ моль х л


 1 моль О2 22,4л х = 5,6 л
1 моль О2 22,4л х = 5,6 л
 1 моль-экв → ¼ моль х л
1 моль-экв → ¼ моль х л

Перед решением задач необходимо вспомнить:
1) простое и сложное вещество;
2) валентность элемента;
3) основные классы неорганических соединений;
4) номенклатура неорганических соединений;
5) графические формулы неорганических соединений;
6) понятие основность кислоты;
7) понятие кислотность основания;
8) электролитическая диссоциация неорганических соединений;
9) относительная атомная масса элемента;
10) относительная молекулярная масса вещества;
11) молярная масса вещества;
12) эквивалент;
13) моль – эквивалент,
14) молярная масса эквивалента;
15) закон эквивалентов.
Контрольные задания
Задание 1.
1 – 30. A: Назовите вещество, укажите к какому классу неорганических соединений оно относится. Вычислите молярную массу эквивалента.
В: Сколько моль – эквивалентов содержится в образце.
С: Какой объем занимает газ (н.у.)?
| Номер варианта | A | B | C |
| 1,16 | Fe в Fe2O3, Cl2O7, NaAlO2, Mg(OH)2, H2SO4 | 30 г Mg(OH)2 15 г K2CO3 | 0,5 моль – эквивалентов H2, 1,5 моль – эквивалентов Cl2 |
| 2,17 | Cl в Cl2O5, KOH, H3PO4, K2CO3, CaO | 1,5 г H3PO4 3,7 г Ba(OH)2 | 3,8 моль – эквивалентов F2, 1,5 моль – эквивалентов O2 |
| 3,18 | P в P2O3, Al2(SO4)3, Fe(OH)2, H3PO4, Al2O3 | 8,7 г K2HPO4 10 г Pb(OH)2 | 9,7 моль – эквивалентов N2, 3,5 моль – эквивалентов Br2 |
| 4,19 | N в N2O3, H3PO4, Ba(OH)2, NaNO2, P2O5 | 10 г K2Cr2O7 2,3 г Zn(OH)2 | 3,2 моль – эквивалентов Ar, 6,6 моль – эквивалентов H2 |
| 5,20 | Si в SiO, H2SiO3, Fe(OH)3, K2HPO4, Na2O | 6,1 г Ca3(PO4)2, 2,1 г HCl | 2,1 моль – эквивалентов O2, 7,6 моль – эквивалентов H2 |
| 6,21 | C в СO2, K2Cr2O7, Zn(OH)2, H4P2O7, P2O5 | 8,1 г Mg(OH)2 3,4 г HNO3 | 9,3 моль – эквивалентов Ar, 6,6 моль – эквивалентов Cl2 |
| 7,22 | Ca3(PO4)2, MnO2, Pb(OH)2, V в V2O7, V2O7 | 15 г Na2S 67 г Na2SO3 | 6,8 моль – эквивалентов H2, 9,5 моль – эквивалентов F2 |
| 8,23 | CuOHNO3, Cu(OH)2, KMnO7, CrO, Сr в CrO | 33 г Fe2O3 27 г H2CrO4 | 1,8 моль – эквивалентов O2, 13,5 моль – эквивалентов F2 |
| 9,24 | NaHSO4, Fe(OH)3, HCl, As2O3, As в As2O3 | 5 г CrO3, 3,3 г NaBiO3 | 13,7 моль – эквивалентов N2, 28,8 моль – эквивалентов H2 |
| 10,25 | CrCl3, Sn(OH)2, H3AlO3, CO, C в СO | 1,7 г Cu(OH)2 5,2 г Ca3(PO4)2 | 4,5 моль – эквивалентов O2, 11,5 моль – эквивалентов F2 |
| 11,26 | Cr2(SO4)3, H2SnO2, Mg(OH)2, SO2, S в SO2 | 7 г As2O3 7,8 г NaHSO4 | 23,5 моль – эквивалентов Cl 2, 13,5 моль – эквивалентов H2 |
| 12,27 | Na2S, H2S, S в SO3, Ni(OH)2, SO3 | 6,3 г Mg(OH)2, 1,3 г HCl | 7,8 моль – эквивалентов О2, 4,7 моль – эквивалентов Cl2 |
| 13,28 | Na2SO3, KOH, H2CrO4, CrO3, Cr в CrO3 | 9 г Fe(OH)3 8,3 г MnO2 | 17,8 моль – эквивалентов N 2, 4,7 моль – эквивалентов Ar |
| 14,29 | KI, NH4OH, HNO2, Fe2O3, Fe в Fe2O3 | 5,8 г CuOHNO3, 4,3 г KOH | 23,5 моль – эквивалентов О2, 14,7 моль – эквивалентов Ar |
| 15,30 | NaBiO3, Fe(OH)3, Al2O3, Al в Al2O3, HNO3 | 9,8 г H3PO4, 15 г K2CO3 | 44,5 моль – эквивалентов О2, 64,7 моль – эквивалентов H2 |
|
|
Задание 2. Эквивалент вещества в химической реакции
1-30. Определите, чему равен 1 моль-экв исходных веществ, как доля от 1 моля.
| Номер варианта | Уравнения реакций |
| Fe(OH)3 + HCl → Fe(OH)2Cl + H2O | |
| Fe(OH)3 + 2HCl → FeOHCl2 + 2H2O | |
| 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O | |
| CuOHNO3 + H2S → CuS + HNO3 + H2O | |
| Na2HPO4 + AlCl3 → AlPO4 + 2NaCl + HCl | |
| Ca(HCO3)2 + 2HCl → CaCl2 + 2H2O + 2CO2 | |
| Al(OH)2Cl + KOH → Al(OH)3 + KCl | |
| H3PO4 + 3NaOH → Na3PO4 + 3H2O | |
| H3PO4 + 2NaOH → Na2HPO4 + 2H2O | |
| H3PO4 + NaOH → NaH2PO4 + H2O | |
| Fe(OH)2CH3COO + 3HNO3 → Fe(NO3)3 + CH3COOH + 2H2O | |
| KH2PO4 + KOH → K2HPO4 + H2O | |
| KH2PO4 + 2KOH → K3PO4 + 2H2O | |
| Bi(OH)2NO3 + KOH → Bi(OH)3 + KNO3 | |
| Fe(OH)2Cl + 2HCl → FeCl3 + 2H2O | |
| K2HPO4 + KOH → K3PO4 + H2O | |
| Na2HPO4 + CaCl2 → CaHPO4 + 2NaCl | |
| K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2 | |
| 2FeSO4 + 2KOH → (FeOH)2SO4 + K2SO4 | |
| FeSO4 + 2KOH → Fe(OH)2 + K2SO4 | |
| H3PO4 + KOH → K3PO4 + 3H2O | |
| Al(OH)Cl2 + 2KOH → Al(OH)3 + 2KCl | |
| Bi(OH)(NO3)2 + 2KOH → Bi(OH)3 + 2KNO3 | |
| PbCl2 + H2O → Pb(OH)Cl + HCl | |
| H2SO4 + PbCl2 → PbSO4 + 2HCl | |
| H2SO4 + KOH → KHSO4 + H2O | |
| Fe(OH)2NO3 + 2HNO3 → Fe(NO3)3 + 2H2O | |
| Al(OH)3 + KOH ® K[Al(OH)4] | |
| Al(OH)3 + HNO3 ® Al(OH)2NO3 + H2O | |
| Al(OH)3 + 2HNO3 ® Al(OH)(NO3)2 + 2H2O |
Задание 2. Закон эквивалентов.
Задание 2.1. 1 – 30.Решите задачу.
1. На нейтрализацию 7,330 г фосфорноватистой кислоты Н3РО2 пошло 4,444 г NaOH. Вычислите эквивалентную массу кислоты, ее основность (nН+) и напишите уравнение реакции нейтрализации.
2. При восстановлении 6,50 г оксида образовалось 4,45 г металла. Вычислите молярные массы эквивалентов металла и его оксида.
3. При нейтрализации 9,8 г ортофосфорной кислоты израсходовано 8 г NaOH. Вычислите эквивалентную массу и основность (nН+) кислоты в этой реакции. На основании расчета напишите уравнение реакции.
|
|
4. В какой массе NaOH содержится столько же моль – эквивалентов, что и в 140 г КОН?
5. При взаимодействии 2,5 г карбоната металла с азотной кислотой образовалось 4,1 г нитрата этого же металла. Вычислите эквивалентную массу металла.
6. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалента этого металла.
7. Некоторый элемент образует кислородное соединение, содержащее 31,58 % кислорода. Вычислите эквивалентную и атомную массу этого элемента, если в данном оксиде он трехвалентен. Составьте формулу оксида.
8. Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.). Вычислите массу эквивалента металла; чему равна его атомная масса?
9. Какой объем (н.у.) занимает 1 моль – эквивалент водорода? Сколько литров водорода (н.у.) выделилось при растворении в кислоте 0,45 г металла, молярная масса эквивалента которого равна 20 г/моль-экв?
10. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
11. Является ли эквивалент элемента постоянной величиной? Чему равны эквивалентные массы хрома в его оксидах, содержащих 68,42 % и 52,00 % хрома. Определите валентность хрома в каждом из этих оксидов и составьте их формулы.
12. Трехвалентный элемент образует оксид, содержащий 31,58 % кислорода. Вычислите эквивалентную и атомную массу этого элемента. Составьте формулу оксида.
13. При окислении 8,37 г двухвалентного металла образовалось 10,77 г оксида. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
14. При взаимодействии 1,62 г трехвалентного металла с кислотой выделяется 2,015 л водорода (н.у.).Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
15. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалента этого металла.
16. При окислении 1,674 г двухвалентного металла образовалось 2,154 г оксида. Вычислите молярную массу эквивалента металла; чему равна его атомная масса?
17. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определите эквивалентную массу металла и объем выделившегося водорода (н.у.).
18. Сколько моль – эквивалентов извести Ca(OH)2 потребуется для нейтрализации 196 г фосфорной кислоты для получения одно-, двух- и трехзамещенного фосфата кальция?
19. По реакциям нейтрализации серной кислоты и ортофосфорной одинаковым количеством щелочи образовались соответственно сульфат и дигидрофосфат. Каково отношение масс этих кислот, пошедших на нейтрализацию.
|
|
20. Оксид металла содержит 28,65% кислорода, а соединение того же металла с галогеном – 48,72 % галогена. Рассчитайте молярную массу эквивалента галогена.
21. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль-экв, вытесняет из кислоты 700 мл водорода, измеренного при н.у. Определить массу металла.
22. 1,6 г кальция и 2,61 г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20 г/моль-экв.
23. Вычислите молярную массу эквивалента карбоната магния, если на растворение 8,4 г этой соли было израсходовано 33,2 мл 20% - ного раствора HCl (r = 1,1 г/моль).
24. Вычислите молярную массу эквивалента серной кислоты, если 98,08 г ее реагируют с 24, 32 г магния.
25. При восстановлении 2,4 г оксида двухвалентного металла водородом получено 0,54 г воды. Вычислите молярную массу эквивалента металла и его оксида и назовите металл.
26. Сколько литров кислорода, измеренного при н.у., расходуется при сгорании 2,4 г металла, молярная масса эквивалента которого равна 12 г/моль – экв..
27. При нагревании 20,06 г металла получено 21,55 г оксида. Вычислите молярную массу эквивалента металла.
28. Металл массой 16,8 г взаимодействует с 14,7 г серной кислоты. Рассчитайте молярную массу эквивалента металла и объем выделившегося водорода. (н.у.)
29. При взаимодействии 5,95 г некоторого вещества с 2,75 г хлороводорода получилось 4,40 г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
30. Эквивалентная масса металла в 2 раза больше, чем эквивалентная масса кислорода. Во сколько раз масса оксида больше массы металла?
Задание 2.2
1 – 30. Рассчитайте массу (или объем) продуктов реакции, если прореагировано указанное количество моль эквивалентов одного из веществ при нормальных условиях.
| Номер варианта | Реакция | Количество моль эквивалентов исходного вещества |
| Zn + H2SO4 → ZnSO4 + H2 | 0,2 моль - экв Zn | |
| H2O2 + O3 → H2O + 2O2 | 0,3 моль - экв O3 | |
| 4FeS2 + 11O2 → 2Fe2O3 + 8 SO2 | 1 моль - экв O2 | |
| Cu(OH)2 + HCl → CuOHCl + H2O | 0,5 моль - экв HCl | |
| Cu(OH)2 + 2HCl → CuCl2 + 2H2O | 0,5 моль - экв HCl | |
| H2SO4 + 2KOH → K2SO4 + 2H2O | 4 моль - экв KOH | |
| SO2 + 1/2O2 → SO3 | 0,1 моль - экв O2 | |
| CO + H2O → CO2 + H2 | 2 моль - экв H2O | |
| N2 + O2 → 2NO | 3 моль - экв N2 | |
| 2H2 + O2 → 2H2O | 0,6 моль - экв H2 | |
| Fe2O3 + 3H2 → 2Fe + 3H2O | 0,4 моль - экв H2 | |
| 2H2O2 → 2H2O + O2 | 0,1 моль - экв H2O2 | |
| 3H2 + N2 →2NH3 | 3 моль - экв H2 | |
| N2O4 → 2NO2 | 1 моль - экв N2O4 | |
| 2NH4NO3 → 4H2O + O2 + 2N2 | 0,2 моль - экв NH4NO3 | |
| 4HCl + O2 → 2Cl2 + 2H2O | 0,4 моль - экв O2 | |
| SO2 + 2H2 → S + 2H2O | 0,5 моль - экв H2 | |
| CH4 + 2O2 → 2H2O + CO2 | 2 моль - экв O2 | |
| 4NH3 + 3O2 → 2N2 + 6H2O | 3 моль - экв O2 | |
| 4NH3 + 5O2 → 4NO + 6H2O | 5 моль - экв O2 | |
| Fe2O3 + 3H2 → 2Fe + 3H2O | 0,4 моль - экв Fe2O3 | |
| 4FeS2 + 11O2 → 2Fe2O3 + 8 SO2 | 1,5 моль - экв FeS | |
| 4NH3 + 3O2 → 2N2 + 6H2O | 3,5 моль - экв NH3 | |
| SO2 + 2H2 → S + 2H2O | 0,5 моль - экв SO2 | |
| N2 + O2 → 2NO | 1,5 моль - экв O2 | |
| 4HCl + O2 → 2Cl2 + 2H2O | 0,6 моль - экв HCl | |
| CO + H2O → CO2 + H2 | 2,5 моль - экв CO | |
| N2O4 → 2NO2 | 1 моль - экв NO2 | |
| 3H2 + N2 →2NH3 | 3 моль - экв N2 | |
| CH4 + 2O2 → 2H2O + CO2 | 2 моль - экв CH4 |
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!