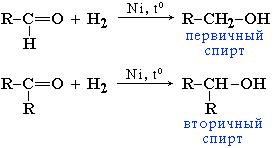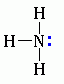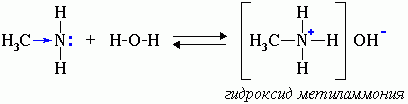· Восстановление
Альдегиды при взаимодействии с водородом в присутствии Ni-катализатора образуют первичные спирты, кетоны - вторичные:
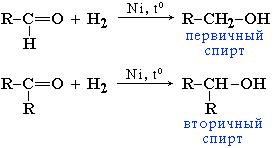
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития LiAlH4
· Окисление
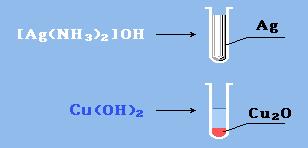
Альдегиды очень легко окисляются в соответствующие карбоновые кислоты под действием даже таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С–Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(OH)=O.
Реакция "серебрянного зеркала" – окисление аммиачным раствором оксида серебра (реактив Толленса):
R–CH=O + 2[Ag(NH3)2]OHà RCOOH + 2Ag↓ + 4NH3 + H2O
Окисление гидроксидом меди (II):
а) в виде свежеприготовленного осадка Cu(OH)2 при нагревании,
б) в форме комплекса с аммиаком [Cu(NH3)4](OH)2,
в) в составе комплекса с солью винной кислоты (реактив Фелинга).
При этом образуется красно-кирпичный осадок оксида меди (I) или металлическая медь (реакция "медного зеркала", более характерная для формальдегида):
R-CH=О + 2Cu(OH)2 à RCOOH + Cu2O↓ + H2О
H2C=О + Cu(OH)2 à HCOOH + Cu↓ + H2О
R–CH=O + 2[Cu(NH3)4](OH)2 à RCOOH + Cu2O↓ + 4NH3 + 2H2O
R–CH=O + 2Cu(OH)2/сольвиннойкислотыà RCOOH + Cu2O↓ + 2H2O
Данные реакции являются качественными на альдегидную группу.
Кетоны не вступают в эти реакции. Они окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот меньшей молекулярной массы.
Амины
1(св-ва аминов)
. Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
2. Функциональная группа: - NH2 аминогруппа
3. Классификация аминов:
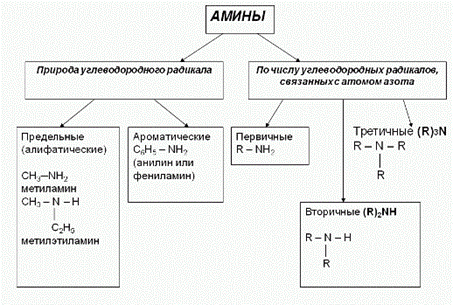
Амины как основнования)
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
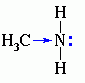

Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет + I -эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
Ряд увеличения основных свойств аминов:
| C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH
-------------------------------------------------→
возрастание основных свойств
|
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):

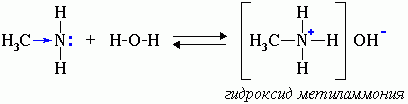
R-NH2 + H2O → [R-NH3]+ + OH-
ион алкиламмония
ВИДЕО:
Получение гидроксида диметиламмония и изучение его свойств
Анилин с водой не реагирует и не изменяет окраску индикатора!!!
ВИДЕО:
Изучение среды раствора анилина
Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль - сульфат метиламмония)
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
Амины как нуклеофилы)
Алкилирование аминов
Амины обладают нуклеофильными свойствами и алкилируютсяалкилгалогенидами и спиртами (см. методы получения).
Ацилирование аминов
Амины ацилируются карбоновыми кислотами и их производными с образованием амидов карбоновых кислот (см. лек. №12).
2RNH2 + R/COX ® R/CONHR + RNH3X
2R2NH + R/COX ® R/CONR2 + R2NH2X
(X=Cl, OCOR/)