Глава 5.
Элементы химической термодинамики
1. Организация химических реакций. Энергетические циклы
2. Основные положения термодинамики
3. Законы термодинамики
4. Введение в обмен веществ.Принципы организации метаболизма. Понятие о процесса катаболизма и анаболизма.
5. Иерархия метаболической регуляции
6. Энергетический обмен. Что такое биоэнергетика?
7. Протонный потенциал.
8. Структурные особенности АТФ. Роль макроэргов в обмене веществ.
9. Представление о биологическом окислении, его роль и виды, ферменты и коферменты этого процесса.Реакции синтеза АТФ. Окисление энергетических субстратов.Переносчики электронов и протонов. Генерирование протонного потенциала.Коэффициент окислительного фосфорилирования. Механизмы его регуляции.
10. Пути утилизации кислорода.
11. Синтез АТФ.
12. Общие пути метаболизма. Цикл трикарбоновых кислот его амфиболическая сущность.Энергетический обмен. Протонный потенциал.
Биологически важные макроэргические соединения. Представление о биологическом окислении. Роль биологического окисления.
13. Реакции окисления-восстановления. Пути утилизации кислорода: оксидазный и оксигеназный.
14. Синтез АТФ. Синтез АТФ путем субстратного и окислительного фосфорилирования.
Генерирование протонного потенциала. Синтез АТФ за счет протонного потенциала.
15. Ситуационные задачи, теоретические задания и лабораторно практические работы по теме «Биохимическая термодинамика».
16. Энергетический обмен и общий путь катаболизма.
Биохимическая термодинамика – раздел биохимии, который занимается изучением энергетических превращений, сопровождающих биохимические реакции. Её основополагающие принципы позволяют объяснить, почему протекают одни реакции и не осуществляются другие. Небиологические системы могут совершать работу за счёт тепловой энергии, биологические же системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию.
Жизнедеятельность организма определяют особенности организации биологических структур, обмена веществ и энергии, передачи генетической информации и механизмы регуляции.
Повреждение любого из этих звеньев приводит к развитию патологического процесса и заболеванию. Знание молекулярных механизмов жизнедеятельности и их нарушений – основа для поиска и применения в клинике препаратов различной биологической природы.
Организация химических реакций.
Цепи химических реакций образуют метаболические пути или циклы, каждый из которых выполняет определенную функцию. Принято выделять центральные и специальные метаболические пути. Центральные циклы являются общими для распада и синтеза основных макромолекул. Они очень сходны у любых представителей живого мира. Специальные циклы характерны для синтеза и распада индивидуальных мономеров, макромолекул, кофакторов и т.д.
Энергетические циклы.
Вследствие многообразия форм питания и потребления энергии живые организмы в природе тесно связаны друг с другом. Взаимосвязь в питании и использовании источников энергии можно представить в виде своеобразных энергетических циклов живой природы.
Главные компоненты этого цикла:
- Солнце - источник внеземной энергии,
- аутотрофы, улавливающие солнечную энергию и синтезирующие из СО2 углеводы и прочие органические вещества
- гетеротрофы - животные организмы, потребляющие органические вещества и кислород, производимый растениями
- фототрофы – растения, производящие кислород в процессе фотосинтеза
Потери энергии, связанные с жизнедеятельностью всех организмов на Земле, возмещаются энергией Солнца. Следует подчеркнуть, что клетки животных и человека используют в качестве энергетического материала сильно восстановленные вещества (углеводы, липиды, белки), т.е. содержащие водород. Водород – энергетически ценное вещество. Его энергия переходит в энергию химических связей АТФ.
Обмен веществ и энергии является основой жизнедеятельности организмов и принадлежит к числу важнейших специфических признаков живой материи, отличающих живое от неживого. Сложнейшая регуляция обмена веществ на разных уровнях обеспечивается работой множества ферментных систем, это – саморегуляция химических превращений.
Ферменты – это высокоспециализированные белки, которые синтезируются в клетке из простых строительных блоков – аминокислот. Обмен веществ осуществляется при участии нескольких сотен различных типов ферментов. Реакции, катализируемые ферментами, дают 100%-ный выход без образования побочных продуктов. Каждый фермент ускоряет лишь какую-то цепь реакций данного соединения, не влияя на другие реакции с его (соединением) участием. Поэтому в клетке возможно протекание множества реакций без опасности загрязнения клетки побочными продуктами. Сотни реакций в клетках при участии ферментов организованы в виде последовательно идущих друг за другом реакций – стационарного потока.
В ходе химических превращений происходит перестройка электронных оболочек взаимодействующих атомов, молекул и ионов и перераспределение сил химической связи, что приводит к выделению энергии (если итогом взаимодействия является упрочнение связей между атомами, ионами и молекулами), либо к поглощению (если эти связи становятся более слабыми). Поэтому для всех химических реакций характерны не только глубокие качественные изменения и строго определенные стехиометрические соотношения между количествами исходных и образующихся в результате реакции веществ, но и вполне определенные энергетические эффекты.
Законы термодинамики
Первый закон термодинамики.
Катаболизм.
Расщепление основных пищевых веществ в клетке представляет собой ряд последовательных ферментативных реакций, составляющих 3 основные стадиикатаболизма (Ганс Кребс) – диссимиляция.
1 стадия – крупные органические молекулы распадаются на составляющие их специфические структурные блоки. Так, полисахариды расщепляются до гексоз или пентоз, белки – до аминокислот, нуклеиновые кислоты – до нуклеотидов и нуклеозидов, липиды – до жирных кислот, глицеридов и др. веществ.
Количество энергии, освобождающееся на этом этапе, невелико – менее 1%.
2 стадия – формируются ещё более простые молекулы, причём число их типов существенно уменьшается. Важно подчеркнуть, что здесь образуются продукты, которые являются общими для обмена разных веществ – это, как бы узлы, соединяющие разные пути метаболизма. К ним относятся: пируват – образуется при распаде углеводов, липидов, аминокислот; ацетил-КоА – объединяет катаболизм жирных кислот, углеводов, аминокислот.
Продукты, полученные на 2-й стадии катаболизма, вступают в 3-ю стадию, которая известна как цикл Кребса – цикл трикарбоновых кислот (ЦТК), в котором идут процессы терминального окисления. В ходе этой стадии все продукты окисляются до СО2 и Н2О. Практически вся энергия освобождается во 2-й и 3-ей стадиях катаболизма.
Все перечисленные выше стадии катаболизма или диссимиляции, которые известны как «схема Кребса» как нельзя более точно отражает важнейшие принципы метаболизма: конвергенцию и унификацию. Конвергенция – объединение различных метаболических процессов, характерных для отдельных видов веществ в единые, общие для всех видов. Следующий этап – унификация – постепенное уменьшение числа участников обменных процессов и использование в метаболических реакциях универсальных продуктов обмена.
На первом этапе четко прослеживается принцип унификации: вместо множества сложных молекул самого различного происхождения образуются достаточно простые соединения в количестве 2-3 десятков. Эти реакции происходят в желудочно-кишечном тракте и не сопровождаются выделением большого количества энергии. Она обычно рассеивается в виде тепла и не используется для других целей. Значение химических реакций первого этапа состоит в подготовке питательных веществ к действительному освобождению энергии.
На втором этапе четко прослеживается принцип конвергенции: слияние различных метаболических путей в единое русло – то есть в 3-й этап.
На 2-ом этапе освобождается около 30% энергии, содержащейся в питательных веществах. Остальные 60-70% энергии освобождается в цикле трикарбоновых кислот и связанного с ним процесса терминального окисления. В системе терминального окисления или дыхательной цепи, основу которого составляет окислительное фосфорилирование, унификация достигает своей вершины. Дегидрогеназы, катализирующие окисление органических веществ в ЦТК, передают на дыхательную цепь только водород, который в процессе окислительного фосфорилирования претерпевает одинаковые превращения.
Анаболизм.
Анаболизм проходит также три стадии. Исходные вещества – те, которые подвергаются превращениям на 3-ей стадии катаболизма. Таким образом, 3 стадия катаболизма – исходная стадия анаболизма. Реакции этой стадии имеют двойную функцию – амфиболическую. Например, синтез белка из аминокислот.
2 стадия – образование из кетокислот аминокислот в реакциях трансаминирования.
3 стадия – объединение аминокислот в полипептидные цепи.
Также, в результате последовательных реакций происходит синтез нуклеиновых кислот, липидов, полисахаридов.
В 60-70 гг XX века выяснилось, что анаболизм не есть простое обращение реакций катаболизма. Это связано с химическими особенностями химических реакций. Ряд реакций катаболизма практически необратимы. Их протеканию в обратном направлении препятствуют непреодолимые энергетические барьеры. В ходе эволюции были выработаны обходные реакции, сопряженные с затратой энергии макроэргических соединений. Катаболический и анаболический пути отличаются, как правило, локализацией в клетке – структурная регуляция.
Например: окисление жирных кислот осуществляется в митохондриях, тогда как синтез жирных кислот катализирует набор ферментов, локализованных в цитозоле.
Именно благодаря разной локализации катаболические и анаболические процессы в клетке могут протекать одновременно.
Принципы интеграции метаболизма
Таким образом, пути метаболизма многообразны, но в этом многообразии заложено единство, которое является специфической чертой обмена веществ.
Это единство состоит в том, что от бактерий до высокоорганизованной ткани высшего организма биохимические реакции тождественны. Другим проявлением единства является цикличность протекания важнейших обменных процессов. Например, цикл трикарбоновых кислот, цикл мочевины, пентозный цикл. Видимо, циклические реакции, отобранные в ходе эволюции, оказались оптимальными для обеспечения физиологических функций.
При анализе организации обменных процессов в организме закономерно возникает вопрос, как же достигается поддержание процессов в соответствии с потребностями организма в разные периоды его жизнедеятельности? Т.е. как поддерживается «гомеостаз» (понятие которое впервые сформировал Кеннон в 1929 г.) в условиях постоянно меняющихся жизненных ситуациий т.е. - при изменении внутренней среды и внешней. Выше уже упоминалось о том, что регуляция обмена веществ в конечном итоге сводится к изменению активности ферментов. В то же время можно говорить об иерархии метаболической регуляции.
Энергетический обмен
Биоэнергетика – это наука, изучающая энергообеспечение живых существ, иными словами, превращение энергии внешних ресурсов в биологически полезную работу. Первым, этапом преобразования энергии является энергизация мембраны- это генерирование трансмембраниой разности электрохимического потенциала ионов водорода или протонного потенциала (ΔμН+) и трансмембранной разности электрохимического потенциала натрия или натриевого потенциала (ΔμNа+).
Глава 6.
Представление о биологическом окислении
Биологическое окисление - это совокупность всех окислительно-восстановительных реакций, протекающих в живых организмах.
Пути утилизации кислорода
Кислород – сильный окислитель. Окислительно-восстановительный потенциал пары кислород/вода равен +0,82 в. Кислород обладает высоким сродством к электронам. Существует два пути утилизации кислорода в организме: оксидазный и оксигеназный.

 Окисление
Окисление
Оксидазный путь Оксигеназный путь
полное неполное
 окисление окисление
окисление окисление
конечный продукт моноокси- диокси- пероксидное
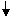 геназный геназный окисление
геназный геназный окисление

 Н2О Н2О2 путь путь
Н2О Н2О2 путь путь
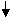
R-OH HO-R-OH R-O-O-H
Оксидазный путь
В основе оксидазного пути утилизации кислорода лежит реакция дегидрирования, в результате которой происходит отщепление 2-х атомов водорода (2Н↔2Н++2ē) от окисляемого субстрата с последующим переносом их на кислород.
Для полного восстановления кислорода до воды требуется две пары электронов
(4ē). Одномоментно к ½ О2 присоединяется 2 ē.


 2ē ½О2 + 2ē ОН-
2ē ½О2 + 2ē ОН-
 RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О
RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О

 2 Н+
2 Н+
Для неполного восстановления кислорода до пероксида водорода требуется одна пара электронов (2 ē). Одномоментно присоединяется один электрон.
 О2 + ē О2- супероксиданионрадикал
О2 + ē О2- супероксиданионрадикал
 О2 + Н+ НО•2 перекисный радикал
О2 + Н+ НО•2 перекисный радикал
 НО·2 + ē НО2- перекисный ион
НО·2 + ē НО2- перекисный ион
 НО-2 + Н+ Н2О2 пероксид водорода
НО-2 + Н+ Н2О2 пероксид водорода
Оксигеназный путь
В основе оксигеназного пути утилизации кислорода лежит непосредственное включение кислорода в окисляемый субстрат, с образованием соединений с одной или несколькими гидроксильными группами или органических соединений с пероксидной группой.
Монооксигеназы – ферментативные системы, катализирующие включение в модифицируемый субстрат только один атом кислорода, а второй атом кислорода восстанавливается до воды в присутствии НАДФН+Н+ как источника водорода.
RН2 + О2 + НАДФН+Н+ → R-OH + НАДФ+ + Н2О
Диоксигеназы – ферментативные системы, катализирующие включение в субстрат двух атомов кислорода.
 RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+
RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+
Общие пути метаболизма.
Ацетил-КоАявляется центральным метаболитом превращения глюкозы, жирных кислот и некоторых аминокислот.
ОН ОН
ТПФ – гидроксиэтил
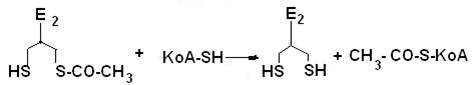
На второй стадии происходит акцептирование ацильного остатка коферментом A (KoA-SH) и образование ацетил-КоА. Транслокация ацильного остатка катализируется вторым ферментом комплекса – дигидролипоилтрансацетилазой. Переносчиком ацильного остатка является простетическоя группа фермента – липоевая кислота
(витаминоподобное соединение), которая может находиться в двух формах: окисленной и восстановленной.

(Восстановленная форма)
На третьей стадии происходит окисление восстановленной формы липоевой кислоты. Акцептором двух атомов водорода является кофермент НАД+. Реакцию окисления катализирует третий фермент - дигидролипоилдегидрогеназа, простетическойгруппой которого является ФАД.
НАДН + Н
+снабжает дыхательную цепь 2Н
+ и 2ē и обеспечивает синтез 3 молей АТФ.
,
Регуляция пируватдегидрогеназного комплекса (ПДГ)
Образование ацетил-КоА из пирувата – необратимая реакция, так как ΔG = - 33,5 кДж/моль. Активность пируватдегидрогеназного комплекса регулируется различными способами: аллостерической регуляцией и путем обратимого фосфорилирования (ковалентная модификация). [АТФ] / [АДФ] и [НАД+ ] / [НАДН] - важнейшие сигналы, отражающие энергетические потребности клетки. ПДГ активен в дефосфорилированной форме. Протеинкиназа ПДГ переводит фермент в неактивную фосфорилированную форму, а фосфатаза поддерживает ПДГ в активном дефосфорилированном состоянии. При насыщении клетки АТФ (повышается молярное отношение [АТФ] / [АДФ]) активируется протеинкиназа которая ингибирует ПДГ.
АТФ -это удаленный продукт реакции окислительного декарбоксилирования ПВК. Кроме АТФ активируют протеинкиназу продукты реакции: ацетил-КоА и НАДН. При выработке избытка энергии система регуляции блокирует образование Ацетил-КоА и, как следствие, снижает скорость ЦТК и синтеза АТФ.
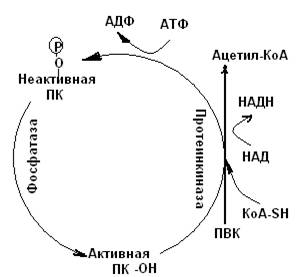
Рис.6-1. Регуляция активности протеинкиназы пируват декарбоксилазы путем
Цикл трикарбоновых кислот
Этот цикл называют также цикл Кребса, в честь Ганса Кребса (лауреата Нобелевской премии 1953 г.), определившего последовательность этих реакций. Цикл трикарбоновых кислот (ЦТК) – с одной стороны, является конечным этапом катаболизма белков, углеводов и липидов, который сопровождается генерированием восстановленных коферментов – универсальных энергетических субстратов – ФАДН2, НАДФН+Н+. Восстановленные коферменты далее используются митохондриальной цепью переносчиков электронов для генерации АТФ из АДФ и Фн. С другой стороны, промежуточные продукты ЦТК являются субстратами для биосинтеза эндогенных белковых веществ, соединений углеводной и липидной природы и других соединений.
Катаболическая функция ЦТК.
ЦТК - это последовательность 8 реакций, в результате которых ацетил-КоА (активная уксусная кислота) окисляется до двух молекул СО2 т.е. до конечного продукта метаболизма.
Ацетил-КоА - двууглеродная ацильная группа, характеризуется очень прочной С-С-связью. Непосредственное расщепление С-С-связи в ацетил-КоА представляет собой трудную химическую задачу. В природе существует весьма распространенное решение подобных задач – это циклическое превращение. ЦТК начинается с реакции конденсации ацетил-КоА с оксалоацетатом(ОАА) с образованием цитрата(лимонной кислоты) и заканчивается образованием ОААпри окислении малата,т.е. цикл замыкается. Все ферменты ЦТК локализуются в матриксе митохондрий и являются растворимыми белками. Исключением является сукцинат-дегидрогеназа, локализованная на поверхности внутренней мембраны митохондрий.
Реакция конденсации.
Ацетил-КоА + ОАА+ Н2О→цитрат + KoA-SH
Реакцию катализирует регулируемый фермент – цитратсинтаза.Это необратимая энергозависимая реакция, так как ΔG= - 32,2 кДж/моль. Источником энергии в этой реакции является энергия разрыва тиоэфирной связи в молекуле ацетил-КоА.
Цитрат– трикарбоновая оксикислота. Гидроксильная группа располагается у третичного атома С.По аналогия с третичными спиртами, цитрат не окисляется.
Реакция изомеризации.
В результате этой реакции происходит перемещение гидроксогруппы из 3-го во 2-е положение углеродной цепи цитрата и образование изомера лимонной кислоты - изоцитрата. Аконитаза – фермент, обладающий абсолютной стереоспецифичностью, катализирует последовательное отщепление Н2О, а затем присоединение ее в другое положение.
Цитрат→аконитат → изоцитрат
↓↓
Н2ОН2О
Изоцитрат - изомер лимонной кислоты, у которой ОН-группа располагается у вторичного атома углерода. По аналогии с вторичными спиртами изоцитрат может подвергаться окислению с образованием кетокислоты.
Реакция окисления.

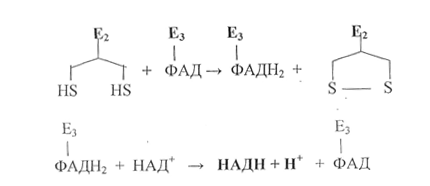
 Сукцинат фумарат
Сукцинат фумарат
ФАД ФАДН2
Реакция катализируется ФАД-зависимой сукцинатдегидрогеназой.Фермент обладает абсолютной стереоспецифичностью. Продуктом реакции является фумарат (транс-изомер). Восстановленный кофермент ФАДН2 снабжающий дыхательную цепь 2Н+ и 2ē для генерации АТФ
Реакция гидратации
Фумарат +Н2О → малат
Присоединение воды к фумарату катализируется фумаразой(традиционное название фермента). Продукт реакции – гидроксикислота - малат(яблочная кислота).
Реакция окисления.

 Малат ОАА
Малат ОАА
НАД+ НАДН+Н+
Реакция катализируется малатдегидрогеназой НАД+ -- зависимой.
ОАА включается в реакцию конденсации с новой молекулой ацетил-КоА, т.е. ЦТК замыкается. Восстановленный кофермент НАДН+Н+снабжает дыхательную цепь 2Н+ и 2ē и участвует в процессе окислительного фосфорилирования.
Стехиометрия ЦТК.
СН3-СО-S-KoA + 2Н2О +ЗНАД+ + ФАД + ГДФ + Н3РО4→2СО2 + 3НАДН+ЗН+ +ФАДН2, +ГТФ + KoA-SH, ΔG=-40,0 кДж/моль
Таким образом, в результате одного оборота цикла от ацетил-КоА отщепляется KoA-SH, а ацетильный остаток расщепляется до 2-х молекул СО2. Этот метаболический процесс сопровождается:
• образованием 4-х восстановленных коферментов: 3-х молекул НАДН +Н+ и 1 молекулы ФАДН 2;
• синтезом одной молекулы ГТФ, который далее фосфорилирует АДФ с образованием АТФ.
ГТФ + АДФ→ГДФ +АТФ
Энергетический эффект ЦТК.
За счет окислительного фосфорилировапия:
 3НАДН + Н+ → (6Н+и 6ē) ЦПЭ → 3 х ЗАТФ = 9 АТФ
3НАДН + Н+ → (6Н+и 6ē) ЦПЭ → 3 х ЗАТФ = 9 АТФ
ФАДН2 → 2Н+и 2ē → ЦПЭ → 2АТФ.
АТФ
За счет субстратного фосфорилирования – 1 АТФ
Итого: при окислении 1 молекулы Ацетил-КоА, при условии сопряжения реакций окисления с окислительным фосфорилированием генерируется 12 молекул АТФ.
Анаболическая функция ЦТК.
ЦТК служит источником интермедиатов (промежуточных метаболитов), которые являются субстратами многих биосинтетических реакций.
1. Сукцинил-КоА является субстратом для биосинтеза порфиринов. Внедрение в пор-фирин катиона железа приводит к образованию гема– простетической группы гемопротеидов (гемоглобина, миоглобина, каталазы, цитохромов и др.).
2. Цитрат может с помощью белков-переносчиков транспортироваться из матрикса митохондрий в цитоплазму, где при действии фермента цитратлиазы расщепляться с образованием цитозольного ацетил-КоА - субстрата для синтеза холестерина, ВЖК.
Цитрат + АТФ + КоА → ОАА + Ацетил-КоА + АДФ + Н3РО4.
З. ОАА - с помощью малат-аспартатного челночного механизма транспортируется из матрикса митохондрий в цитоплазму, где в реакции трансаминирования превращается в аспартат., в свою очередь, может трансформироваться в другие аминокислоты и участвовать в биосинтезе белка. Аспартат используется и в синтезе азотистых оснований и, таким образом, участвует в синтезе нуклеотидов и нуклеиновых кислот. ОАА (оксал-ацетат) в цитоплазме может подвергаться декарбоксилированию при действии фосфоенолпируваткарбоксикиназы в присутствии ГТФ с образованием ФЕП- промежуточного метаболита участвующего в синтезе глюкозы (в глюконеогенезе).
4. α-Кетоглутарат поступает в цитоплазму, где превращается в глутамин, пролин, гистидин, аргинин, которые далее включаются в синтез белковых веществ и других биологически важных соединений. Таким образом, ЦТК – это амфиболический цикл.
Протонный потенциал.
Трансмембранная разность электрохимического потенциала иона водорода, ΔμН+ или протонный потенциал занимает центральное положение в системе процессов трансформации энергии, протекающий во внутренней мембране митохондрий. За счет энергии внешних ресурсов протоны транспортируются через биологическую мембрану против сил электрического поля в направлении большей их концентрации, в результате генерируется разность электрохимического потенциала. ΔμН+ состоит из 2-х компонентов: электрического в форме трансмембранного градиента электрических потенциалов (Δφ) и химического, в форме трансмембранной концентрации ионов водорода (ΔрН). ΔμН+ =Δφ +ΔрН Потенциальная энергия, накопленная в виде Δφ и ΔрН, может быть утилизирована полезным образом, в частности, в синтезе АТФ.
Роль АТФ в обмене веществ
В биологических системах АТФ постоянно образуется и постоянно потребляется. Оборот АТФ очень высок. Например, человек в покое расходует около 40 кг АТФ в сутки. Энергопотребляющие процессы могут осуществляться при условии постоянного регенерирования АТФ из АДФ. Таким образом, цикл АТФ-АДФ – основной механизм обмена энергии в биологических системах.


 Н2О гидролиз Фн АТФ-зависимые
Н2О гидролиз Фн АТФ-зависимые

 АТФ АДФ процессы
АТФ АДФ процессы
 Фн
Фн
Фосфорилирование
Рис. 6- 1 Синтез АТФ
1. Гидролиз АТФ облегчает возможность протекания эндергонических реакций в нужном направлении при условии физиологически допустимых концентраций субстрата.
2. Гидролиз АТФ обеспечивает энергию, необходимую для совершения механической работы в сократительных тканях, таких, как мышцы.
3. Гидролиз АТФ создает движущую силу для транспорта ионов через клеточную мембрану, т.е. участвует в осмотической работе клетки.
4. Гидролиз АТФ обеспечивает передачу нервного импульса.
Синтез АТФ
Реакция синтеза АТФ – это реакция фосфорилирования АДФ неорганическим фосфатом (Рис. 6-1).
АДФ + Н3РО4 → АТФ + Н2О .
Это эндергоническая реакция, которая протекает только при поступлении свободной энергии извне, так как ΔG = + 30,5 кДж/моль
(+ 7.3 ккал/ моль). Следовательно, синтез АТФ может протекать лишь при условии энергетического сопряжения с экзергоническими реакциями. В зависимости от источника свободной энергии существует два пути синтеза АТФ: субстратное фосфорилирование иокислительное фосфорилирование.
СООН СООН
ФЕП ПВК
ΔG= - 61,9 кДж/моль (- 14,8 ккал/моль).
Путем непосредственного переноса остатка фосфорной кислоты, богатой энергией, с этих макроэргических соединений на АДФ и синтезируется АТФ.
ΣФЕП +АДФ→ПВК +АТФ
К макроэргическим соединениям относятся и соединения с тиоэфирными связями. Например, сукцинил~S-KoA. При разрыве тиоэфирной связи высвобождается энергия, которая используется на синтез ГТФ (ГДФ+Н3РО4 → ГТФ + Н2О). Сукцинил~S-KoA + ГДФ +Н3РО4→ Сукцинат + ГТФ + HS~КоА, ΔG=-35.5 кДж/моль.
Типы переносчиков
ФМН-содержащий переносчик электронов. По структуре ФМН представляет моно-нуклеотид, у которого в качестве азотистого основания служит изоаллоксазин, соединенный через рибозу с остатком фосфорной кислоты. При восстановлении он приобретает не только электроны, но и протоны. Ео = +0,12
ФМН + 2Н+ + 2ē ↔ ФМНН2
Железо-серные центры
Это белковые негемовые железосодержащие переносчики электронов. Имеются несколько типов железо-серных центров: Fe-S,Fe2-S2, Fe4-S4. Атомы железа комплексов могут отдавать и принимать электроны, поочередно переходя в ферро-(Fe2+) - и ферри-(Fe3+) - состояния. Все железо-серные центры отдают электроны убихинону.
Fe3+-S + 2ē ↔ Fe2+-S
Убихинон, кофермент-Q(KoQ) – единственный небелковый переносчик электронов.

КоQ (хинон) КоQ (семихинон) КоQН2 (гидрохинон)
Убихинон при восстановлении приобретает не только электроны, но и протоны. При одноэлектронном восстановлении он превращается в семихинон – органический свободный радикал. Ео=+0,01
Цитохромы – белковые переносчики электронов, в качестве простетической группы, содержащие гемовое железо. В основе функционирования цитохромов лежит изменение степени окисления атома железа Fe3+ +ē ↔ Fe2+. Различные цитохромы обозначаются буквенными индексами: b, с1, с, a, a3. Отличаются цитохромы по структуре белковой части и боковых цепей гема, в связи с этим они имеют и различные величины редокс-потенциалов (окислительно-восстановительных потенциалов). Цитохром «b» Ео = +0,08, «ci» Ео =+0,22, «с» Ео = +0,25, «ааз» Е о= +0,29. Отличительной особенностью цитохрома с является то,что он непрочно связан с внешней поверхностью внутренней мембраны митохондрий и легко покидает её.
Все эти переносчики электронов можно сгруппировать в четыре ферментативных комплекса, структурированные во внутренней мембране митохондрий, представляющие собой ферментативный ансамбль,получивший название «дыхательные ферменты»,«цитохромная система», «ЦПЭ»(цепь переноса электронов).
Комплекс I – НАДН-дегидрогеназа (НАДН-КоQ-редуктаза). Простетические группы -ФМН, FeS. Акцептор электронов – KoQ.
Комплекс III – КоQН2-дегидрогеназа (KoQH2 -цит.с-редуктаза). Простетические группы: FeS, цитохромы b1, b2, с1. Акцептор электронов – цитохром - с.
Комплекс IV – цитохромокcидаза. Простетические группы: цитохромы ааз, Си2+. Акцептор электронов– кислород.
Комплекс II – сукцинатдегидрогеназа (Сукцинат-КоQ-редуктаза). Простетические группы ФАД, FeS. Акцептор электронов – KoQ.
Между комплексами электроны транспортируются при помощи подвижных переносчиков - убихинона и цитохрома-с.
Окислительно-восстановительные переносчики в ЦПЭ расположены в порядке увеличения стандартных окислительных потенциалов, что обеспечивает самопроизвольный транспорт двух электронов по дыхательной цепи от НАДН+Н+ к кислороду - конечному акцептору электронов. Перенос двух электронов по ЦПЭ является полезной работой и сопровождается поэтапным высвобождением свободной энергии Гиббса (ΔG), которая далее используется в синтезе АТФ.Поэтапное высвобождение энергии приводит к тому, что электроны, которые восстанавливают кислород, находятся на более низком энергетическом уровне, по сравнению с электронами, находящимися в восстановленном НАДН +Н+ в начале цепи.
З. Генерирование протонного потенциала ΔμН+
Каким же образом осуществляется сопряжение транспорта электронов по дыхательной цепи с трансформацией высвободившейся электрической энергии в энергию химических связей АТФ? На этот вопрос в 1961 году дал ответ английский ученый Питер Митчелл. Его концепция заключалась в том, что движущей силой синтеза АТФ является электрохимический потенциал, протонный потенциал – ΔμH+. ΔμH+. = Δ рН+ Δ φ
рН — градиент протонов, Δφ – разность электрического потенциала. В 1978 году
П. Митчеллу была присуждена Нобелевская премия и хемиосмотическая теория стала общепризнанной.
По теории П. Митчелла высвобождающаяся поэтапно энергия в процессе транспорта электронов по дыхательной цепи используется для выкачивания протонов из матрикса митохондрий в межмембранное пространство. Транспорт 2Н+ из матрикса митохондрий в межмембранное пространство создает градиент концентрации протонов - ΔрН и приводит к возникновению отрицательного заряда на поверхности мембраны со стороны матрикса и положительного заряда со стороны межмембранного пространства, при этом создается разность электрических потенциалов – Δφ. Источником протонов в матриксе митохондрий является НАДН + Н+, ФАДН2, вода. Возможность генерирования протонного потенциала обеспечивается:
1) непроницаемостью внутренней мембраны митохондрий для ионов вообще и, особенно, для протонов.
2) раздельным транспортом протонов и электронов по дыхательной цепи. Это обеспечивается наличием переносчиков 2-х типов: только для электронов и электронов и протонов одновременно.
4. Синтез АТФ за счет протонного потенциала
Ферментативная система Н+ - АТФ- синтазный комплекс, АТФ-синтаза, АТФ-азакатализирует реакцию фосфорилирования АДФ неорганическимфосфатом за счет энергии которая аккумулирована в электрохимическом потенциале.
Протонная АТФ-синтаза состоит из 2-х субкомплексов: F1 иFo. F1 - субъединица представлена 5 видами полипептидных цепей и отвечает за синтез и гидролиз АТФ. Имеет форму шляпки гриба, выступающего в матрикс митохондрий и связана с мембранной белковой субъединицей Fо. Fo - это гидрофобный сегмент из 4-х полипептидных цепей, который пронизывают всю мембрану митохондрий и образует протонный каналв ферментативном комплексе. Через протонные каналы АТФ-синтазы происходит, возвращение протонов обратно вматрикс митохондрий. Существует предположение,что прохождение протонов сопровождается конформационными изменениями активных центров АТФ-синтазы, что и стимулирует синтез АТФ.
В соответствии с механизмом сопряжения окислительного фосфорилирования, предложенным Митчеллом, перенос двух протонов через, протонный канал АТФ-синтазы сопровождается синтезом одной молекулы АТФ.
Реакции окисления, катализируемые пиридинзависимыми дегидрогеназами, сопряжены с I-м комплексом ЦПЭ,поэтому высвобождающаяся поэтапно энергия обеспечивает транслокацию в межмембранное пространство трех пар протонови следовательно, синтез 3-х молекул АТФ.
Реакции окисления, катализируемые флавинзависимыми дегидрогеназами, сопряжены с III-м комплексом ЦПЭ и в межмембранное пространство переносятся лишь две пары протонов,следовательно, синтезируется 2 АТФ.
Реакция окисления аскорбиновой кислотыс




 Окисление
Окисление

 Н2О Н2О2 путь путь
Н2О Н2О2 путь путь


 2ē ½О2 + 2ē ОН-
2ē ½О2 + 2ē ОН- RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О
RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О
 2 Н+
2 Н+ О2 + Н+ НО•2 перекисный радикал
О2 + Н+ НО•2 перекисный радикал НО·2 + ē НО2- перекисный ион
НО·2 + ē НО2- перекисный ион НО-2 + Н+ Н2О2 пероксид водорода
НО-2 + Н+ Н2О2 пероксид водорода RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+
RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+



 Сукцинат фумарат
Сукцинат фумарат
 Малат ОАА
Малат ОАА 3НАДН + Н+ → (6Н+и 6ē) ЦПЭ → 3 х ЗАТФ = 9 АТФ
3НАДН + Н+ → (6Н+и 6ē) ЦПЭ → 3 х ЗАТФ = 9 АТФ

 Н2О гидролиз Фн АТФ-зависимые
Н2О гидролиз Фн АТФ-зависимые
 АТФ АДФ процессы
АТФ АДФ процессы Фн
Фн



