Как известно из термодинамики, при постоянной температуре и постоянном давлении, та фаза будет находиться в равновесии, для которой наблюдается минимум изобарно-изотермического потенциала G = H – TS.
H = U + PV и G = U + PV - TS
В частности для твердой фазы: U = U 0 + UТ + UE, где U 0– потенциальная энергия решетки при Т = 0 К; UТ – энергия тепловых колебаний атомов при данной температуре; UЕ – энергия упругих искажений решетки за счет растворения чужеродных атомов; Р – внешнее давление; V – объем занимаемой фазой; S – энтропия; Т – абсолютная температура; Н – энтальпия фазы. Отметим, что в общем случае равновесное состояние системы определяется минимумом того термодинамического потенциала (G, U, H или F), который описывает ее состояние при выбранных переменных параметрах.
Энтропия всегда положительна (S>0) и возрастает с повышением температуры, поэтому с ростом температуры G уменьшается (рис. 3.5 а); при этом кривая G(T) всегда обращена выпуклостью вверх.

|
| Рисунок 3.5. – Зависимость изобарно-изотермного потенциала для жидкой и твердой фаз постоянного состава от температуры (а) и от состава (б) для жидких и твердых фаз переменного состава при Т =const, при которой в равновесном состоянии находится твердая фаза
|
Если сравнить температурные зависимости G для двух фаз (жидкой и твердой рис. 3.5 а), то наклон кривых всегда будет различным из-за различия S, поэтому кривые должны пересечься.
Наклон кривой G = f (T) будет круче у той фазы, у которой S больше. Энтропия жидкой фазы больше энтропии твердой фазы того же состава, поэтому кривая для жидкой фазы снижается резче, чем для твердой. Точка пересечения Т равн соответствует температуре фазового превращения. Ниже и выше этой температуры стабильны разные фазы, обладающие соответственно меньшим значением G.
Рассмотрим концентрационную зависимость G в системе, образованной компонентами А и В. В идеальном случае, когда компоненты А и В совсем не растворяются друг в друге, любой сплав данной системы представляет собой механическую смесь компонентов А и В, и термодинамический потенциал любого сплава системы находят по правилу аддитивности.
Если же компонент В растворим в компоненте А, то вплоть до состава, отвечающего предельной концентрации (ХВ нас), зависимость G от концентрации будет изображаться непрерывной кривой, обращенной выпуклостью вниз, т. е. равновесное растворение связано с уменьшением величины G раствора.
Рассмотрим ход кривой  вблизи компонента А (рис. 3.5 б), т. е. в области очень разбавленных растворов.
вблизи компонента А (рис. 3.5 б), т. е. в области очень разбавленных растворов.
В этой области  равно тангенсу угла между касательной к кривой G=f (X) и осью X и, следовательно, химическому потенциалу компонента В в растворе концентрации
равно тангенсу угла между касательной к кривой G=f (X) и осью X и, следовательно, химическому потенциалу компонента В в растворе концентрации 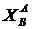 :
:

| (3.23)
|
|
Для идеальных растворов 
| (3.24)
|
|
где 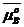 – химический потенциал 1 моля чистого компонента В (величина, зависящая только от природы компонента В ); R – универсальная газовая постоянная, равная kNA, где k – постоянная Больцмана, NA – число Авогадро, Поэтому
– химический потенциал 1 моля чистого компонента В (величина, зависящая только от природы компонента В ); R – универсальная газовая постоянная, равная kNA, где k – постоянная Больцмана, NA – число Авогадро, Поэтому
 (3.25) (3.25)
|
|
Для бесконечно разбавленных растворов ХВ → 0 и соответственно ln ХВ → – ∞ и tgα → – ∞.
Это означает, что кривая G=f(XB) касается оси ординат, но особенно важно то, что при малых концентрациях компонента В производная 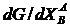 является всегда отрицательной величиной. Следовательно, если примесь растворяется в чистом компоненте, то это сопровождается уменьшением изобарно-изотермного потенциала раствора. Это означает, что в этих случаях процесс всегда должен идти в сторону загрязнения чистого компонента.
является всегда отрицательной величиной. Следовательно, если примесь растворяется в чистом компоненте, то это сопровождается уменьшением изобарно-изотермного потенциала раствора. Это означает, что в этих случаях процесс всегда должен идти в сторону загрязнения чистого компонента.
Этот вывод важен для процессов получения высокочистых металлических, полупроводниковых и диэлектрических материалов и подчеркивает необходимость сведения к минимуму практически неизбежных загрязнений из окружающей среды, материала тиглей и т. д. Отметим, что во всех известных экспериментальных работах было установлено, что всегда присутствует хотя бы ничтожная растворимость компонентов друг в друге.
Термодинамические характеристики растворов. Протяженность области существования раствора (как твердого, так и жидкого) определяется рядом его характеристик, в том числе и термодинамическими характеристиками. Введем эти характеристики для двухкомпонентных растворов. Большинство термодинамических функций раствора не может быть получено путем аддитивного сложения термодинамических функций компонентов, образующих раствор. В частности раствор, образуется только в том случае, если при введении в растворитель добавки понижается изобарно-изотермический потенциал растворителя. Рассмотрим термодинамические функции 1 моля раствора в общем виде (индексы α – функции, относящиеся к раствору, о – функции, относящиеся к чистым компонентам):
где индексом α – обозначен раствор,а индексом 0 – компонента,  – изобарно-изотермические потенциалы раствора и компонентов А и В;
– изобарно-изотермические потенциалы раствора и компонентов А и В;  – изобарно-изотермический потенциал смешения раствора; ХА и ХВ – концентрация компонентов А и В в растворе;
– изобарно-изотермический потенциал смешения раствора; ХА и ХВ – концентрация компонентов А и В в растворе;  – энтропии раствора и компонентов А и В;
– энтропии раствора и компонентов А и В;  – энтропия смешения раствора;
– энтропия смешения раствора;  – энтальпия раствора и компонентов А и В;
– энтальпия раствора и компонентов А и В; 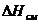 – энтальпия смешения раствора;
– энтальпия смешения раствора; 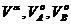 – объемы раствора и чистых компонентов А и В;
– объемы раствора и чистых компонентов А и В;  – объем смешения раствора.
– объем смешения раствора.
На основании 1-го и 2-го законов термодинамики можно показать, что
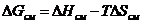
| (3.27)
|
Если при описании термодинамических функций раствора учитывать только парные взаимодействия между ближайшими атомами, то можно показать, что Δ Нсм и Δ Sсм равняются следующим величинам:

| (3.28)
|

| (3.29)
|
где Ω АВ – параметр взаимодействия между компонентами А и В в растворе. (В общем случае величина Ω АВ зависит от концентрации компонентов и температуры. В тех случаях, когда Ω АВ практически постоянен, величина Δ Нсм раствора зависит только от концентрации ХА и ХВ).
В свою очередь, параметр взаимодействия равен:

| (3.30)
|
где Z – среднее координационное число в растворе, НАВ, НАА и НВВ – энтальпии связей А−В, А−А и В−В.
Задача. Определить среднее координационное число − Z для двухкомпонентного раствора, состоящего из 40% компонента А и 60% компонента − В, если валентность компонента А равна 3, а компонента В – 2.
В зависимости от структуры и величины термодинамических функций смешения, а также величины коэффициента активности 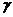 может быть выделен ряд типов растворов. Остановимся на рассмотрении только двух типов растворов: идеального и регулярного. В приближении этих типов растворов могут быть описаны многие металлические и полупроводниковые растворы, как в твердом, так и в жидком состоянии. Однако следует учитывать ограниченность моделей идеального и регулярного растворов в первую очередь потому, что в них учитывается взаимодействие только между ближайшими соседями. В таблице 3.4. приведены термодинамические характеристики идеального и регулярного растворов. Из значения этих характеристик следует определение этих типов растворов.
может быть выделен ряд типов растворов. Остановимся на рассмотрении только двух типов растворов: идеального и регулярного. В приближении этих типов растворов могут быть описаны многие металлические и полупроводниковые растворы, как в твердом, так и в жидком состоянии. Однако следует учитывать ограниченность моделей идеального и регулярного растворов в первую очередь потому, что в них учитывается взаимодействие только между ближайшими соседями. В таблице 3.4. приведены термодинамические характеристики идеального и регулярного растворов. Из значения этих характеристик следует определение этих типов растворов.
В общем случае  , Δ Нсм, Δ Sсм,
, Δ Нсм, Δ Sсм,  – учитывают взаимодействие между атомами в растворе.
– учитывают взаимодействие между атомами в растворе.
Таблица 3.4. – Термодинамические характеристики растворов
| Термодинамическая характеристика
| Значение термодинамической характеристики для:
|
| идеального раствора
| регулярного раствора
|
| ∆Vсм
|
| ≠ 0
|
| ∆Hсм
| 0 (Ω=0)
| XAXBΩAB
|
| ∆Sсм
| - R (XA lnXA – XB lnXB)
| - R (XA lnXA – XB lnXB)
|
| ∆Gсм
| RТ (XA lnXA – XB lnXB)
| XAXBΩAB+ RТ (XA lnXA + XB lnXB)
|
| аА (концентрация)
| XA
| XA exp [ΩAB(1- XA)2/(RT)]
|
| аВ (концентрация)
| XB
| XB exp [ΩAB(1- XB)2/(RT)]
|
| γA (коэффициент активности А)
|
| exp ΩAB(1- XA)2/RT
|
| γB (коэффициент активности В)
|
| exp ΩAB(1- XB)2/RT
|
Для идеального раствора (механическая смесь, нет взаимодействия между компонентами А и В)  = 0, Δ Нсм = 0, Н0 и V0 аддитивны, то есть определяются простым сложением компонент; для регулярного раствора (В растворяется в А, есть взаимодействие А с В, и Ω≠ 0)
= 0, Δ Нсм = 0, Н0 и V0 аддитивны, то есть определяются простым сложением компонент; для регулярного раствора (В растворяется в А, есть взаимодействие А с В, и Ω≠ 0)  ≠ 0, Δ Нсм≠ 0 Н0 и V0 не аддитивны (изменение энтальпии, смешение атомов разного рода).
≠ 0, Δ Нсм≠ 0 Н0 и V0 не аддитивны (изменение энтальпии, смешение атомов разного рода).
Из термодинамики следует, что образование идеального раствора в стандартных условиях сопровождается изменением изобарно-изотермического потенциала смешения:

| (3.31)
|
где – ХА и ХВ – концентрация компонентов – А и В в растворе.
В случае равновесного сосуществования двух идеальных растворов (жидкого и твердого) с учетом отсчета от стандартного состояния (Т пл А > Т пл В ) изменение Δ Gсм отдельно для каждого из растворов имеет вид:

| (3.32)
|

| (3.33)
|
В тоже время известно, что при фазовом переходе

| (3.34)
|
Для чистого компонента в точке его плавления (Т=Тпл) термодинамические потенциалы жидкой и твердой фазы равны:
Откуда для чистого компонента
При температуре, отличающейся от Тпл,
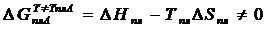 . .
|
Учитывая зависимость  и пренебрегая небольшой температурной зависимостью
и пренебрегая небольшой температурной зависимостью  и
и 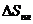 при замене
при замене 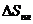 отношением
отношением  получаем для каждого из компонентов при Т ≠ Тпл соответственно:
получаем для каждого из компонентов при Т ≠ Тпл соответственно:

| (3.35)
|

| (3.36)
|
При равновесии (сосуществовании) жидкой и твердой фаз химический потенциал µ для каждого из компонентов одинаков как в жидком так и в твердом растворе:

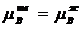
т.е. справедливы следующие соотношения:
Проведем дальнейший расчет относительно компонента В. Продифференциируем уравнения (3.32) и (3.33) и учитывая, что ХА = 1 – ХВ, получим соответственно:

| (3.37)
|

|
(3.38)
|
Заменяя 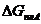 и
и  их значениями из (3.35) и (3.36) и приравнивая правые части равенств (3.37) и (3.38) получим:
их значениями из (3.35) и (3.36) и приравнивая правые части равенств (3.37) и (3.38) получим:
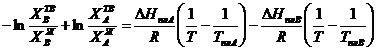
| (3.39)
|
Рассмотрим сплавы вблизи чистого компонента А, т.е.

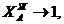 а
а 
при таких условиях значения
 и
и 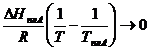
Отсюда получаем
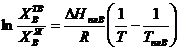
|
(3.40)
|
Повторяя аналогичные рассуждения для области диаграммы вблизи компонента В, получаем

| (3.41)
|
|
Уравнение линии ликвидуса для равновесия с α-твердым раствором в области малых концентраций компонента В, т.е. при 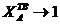 имеет вид
имеет вид
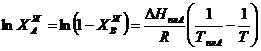
|
(3.42)
|
В случае образования регулярных жидких растворов уравнение (3.42) преобразуется к виду
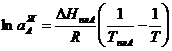
| (3.43)
|
Расчет линий ликвидуса и солидуса в системе Ge-Si, проведенный с помощью выражений (3.40) и (3.41), дает хорошее соответствие расчетных и экспериментальных данных. Это косвенно свидетельствует о том, что германий и кремний образуют между собой практически близкие к идеальным жидкие и твердые растворы.
В других случаях такого соответствия нет. Чем дальше растворы от идеальных, тем больше различие расчетных и экспериментальных данных. Таким образом, выражения (3.40) и (3.41) могут быть использованы лишь в первом приближении в системах с неограниченной растворимостью компонентов.
Если жидкий раствор идеальный, а твердый раствор регулярный (т. е. изменение энтальпии при смешении атомов разного рода в твердом растворе  ), то выражения (3.40) и (3.41) преобразуются к виду:
), то выражения (3.40) и (3.41) преобразуются к виду:
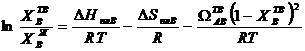
| (3.44)
|
или

| (3.45)
|
В наиболее общем виде для регулярных растворов выражения (3.44) и (3.45) преобразуются в уравнение вида:

| (3.46)
|
где  и
и  – энтальпия и энтропия плавления того компонента, отношение концентраций которого в твердой и жидкой фазах рассматривается в левой части равенства;
– энтальпия и энтропия плавления того компонента, отношение концентраций которого в твердой и жидкой фазах рассматривается в левой части равенства;  и
и  – концентрация i – того компонента в жидкой и твердой фазах соответственно.
– концентрация i – того компонента в жидкой и твердой фазах соответственно.
Однако использовать уравнение (3.46) для построения линий ликвидуса и солидуса не всегда удается из-за отсутствия термодинамических характеристик растворов и их температурной и концентрационной зависимостей. Они, как правило, известны лишь для ограниченного числа систем. Поэтому, чаще задача решается в обратной последовательности: экспериментально строят фазовые диаграммы и по положению линий ликвидуса и солидуса на этих диаграммах определяют термодинамические характеристики для данной системы.
Построение ДФР с неограниченной растворимостью по данным об изменении термодинамического потенциала. Для построения диаграмм фазового равновесия двухкомпонентных систем, для которых известно, что взаимодействие компонентов приводит к образованию непрерывного ряда твердых и жидких растворов, и известны температуры плавления чистых компонентов ( и
и 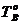 ) и их температурные зависимости
) и их температурные зависимости 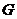 (Т) поступают следующим образом:
(Т) поступают следующим образом:
1) для нескольких температур, лежащих в интервале между температурами плавления компонентов ( <
<  <
< 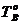 ), строят изотермические кривые, отражающие концентрационные зависимости изобарно-изотермных потенциалов твердой и жидкой фаз (рис. 3.6. а, б);
), строят изотермические кривые, отражающие концентрационные зависимости изобарно-изотермных потенциалов твердой и жидкой фаз (рис. 3.6. а, б);
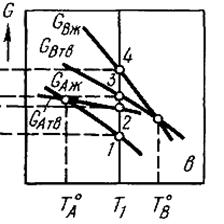 а) температурная зависимость
а) температурная зависимость  для чистых компонентов А и В в твердом и жидком состояниях для чистых компонентов А и В в твердом и жидком состояниях 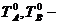 температуры плавления компонентов А и В температуры плавления компонентов А и В
|  б) зависимость
б) зависимость  для жидкой и твердой фаз переменного состава при постоянной температуре Т1 (ХВж и ХВтв – составы жидкой и твердой фаз, находящихся в равновесии при Т=Т1) для жидкой и твердой фаз переменного состава при постоянной температуре Т1 (ХВж и ХВтв – составы жидкой и твердой фаз, находящихся в равновесии при Т=Т1)
|

| в) кривые ликвидуса и солидуса
Рисунок 3.6. – Схема построения кривых ликвидуса и солидуса по данным о температурных зависимостях  чистых компонентов чистых компонентов  и и  в твердой и жидкой фазе (а), о концентрационной зависимости в твердой и жидкой фазе (а), о концентрационной зависимости  твердой и жидкой фаз в случае двухкомпонентной системы с неограниченной растворимостью компонентов в твердом и жидком состояниях (а); б) температурная зависимость твердой и жидкой фаз в случае двухкомпонентной системы с неограниченной растворимостью компонентов в твердом и жидком состояниях (а); б) температурная зависимость  для чистых компонентов А и В в твердом и жидком состояниях ( для чистых компонентов А и В в твердом и жидком состояниях ( и и  – составы жидкой и твердой фаз, находящихся в равновесии при – составы жидкой и твердой фаз, находящихся в равновесии при  ) )
| |
| | | | |
2) с помощью графического дифференцирования этих кривых находят координаты фигуративных точек, лежащих при выбранной температуре на кривых ликвидуса и солидуса и отвечающих составам жидкой и твердой фаз, находящихся в равновесии. Координаты фигуративных точек находят с учетом того, что величины химических потенциалов компонентов в этих точках равны: µтв = µж; или  ;
;  (рис. 3.6. б),
(рис. 3.6. б),
3) по полученным фигуративным точкам строят кривые ликвидуса и солидуса (рис. 3.6. в).
4) находят точки, лежащие на кривых ликвидуса и солидуса, при Т=Т1. Находят такие точки для других температур.
Коэффициент распределения. Отношение  /
/  в выражениях (3.45) и (3.46) представляет собой важную характеристику равновесия между твердой и жидкой фазами (кристалл – расплав). Это отношение концентрации растворенного компонента в твердой в жидкой фазе при той же температуре называют коэффициентом распределения:
в выражениях (3.45) и (3.46) представляет собой важную характеристику равновесия между твердой и жидкой фазами (кристалл – расплав). Это отношение концентрации растворенного компонента в твердой в жидкой фазе при той же температуре называют коэффициентом распределения:
k 0 =  , при постоянной температуре
, при постоянной температуре
Из диаграммы фазового равновесия могут быть найдены величины равновесных коэффициентов распределения. Однако поскольку линии ликвидуса и солидуса, как правило, криволинейны, коэффициент распределения k0 зависит от концентрации Xi:
k 0 =f (Xi)
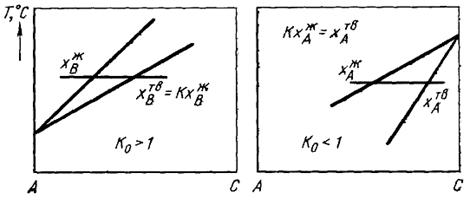
Для приближенной оценки значения k0 линии ликвидуса и солидуса обычно заменяют касательными к ним вблизи основного компонента (растворителя), как это показано рис. 3.7. В этом случае значение k0 в области малых концентраций можно считать независящим от концентрации k 0  f (Xi).
f (Xi).
Как следует из рис. 3.7., коэффициент k0 > 1 соответствует тому случаю, когда примесь повышает температуру плавления растворителя. При k0 < 1 температура плавления растворителя понижается при растворении в нем примеси.
|
| Рисунок 3.7. – Положение линий ликвидуса и солидуса вблизи компонента –растворителя для случаев k0 > 1 и k0 < 1.
|
Знание значений коэффициентов распределения необходимо при разработке режимов очистки металлов и полупроводниковых материалов методом зонной плавки: чем больше отличается k0 от единицы, тем эффективнее очистка.
Из элементарных алмазоподобных полупроводников (Ge, Si, C) диаграмму фазового равновесия с неограниченной растворимостью образуют только Ge и Si. Они полностью отвечают вышеперечисленным требованиям.
Si и C (алмаз) отвечают требованиям по химической связи (природе) и типу решетки, но очень сильно различаются по размеру ковалентных тетраэдрических радиусов:
RSi=0,117 нм, Rc=0,077 нм, 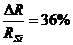 » (10÷15)%
» (10÷15)%
Поэтому растворимость С в Si не превышает долей процента, а Si в С еще меньше.
Неограниченная растворимость – очень распространенное явление среди полупроводниковых соединений. Их образуют между собой многие соединения классов: АIIIBV, АIIBVI, АIVBVI, АIIIBV АVBVI и др.
Такие твердые растворы находят широкое применение. Этому способствует то, что твердые растворы полупроводников с неограниченной растворимостью позволяют получать сплавы с любыми значениями ширины запрещенной зоны, периода решетки (межатомных расстояний), коэффициентов термического расширения и ряда других параметров. Периоды решетки, в первом приближении изменяются аддитивно (правило Вегарда), другие параметры – по более сложным законам. Учитывая возможности, создаваемыми такими твердыми растворами, установление зависимостей их свойств от состава является важной материаловедческой задачей.
Задачи:
3.1. Определите энтропии плавления 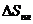 для Fe, W, Si, Te и сопоставьте полученные значения с характером изменения химических связей этих веществ при плавлении (температуры плавления Fe, W, Si и Te составляют 1530, 3416, 1412 и 450о С соответственно).
для Fe, W, Si, Te и сопоставьте полученные значения с характером изменения химических связей этих веществ при плавлении (температуры плавления Fe, W, Si и Te составляют 1530, 3416, 1412 и 450о С соответственно).
3.2. Ge содержит в одинаковых концентрациях фоновые (вредные) примеси Cu (koCu = 1,5·10-5) и Sn (koSn = 2·10-2). Перед получением из такого материала совершенного монокристалла по методу Чохральского (из жидкого раствора-расплава) его подвергают зонной плавке для понижения концентрации Cu и Sn на несколько порядков величины. Какая из примесей требует меньшего числа проходов зонной плавки?
3.3. Как изменится значение коэффициента распределения примеси (при k0 < 1 и k0 > 1) при увеличении скорости роста кристалла вследствие увеличения переохлаждения расплава.
3.4. Вода (лед) образует с неизвестной примесью раствор с неограниченной растворимостью компонентов в жидком и твердом состоянии. При этом примесь повышает температуру плавления льда. При некоторой температуре Т система находится в двухфазном состоянии (Тв + Ж). В какой из фаз концентрация примеси меньше при этой Т?
3.5. Воду с примесью вынесли на мороз. Половина воды замерзла. Где примеси будет больше: в незамерзшей воде или во льду? Задачу рассмотреть для двух случаев: 1) k0 > 1 (примесь увеличивает температуру плавления льда); 2) k0 < 1 (примесь понижает температуру плавления льда).
§ 6. Т – Х – диаграммы фазовых равновесий двойных систем с ограниченной растворимостью компонентов
Неограниченная растворимость компонентов друг в друге встречается относительно редко, значительно чаще их взаимодействие носит сложных характер.
В пределах одной двойной системы в различных интервалах концентраций могут реализоваться (и часто реализуются) разные фазы, что приводит к усложнению диаграмм фазового равновесия.
Переход от неограниченной растворимости к ограниченной. Термодинамический анализ позволяет качественно, а во многих случаях и количественно, объяснить переход от диаграммы с неограниченной растворимостью к другим типам фазовых диаграмм. Исходным пунктом для решения вопроса о результатах взаимодействия атомов разного сорта при их смешении является знак изобарно-изотермного потенциала смешения:
Величина  сложно зависит от ряда факторов, основными из которых являются два:
сложно зависит от ряда факторов, основными из которых являются два:
1) химический, учитывающий степень химического сродства компонентов (их валентность, электроотрицательность, тип решетки);
2) геометрический, учитывающий разницу в «размерах атомов» взаимодействующих компонентов при образовании раствора: 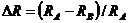 , где
, где  и
и  – атомные радиусы компонентов А и В, определяемые химической связью, возникающей при образовании раствора.
– атомные радиусы компонентов А и В, определяемые химической связью, возникающей при образовании раствора.
Усиление химического сродства компонентов уменьшает внутреннюю энергию фазы  и, следовательно, величину энтальпии, поскольку
и, следовательно, величину энтальпии, поскольку

| (3.47)
|
поэтому в этом случае  должно быть отрицательным.
должно быть отрицательным.
Увеличение разницы в размерах взаимодействующих атомов  должно вызывать возрастание внутренней энергии
должно вызывать возрастание внутренней энергии  и соответственно энтальпии
и соответственно энтальпии  , в том числе в случае твердого раствора за счет увеличения энергии упругой деформации решетки (
, в том числе в случае твердого раствора за счет увеличения энергии упругой деформации решетки ( ); при этом
); при этом  должно быть положительным.
должно быть положительным.
Нужно различать случаи химического взаимодействия при образовании твердого раствора между ближайшими соседними атомами одного сорта (А – А) или (В – В) и взаимодействие между ближайшими соседними атомами разного сорта (А – В). Соответствующие энергии связи (энтальпии) обозначим  и
и  .
.
В случае идеального раствора энергия связи пар атомов разного сорта будет равна среднему арифметическому от энергии связи пар атомов одного сорта, т. е.

| (3.48)
|
В этом случае энтальпия смешения  = 0, так же как и параметр взаимодействия Ω = 0 (см. табл. 3.4).
= 0, так же как и параметр взаимодействия Ω = 0 (см. табл. 3.4).
В реальном растворе  . Знак величины энтальпии смешения зависит от знака Ω. Величина
. Знак величины энтальпии смешения зависит от знака Ω. Величина  , так же как и Ω, может быть отрицательной или положительной.
, так же как и Ω, может быть отрицательной или положительной.
Следует, однако, учитывать, что результат взаимодействия компонентов определяется величиной  только при низких температурах: Т →0. С повышением температуры в соответствии с выражением (3.27) становится значительной роль произведения
только при низких температурах: Т →0. С повышением температуры в соответствии с выражением (3.27) становится значительной роль произведения  (так называемого энтропийного члена).
(так называемого энтропийного члена).
Диаграммы фазовых равновесий с эвтектическим превращением. В двойных системах, в которых кристаллические структуры компонентов различаются, а их растворение друг в друге приводит к понижению температур кристаллизации, могут происходить эвтектические٭ превращения.
Диаграмма с эвтектикой схематически показана на рис. 3.8 а. Она состоит из шести фазовых областей: однофазная область жидкого раствора Ж, двухфазные области жидкий раствор Ж +твердый раствор α и жидкий раствор Ж +твердый раствор β; однофазные области первичных твердых растворов α и β; двухфазная область сосуществования твердых растворов α+β.
Наклонные линии ликвидуса А ' е и В ' е представляют собой геометрическое место фигуративных точек жидких растворов предельной концентрации при соответствующих температурах.
Наклонные линии солидуса А ' с и B ' d являются геометрическим местом фигуративных точек твердых растворов предельной концентрации, существующих при определенных температурах, превышающих эвтектическую температуру T e.
Горизонтальная линия ced является эвтектической линией. Только три точки на линии ced являются фигуративными, они характеризуют предельную концентрацию твердых растворов α (точка с) и β (точка d) и жидкого раствора (точка е) при температуре эвтектического превращения.
٭ эвтектика (eutektos – (греч) – легко плавящийся) – тонкая смесь твердых веществ, одновременно выкристаллизовывающихся из расплава при температуре более низкой, чем температура плавления отдельных компонентов.

|
Рисунок 3.8. – Фазовая диаграмма двойной системы с эвтектическим разрывом растворимости:
а – фазовые равновесия;
б – кривая охлаждения сплавов, указанных на диаграмме; в – кривые изобарно-изотермных потенциалов жидких и твердых фаз при температуре эвтектики Т е: 
|

| в)
|
На рис. 3.8 в приведено строение кривых изобарно-изотермных потенциалов твердых растворов α и β и жидкого раствора при температуре эвтектики. Эвтектическая температура Т е и положение эвтектической точки (точки е) в случае образования в системе идеальных жидких растворов и при малой растворимости компонентов друг в друге в твердом состоянии могут быть рассчитаны из совместного решения уравнений ликвидуса компонентов А и В:

|
(3.49)
|
Особенность эвтектической линии ced состоит также в том, что при эвтектической температуре (Т е) в сплавах состава от с до d в равновесии находятся три фазы указанного выше состава.
Задача. Определить число степеней свободы С в сплавах от с до d при Т е.
Наклонные линии ас и bd – геометрические места фигуративных точек твердых растворов предельной концентрации, существующих при температурах ниже эвтектической (кривые растворимости).
В ходе охлаждения из однофазной области при температуре пересечения линии состава с наклонной линией диаграммы сплав оказывается в состоянии предельно насыщенного раствора. Ниже точки пересечения начинается распад пересыщенного раствора с выделением другой фазы, состав которой характеризует точка пересечения коноды со второй наклонной линией, ограничивающей данную двухфазную область. При охлаждении в пределах двухфазной области одновременно изменяются как состав обеих фаз, так и их количественное соотношение.
В сплавах составов от с до d при охлаждении происходит распад жидкого раствора состава е на два твердых раствора составов с и d по реакции:
| Ж е↔ Тв с + Тв d (охлаждение ↔ нагрев)
| (3.50)
|
На диаграмме рис. 3.8 а показаны линии составов четырех характерных сплавов и соответствующие им кривые охлаждения с указанием фазового состава сплавов в различных температурных интервалах. Протяженность площадки на кривой охлаждения, связанной с нонвариантным превращением для сплавов Х 3 и Х е, пропорциональна количеству жидкого расплава, превращающегося в эвтектическую смесь при температуре Т е. Для сплава Х е это количество составляет 100%, а для сплавов X 1 и Х 2 0%, для всех остальных определяется по правилу рычага или по закону аддитивности1.
Следует обратить внимание на то, что при охлаждении любого сплава, лежащего в двухфазной области α+β, начиная с температуры Т е, изменяется состав обоих твердых растворов по кривым са и db (при этом они обедняются растворенным компонентом) и количественное соотношение фаз определяется по правилу рычага.
Для диаграмм с эвтектикой возникает необходимость ввести, кроме понятия «фаза», еще понятие «структурная составляющая». Для диаграммы с неограниченной растворимостью эти понятия совпадали.
В области α+β диаграммы с эвтектикой фазовый состав для любого сплава одинаков – это смесь из фаз α и β, но по условиям образования этих фаз, характеру их расположения и форме частиц сплавы различаются. Это различие существенно, поскольку свойства сплавов зависят не только от состава фаз, но также и от геометрии и характера взаиморасположения частиц фазовых составляющих.
Структурными составляющими являются первичные кристаллы, выделяющиеся из пересыщенного жидкого расплава по наклонным линиям (солидус) диаграммы; вторичные кристаллы, выделяющиеся из пересыщенного твердого раствора по наклонным линиям (линии растворимос




 вблизи компонента А (рис. 3.5 б), т. е. в области очень разбавленных растворов.
вблизи компонента А (рис. 3.5 б), т. е. в области очень разбавленных растворов. равно тангенсу угла между касательной к кривой G=f (X) и осью X и, следовательно, химическому потенциалу компонента В в растворе концентрации
равно тангенсу угла между касательной к кривой G=f (X) и осью X и, следовательно, химическому потенциалу компонента В в растворе концентрации 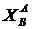 :
:

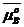 – химический потенциал 1 моля чистого компонента В (величина, зависящая только от природы компонента В ); R – универсальная газовая постоянная, равная kNA, где k – постоянная Больцмана, NA – число Авогадро, Поэтому
– химический потенциал 1 моля чистого компонента В (величина, зависящая только от природы компонента В ); R – универсальная газовая постоянная, равная kNA, где k – постоянная Больцмана, NA – число Авогадро, Поэтому (3.25)
(3.25)
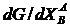 является всегда отрицательной величиной. Следовательно, если примесь растворяется в чистом компоненте, то это сопровождается уменьшением изобарно-изотермного потенциала раствора. Это означает, что в этих случаях процесс всегда должен идти в сторону загрязнения чистого компонента.
является всегда отрицательной величиной. Следовательно, если примесь растворяется в чистом компоненте, то это сопровождается уменьшением изобарно-изотермного потенциала раствора. Это означает, что в этих случаях процесс всегда должен идти в сторону загрязнения чистого компонента. ;
;
 ;
;
 ;
;
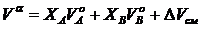
 – изобарно-изотермические потенциалы раствора и компонентов А и В;
– изобарно-изотермические потенциалы раствора и компонентов А и В;  – изобарно-изотермический потенциал смешения раствора; ХА и ХВ – концентрация компонентов А и В в растворе;
– изобарно-изотермический потенциал смешения раствора; ХА и ХВ – концентрация компонентов А и В в растворе;  – энтропии раствора и компонентов А и В;
– энтропии раствора и компонентов А и В;  – энтропия смешения раствора;
– энтропия смешения раствора;  – энтальпия раствора и компонентов А и В;
– энтальпия раствора и компонентов А и В; 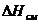 – энтальпия смешения раствора;
– энтальпия смешения раствора; 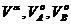 – объемы раствора и чистых компонентов А и В;
– объемы раствора и чистых компонентов А и В;  – объем смешения раствора.
– объем смешения раствора.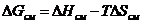



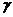 может быть выделен ряд типов растворов. Остановимся на рассмотрении только двух типов растворов: идеального и регулярного. В приближении этих типов растворов могут быть описаны многие металлические и полупроводниковые растворы, как в твердом, так и в жидком состоянии. Однако следует учитывать ограниченность моделей идеального и регулярного растворов в первую очередь потому, что в них учитывается взаимодействие только между ближайшими соседями. В таблице 3.4. приведены термодинамические характеристики идеального и регулярного растворов. Из значения этих характеристик следует определение этих типов растворов.
может быть выделен ряд типов растворов. Остановимся на рассмотрении только двух типов растворов: идеального и регулярного. В приближении этих типов растворов могут быть описаны многие металлические и полупроводниковые растворы, как в твердом, так и в жидком состоянии. Однако следует учитывать ограниченность моделей идеального и регулярного растворов в первую очередь потому, что в них учитывается взаимодействие только между ближайшими соседями. В таблице 3.4. приведены термодинамические характеристики идеального и регулярного растворов. Из значения этих характеристик следует определение этих типов растворов.




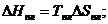

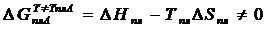 .
.
 и пренебрегая небольшой температурной зависимостью
и пренебрегая небольшой температурной зависимостью  и
и 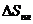 при замене
при замене  получаем для каждого из компонентов при Т ≠ Тпл соответственно:
получаем для каждого из компонентов при Т ≠ Тпл соответственно:


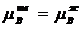
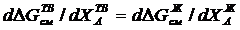



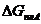 и
и  их значениями из (3.35) и (3.36) и приравнивая правые части равенств (3.37) и (3.38) получим:
их значениями из (3.35) и (3.36) и приравнивая правые части равенств (3.37) и (3.38) получим: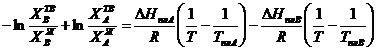

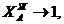 а
а 
 и
и 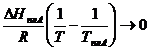
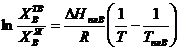

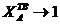 имеет вид
имеет вид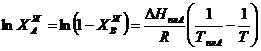
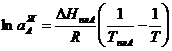
 ), то выражения (3.40) и (3.41) преобразуются к виду:
), то выражения (3.40) и (3.41) преобразуются к виду: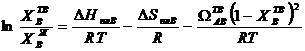


 и
и  – энтальпия и энтропия плавления того компонента, отношение концентраций которого в твердой и жидкой фазах рассматривается в левой части равенства;
– энтальпия и энтропия плавления того компонента, отношение концентраций которого в твердой и жидкой фазах рассматривается в левой части равенства;  и
и  – концентрация i – того компонента в жидкой и твердой фазах соответственно.
– концентрация i – того компонента в жидкой и твердой фазах соответственно. и
и  ) и их температурные зависимости
) и их температурные зависимости  (Т) поступают следующим образом:
(Т) поступают следующим образом: <
<  а) температурная зависимость
а) температурная зависимость  для чистых компонентов А и В в твердом и жидком состояниях
для чистых компонентов А и В в твердом и жидком состояниях  температуры плавления компонентов А и В
температуры плавления компонентов А и В
 б) зависимость
б) зависимость 
 чистых компонентов
чистых компонентов  и
и 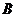 в твердой и жидкой фазе (а), о концентрационной зависимости
в твердой и жидкой фазе (а), о концентрационной зависимости  и
и  – составы жидкой и твердой фаз, находящихся в равновесии при
– составы жидкой и твердой фаз, находящихся в равновесии при  )
)
 ;
;  (рис. 3.6. б),
(рис. 3.6. б), , при постоянной температуре
, при постоянной температуре f (Xi).
f (Xi).
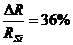 » (10÷15)%
» (10÷15)%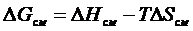
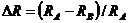 , где
, где  и
и  – атомные радиусы компонентов А и В, определяемые химической связью, возникающей при образовании раствора.
– атомные радиусы компонентов А и В, определяемые химической связью, возникающей при образовании раствора. и, следовательно, величину энтальпии, поскольку
и, следовательно, величину энтальпии, поскольку
 должно быть отрицательным.
должно быть отрицательным. должно вызывать возрастание внутренней энергии
должно вызывать возрастание внутренней энергии  , в том числе в случае твердого раствора за счет увеличения энергии упругой деформации решетки (
, в том числе в случае твердого раствора за счет увеличения энергии упругой деформации решетки ( ); при этом
); при этом  и
и  .
.
 . Знак величины энтальпии смешения зависит от знака Ω. Величина
. Знак величины энтальпии смешения зависит от знака Ω. Величина  (так называемого энтропийного члена).
(так называемого энтропийного члена).






