| константу равновесия реакции
|
|
| направление смещения равновесия при введении катализатора
(1 – вправо, 2 – влево, 3 – не смещается)
|
|
В обратимой реакции
NO2(г) + NO(г) D N2O3(г); ∆H° = –40,4 кДж
исходные концентрации NO2 и NO равны 0,5 и 0,2 моль/л. К моменту наступления равновесия прореагировало 20 % NO. Определите
| константу равновесия
| 0,54
|
| направление смещения равновесия при увеличении давления
(1 – вправо, 2 – влево, 3 – не смещается)
|
|
Для обратимой реакции
PCl5(г) D PCl3(г) + Cl2(г); ∆H° = 92,6 кДж
Укажите
| условия смещения равновесия в сторону прямой реакции
(1 - повышение температуры, понижение давления; 2 - повышение температуры и давления; 3 – понижение температуры и давления; 4 – понижение температуры, повышение давления)
|
|
| факторы, от которых зависит константа равновесия
(1 – концентрация веществ, 2 – присутствие катализатора, 3 – давление, 4 – температура)
|
|
В обратимой реакции
NO2(г) + NO(г) D N2O3(г); ∆H° = –40,4 кДж
равновесные концентрации [NO2] = 0,2 моль/л, [NO] = 0,5 моль/л, [N2O3] = 0,3 моль/л. Определите
| константу равновесия
|
|
| направление смещения равновесия при увеличении концентрации продукта реакции (1 – вправо, 2 – влево, 3 – не смещается)
|
|
В обратимой реакции
СO(г) + Cl2(г) D СOCl2(г)
равновесные концентрации [Сl2] = 0,02 моль/л, [CO] = 0,06 моль/л, [COCl2] = 0,03 моль/л. Определите
| константу равновесия
|
|
| направление смещения равновесия при увеличении концентрации хлора
(1 – вправо, 2 – влево, 3 – не смещается)
|
|
Приведено уравнение обратимой реакции
2H2O(г) + C(графит) D CO2(г) + 2H2(г); ∆H0 > 0
и математические выражения закона действующих масс для этой реакции:
1)  2)
2)  3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| направление смещения равновесия при повышении температуры
(1 - вправо, 2 - влево, 3 - не смещается)
|
|
Приведено уравнение обратимой реакции
C(графит) + 2H2(г) D CH4(г); ∆H° = –74 кДж
И математические выражения закона действующих масс для этой реакции
1)  2)
2)  3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| факторы, приводящие к смещению равновесия вправо (1 - повышение температуры, 2 - повышение давления, 3 - увеличение концентрации водорода, 4 - понижение давления)
|
|
Приведено уравнение обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = 172 кДж
И математические выражения закона действующих масс для этой реакции
1)  2)
2)  3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| условия смещения равновесия в сторону прямой реакции (1 - повышение температуры, понижение давления; 2 - повышение температуры, повышение давления; 3 - понижение температуры, понижение давления; 4 - понижение температуры, повышение давления)
|
|
Для обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = –172 кДж
приведены математические выражения закона действующих масс:
1)  2)
2) 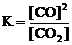 3)
3) 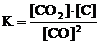 4)
4) 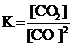 .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| факторы, приводящие к смещению равновесия влево (1 - повышение температуры, 2 - повышение давления, 3 - увеличение концентрации СО2, 4 - уменьшение концентрации СО)
|
|
Для обратимой реакции
MgCO3(к) D MgO(к) + CO2(г), ∆H° = 118 кДж
приведены математические выражения закона действующих масс:
1)  2)
2)  3)
3)  4)
4) 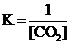 .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| условия смещения равновесия в сторону прямой реакции
(1 - повышение температуры, понижение давления, 2 - повышение температуры и давления, 3 - понижение температуры и давления, 4 - понижение температуры, повышение давления)
|
|
Для обратимой реакции
N2(г) + O2(г) D 2NO(г), ∆H° = 180 кДж
приведены математические выражения закона действующих масс:
1)  2)
2)  3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| условия смещения равновесия в сторону прямой реакции
(1 - повысить температуру, 2 - повысить концентрацию О2, 3 - понизить температуру, 4 - понизить концентрацию N2)
|
|
Для обратимой реакции
C(графит) + СO2(г) D 2CO(г); ∆H° = -172 кДж
приведены математические выражения закона действующих масс:
1)  2)
2)  3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения закона действующих масс
|
|
| условия смещения равновесия вправо (1 – увеличение давления,
2 – уменьшение давления, 3 – введение катализатора, 4 – понижение температуры)
|
|
Для обратимой реакции
SO2(г) + 2СО(г) D 2СО2(г) + S(к); ∆H° = –269,1 кДж
приведены математические выражения закона действующих масс:
1) 
 2)
2) 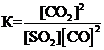 3)
3)  4)
4) 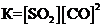 .
.
Укажите
| номер правильного выражения константы равновесия
|
|
| условия смещения равновесия в сторону продуктов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления)
|
|
Для обратимой реакции
SO2(г) + 2H2S(г) D 2Н2О(г) + 3S(к); ∆H° = –144,7 кДж
приведены математические выражения закона действующих масс:
1)  2)
2) 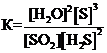 3)
3) 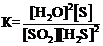 4)
4)  .
.
Укажите
| номер правильного выражения константы равновесия
|
|
| условия смещения равновесия в сторону продуктов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления)
|
|
Для обратимой реакции
СO2(г) + Мg(к) D MgO(к) + С(графит); ∆H° = –208,3 кДж
приведены математические выражения закона действующих масс:
1)  2)
2) 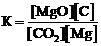 3)
3)  4)
4)  .
.
Укажите
| номер правильного выражения константы равновесия
|
|
| направление смещения равновесия при увеличении температуры
(1 – вправо; 2 – влево; 3 – не смещается)
|
|
Для обратимой реакции
СaO(к) + 3С(графит) D СО(г) + СaC2(к); ∆H° = –462,2кДж
приведены математические выражения закона действующих масс:
1)  2)
2) 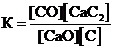 3)
3) 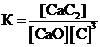 4)
4) 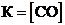 .
.
Укажите
| номер правильного выражения константы равновесия
|
|
| условия смещения равновесия в сторону реагентов (1 – повышение температуры, 2 – повышение давления, 3 – понижение температуры, 4 – понижение давления)
|
|
Для обратимых реакций
1) H2(г) + I2(г) D 2HI(г) 2) CO(г) + Cl2(г) D COCl2(г)
3) C(графит) + СO2(г) D 2CO(г) 4) N2(г) + 3H2(г) D 2NH3(г)



 2)
2)  3)
3)  4)
4)  .
. 2)
2)  3)
3)  4)
4)  .
. 2)
2)  3)
3)  4)
4)  .
.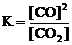 3)
3) 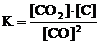 4)
4) 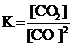 .
. 2)
2)  3)
3)  4)
4) 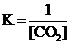 .
. 2)
2)  3)
3)  4)
4)  .
. 2)
2)  3)
3)  4)
4)  .
.
 2)
2) 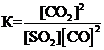 3)
3)  4)
4) 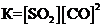 .
. 2)
2) 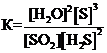 3)
3) 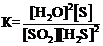 4)
4)  .
. 2)
2) 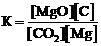 3)
3)  4)
4)  .
. 2)
2) 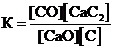 3)
3) 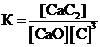 4)
4) 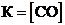 .
.


