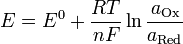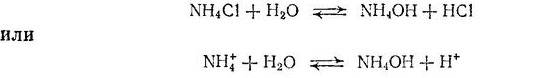Потенциал электрода, как видно из этого уравнения, зависит от активности ионов которые являются потенциалопределяющими
Переход от нормальной к эквивалентной концентрации
Эквивалентная, или нормальная концентрация — отношение числа эквивалентов растворенного вещества к объему раствора. Концентрация, выраженная этим способом, обозначается Снили (после численного значения нормальности) буквой н.
Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть смешаны, чтобы растворенные вещества прореагировали без остатка.
На основании этой зависимости можно не только вычислять требуемые для проведения реакций объемы растворов, но и обратно, по объемам затраченных на реакцию растворов находить их концентрации.
Возможность расчета относительных молекулярных масс на основе законов Рауля
Изучая замерзание и кипение растворов, Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации раствора:
Здесь t— молярная концентрация (моляльность); Е и К — эбуллиоскопическая* и криоскопическая” постоянные, зависящие только от природы растворителя, по не зависящие от природы растворенного вещества. Для воды криоскопическая постоянная К равна 1,86, эбуллиоскопическая постоянная Е равна 0,52. Для бензола К = 5,07, Е = 2,6.
На измерениях температур кипения и замерзания растворов основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ. Оба метода широко используются в химии, так как, применяя различные растворители, можно определять молекулярные массы разнообразных веществ.
Гидролиз солей сильных кислот и слабых оснований
В случае соли, образованной слабым основанием и сильной кислотой, гидролизу подвергается катион соли и реакция сопровождается образованием ионов Н+, например
Накопление ионов Н+ приводит к уменьшению концентрации ионов ОН-. Таким образом, растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию.
Вывод константы и степени гидролиза
Вывод степени гидролиза
Обозначается α (или h гидр);
α = (c гидр/ c общ)·100%
где c гидр— число молей гидролизованной соли, c общ— общее число молей растворённой соли.
Вывод константы гидролиза
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:
Уравнение константы равновесия для данной реакции имеет вид:
или
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянныхможно заменить одной новой — константой гидролиза:
Численное значение константы гидролиза получим, используя ионное произведение воды и константу диссоциации азотистой кислоты:
подставим в уравнение константы гидролиза равна:
В общем случае для соли, образованной слабой кислотой и сильным основанием:
, где — константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
, где — константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием: