Строение алкенов
С2Н4, СН2=СН2
Номенклатура и изомерия
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -ен: этан — этен, пропан — пропен и т.д.
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С=СН— - винил (этенил)
Н2С=CН—СН2 - - аллил (пропенил-2)
Для алкенов характерны 4 вида изомерии.
· Изомерия разветвления углеродного скелета;
· Изомерия положения двойной связи;
· Геометрическая изомерия;
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля. В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr2О3). Например:
H3C—CH2—CH2—CH3 → H2C=CH—CH2—CH3 + H2 бутен-1
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
H2C—CH2 + КОН → H2C=CH2 + KCl + H2O
2. Дегидратация спиртов:
С2Н5ОН → С2Н4 + Н2О
Химические свойства алкенов:
+ О2 (горение)
- разложение
- изомеризация (начиная с бутена)
+ галогены (присоединение)- с бромной водой – качественная реакция на двойную связь
+ галогеноводороды (присоединение)
+ вода (присоединение, гидратация)
+ водород (присоединение, гидрирование)
+ KMnO4(обесцвечивание раствора) – качественная реакция на двойную связь
полимеризация –
1. Применение: Получение полимеров.
2. Исходное сырье для органического синтеза.
Билет 3. Алкины, общая химическая формула. Ацетилен, строение, свойства, применение ацетилена.
Алкины - непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Алкины образуют гомологический ряд с общей формулой CnH2n-n
Строение алкинов
Простейшим представителем алкинов, его родоначальником является ацетилен (этин) С2Н2. Строение его молекула можно выразить такими формулами:
СН≡СН
Получение ацетилена
В природе ацетилен не встречается.
В промышленности - неполное разложение метана: 2СН4→С2Н2 + 3Н2
В лаборатории – карбидный способ: СаС2 + 2H2O → С2Н2 + Са(ОН)2
Химические свойства ацетилена:
+ О2 (горение)
-разложение
-полимеризация (димеризация –образуется винилацетилен, тримеризация – образуется бензол))
+ галогены (присоединение)- с бромной водой – качественная реакция на двойную связь
+ галогеноводороды (присоединение)
+ вода (присоединение, гидратация – образуется этаналь, уксусный альдегид). Гомологи образуют кетоны.
+ водород (присоединение, гидрирование)
+ KMnO4(обесцвечивание раствора) – качественная реакция на тройную связь связь
Применение:
3. Получение полимеров.
4. Исходное сырье для органического синтеза.
Билет № 4
Билет № 7
Природные источники углеводородов: газ, нефть, каменный уголь. Их переработка и практическое применение.
Основными природными источниками углеводородов являются нефть, природный и попутный нефтяной газы и каменный уголь.
Природный и попутный нефтяной газы.
Природный газ – смесь газов, основным компонентом которой является метан, остальное приходится на долю этана, пропана, Бутана, и небольшого количества примесей – азота, оксида углерода (IV), сероводорода и паров воды. 90% его расходуется в качестве топлива, остальные 10% используют как сырье для химической промышленности: получение водорода, этилена, ацетилена, сажи, различный пластмасс, медикаментов и др.
Попутный нефтяной газ – это тоже природный газ, но он встречается вместе с нефтью – находится над нефтью или растворен в ней под давлением. Попутный газ содержит 30 – 50% метана, остальная часть приходится на его гомологи: этан, пропан, бутан и другие углеводороды. Кроме того, в нем присутствуют те же примеси, что и в природном газе.
Три фракции попутного газа:
1. Газовый бензин; его добавляют к бензину для улучшения запуска двигателя;
2. Пропан-бутановая смесь; применяется как бытовое топливо;
3. Сухой газ; используют для получения ацителена, водорода, этилена и других веществ, из которых в свою очередь производят каучуки, пластмассы, спирты, органические кислоты и т.д.
Нефть.
Нефть – маслянистая жидкость от желтого или светло-бурого до черного цвета с характерным запахом. Она легче воды и в ней практически нерастворима. Нефть представляет собой смесь примерно 150 углеводородов с примесями других веществ, поэтому у нее нет определенной температуры кипения.
90% добываемой нефти используется как сырье для производства различных видов топлива и смазочных материалов. В то же время нефть – ценное сырье для химической промышленности.
Нефть, добываемую из земных недр, называю сырой. В сыром виде нефть не применяют, ее подвергают переработке. Сырую нефть очищают от газов, воды и механических примесей, а затем подвергают фракционной перегонке.
Перегонка – процесс разделения смесей на отдельные компоненты, или фракции, на основании различия их температур кипения.
При перегонке нефти выделяют несколько фракций нефтепродуктов:
1. Газовая фракция (tкип = 40°С) содержит нормальные и разветвленные алканы СН4 – С4Н10;
2. Бензиновая фракция (tкип = 40 - 200°С) содержит углеводороды С5Н12 – С11Н24; при повторной перегонке из смеси выделяют легкие нефтепродукты, кипящие в более низких интервалах температур: петролейный эфир, авиационный и автомобильный бензин;
3. Лигроиновая фракция (тяжелый бензин, tкип = 150 - 250°С), содеожит углеводороды состава С8Н18 – С14Н30, применяют в качестве горючего для тракторов, тепловозов, грузовых автомобилей;
4. Керосиновая фракция (tкип = 180 - 300°С) включает углеводороды состава С12Н26 - С18Н38; ее используют в качестве горючего для реактивных самолетов, ракет;
5. Газойль (tкип = 270 - 350°С) используют как дизельное топливо и в больших масштабах подвергается крекингу.
После отгонки фракций остается темная вязкая жидкость – мазут. Из мазута выделяют соляровые масла, вазелин, парафин. Остаток от перегонки мазута – гудрон, его применяют при производстве материалов для дорожного строительства.
Вторичная переработка нефти основана на химических процессах:
1. Крекинг – расщепление крупных молекул углеводородов на более мелкие. Различают термический и каталитический крекинг, который более распространен в настоящее время.
2. Риформинг (ароматизация) - это превращение алканов и циклоалканов в ароматические соединения. Этот процесс осуществляют путем нагревания бензина при повышенном давлении в присутствии катализатора. Риформинг применяют для получения из бензиновых фракций ароматических углеводородов.
3. Пиролиз нефтепродуктов проводят нагреванием нефтепродуктов до температуры 650 - 800°С, основными продуктами реакции являются непредельные газообразные и ароматические углеводороды.
Нефть – сырье для производства не только топлива, но и многих органических веществ.
Каменный уголь.
Каменный уголь так же является источником энергии и ценным химическим сырьем. В состав каменного угля в основном органические вещества, а также вода, минеральные вещества, при сжигании образующие золу.
Одним из видов переработки каменного угля является коксование – это процесс нагревания угля до температуры 1000°С без доступа воздуха. Коксование угля проводят в коксовых печах. Кокс состоит из практически чистого углерода. Его используют в качестве восстановителя при доменом производстве чугуна на металлургических заводах.
Летучие вещества при конденсации каменноугльную смолу (содержит много различных органических веществ, из них большая часть – ароматические), аммиачную воду (содержит аммиак, соли аммония) и коксовый газ (содержит аммиак, бензол, водород, метан, оксид углерода (II), этилен, азот и другие вещества).
Билет №8
Физические свойства
Бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества.
Химические свойства
Пищевая промышленность
Сельское хозяйство.
Медицинская промышленность
Способы получения
1.Из каменноугольной смолы.
2.Взаимодействие галогенпроизводных ароматических УВ со щелочами:
C6H5-Cl + NaOH → C6H5-OH + NaCl
Применение фенолов
Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов и других полимеров, лекарственных препаратов, красителей, поверхностно-активных веществ, антиоксидантов, антисептиков, взрывчатых веществ.
Билет № 11
Билет № 12
1. Предельные одноосновные карбоновые кислоты. Общая формула. Строение и свойства на примере уксусной кислоты.
Карбоновые кислоты - производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп –СООН
Общая формула предельных одноосновных карбоновых кислот СnH2n+1COOH
Химические свойства:

| Образуются соли уксусной кислоты –ацетаты, муравьиной – формиаты.
| |
+Me
+MeO
+MeOH
+ карбонаты
+ аммиак
+ спирты – образуются сложные эфиры
+ галогены – образуются галогенопроизводные кислоты (хлоруксусная, дихлоруксусная…)
Из всех карбоновых кислот уксусная находит наиболее широкое применение: в химической промышленности для получения искусственных волокон, пластмасс, негорючей кинопленки, красителей, медикаментов.
Билет № 13
Жиры
+вода (гидролиз) – образуются глицерин и карбоновые кислоты, происходит в организме под действием ферментов.
+ Щелочь (щелочной гидролиз) – образуются глицерин и соли карбоновых кислот (мыла)
+Н2 (гидрирование, для жидких жиров, содержащих остатки непредельных кислот) – образуются твердые жиры.
Жиры - одна из основных групп веществ, входящих, наряду с белками и углеводами, в состав всех растительных и животных клеток.
Жиры обладают высокой энергетической ценностью, при полном окислении в живом организме 1 г жира выделяется 37,7 кДж, что в два раза больше, чем при окислении 1 г белка или углевода.
Билет № 14
1. Крахмал и целлюлоза, физические и химические свойства, применение. Понятие об искусственных волокнах на примере ацетатного волокна.
Крахмал и целлюлоза - природные полисахариды, состоящие из остатков молекулы глюкозы.
Их формула (С6Н10О5)n
Так как по строению молекулы этих веществ очень похожи, то привожу сравнительную таблицу, в которой сравнивается строение и свойства этих вещест
Билет № 15
1. Глюкоза – представитель моносахаридов, химическое строение, физические и химические свойства, применение.
Глюко́за (C6H12O6), или виноградный сахар встречается в соке многих фруктов и ягод, в том числе и винограда, отчего и произошло название этого вида сахара. Является шестиатомным сахаром (гексозой).
Физические свойства
Белое кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях.
Строение молекулы
CH2-CH-CH-CH-CH-CHO





OH OH OH OH OH
Глюкоза может существовать в виде циклов (α и β глюкозы).
Глюкоза — конечный продукт гидролиза большинства дисахаридов и полисахаридов.
Получение
В промышленности глюкозу получают гидролизом крахмала и целлюлозы.
Химические свойства

| Окисление, образуется глюконовая кислота
| |
+ O
2
+Cu(OH)2 (при нагревании)
+Ag2O (аммиачный раствор)
+Н2 - восстановление – образуется шестиатомный спирт – сорбит
+ Cu(OH)2 (без нагревания) – реагирует как многоатомный спирт
- спиртовое брожение – образуется этанол и углекислый газ
- молочнокислое брожение – образуется молочная кислота
- масляно-кислое брожение – образуется масляная кислота (бутановая), углекислый газ, Н2
Биологическая роль
Глюкоза — основной продукт фотосинтеза, образуется в цикле Кальвина.
В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов.
Применение
Глюкозу используют при интоксикации (например при пищевом отравлении или деятельности инфекции), вводят внутривенно струйно и капельно, так как она является универсальным антитоксическим средством.
Билет № 16
Физические свойства.
Аминокислоты представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде и малорастворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус.
Химические свойства
+ кислоты (проявляются основные свойства)
 +основания
+основания
| (Проявляются кислотные свойства)
| |
+оксиды металлов
+металлы
+спирты
+ аммиак
+аминокислоты – образование пептидов
Биологическая роль аминокислот заключается в том, что из их остатков образуется первичная структура белка. Существует 20 аминокислот, которые являются исходными веществами для производства белков в нашем организме. Некоторые аминокислоты применяются в качестве лечебных средств, например глутаминовую кислоту - при нервных заболеваниях, гистидин – при язве желудка. Некоторые аминокислоты находят применение в пищевой промышленности, их добавляют в консервы и пищевые концентраты для улучшения пищи
Билет № 17
1. Анилин – представитель аминов. Химическое строение и свойства, получение и практическое применение. 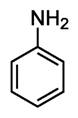
Формула C6H5NH2
Физические свойства.
Анилин- бесцветная маслянистая жидкость со слабым характерным запахом, малорастворим в воде, но хорошо растворим в спирте, эфире, бензоле. Температура кипения 184°C. Анилин- сильный яд, действует на кровь.
Химические свойства.
+кислоты (реакции по аминогруппе)
Получение.
Восстановление нитросоединений – реакция Зинина
C6H5NО2 + Н2 → C6H5NН2 + Н2О
Применение.
Производство красителей: анилинового черного, метилового зеленого, анилинового красного и др. На его основе получают полимеры, взрывчатые вещества, сульфаниламидные лекарственные препараты.
Билет № 18
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α -аминокислот (которые являются мономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификации происходят уже после синтеза белка на рибосоме).
Свойства
Белки являются амфотерными веществами, также как и аминокислоты, из остатков которых они состоят..
Денатурация: Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной, третичной и вторичной структур белка, называемой денатурацией. Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок альбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима.
Гидролиз: Под воздействием ферментов происходит гидрол белка до составляющих его аминокислот. Этот процесс происходит, например, в желудке человека под воздействием таких ферментов как пепсина и трипсина.
Цветные реакции на белки:
А) Ксантопротеиновая реакция: белок + азотная кислота → желтое окрашивание
Б) Биуретовая реакция: белок + свежеприготовленный гидроксид меди (II) – фиолетовое
В) Цистеиновая реакция: белок + ацетат свинца в щелочной среде → черное окрашивание.
Функции белков в организме
Каталитическая функция
Структурная функция
Защитная функция
Транспортная функция
Строение алкенов
С2Н4, СН2=СН2
Номенклатура и изомерия
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -ен: этан — этен, пропан — пропен и т.д.
Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н2С=СН— - винил (этенил)
Н2С=CН—СН2 - - аллил (пропенил-2)
Для алкенов характерны 4 вида изомерии.
· Изомерия разветвления углеродного скелета;
· Изомерия положения двойной связи;
· Геометрическая изомерия;
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля. В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr2О3). Например:
H3C—CH2—CH2—CH3 → H2C=CH—CH2—CH3 + H2 бутен-1
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
H2C—CH2 + КОН → H2C=CH2 + KCl + H2O
2. Дегидратация спиртов:
С2Н5ОН → С2Н4 + Н2О
Химические свойства алкенов:
+ О2 (горение)
- разложение
- изомеризация (начиная с бутена)
+ галогены (присоединение)- с бромной водой – качественная реакция на двойную связь
+ галогеноводороды (присоединение)
+ вода (присоединение, гидратация)
+ водород (присоединение, гидрирование)
+ KMnO4(обесцвечивание раствора) – качественная реакция на двойную связь
полимеризация –
1. Применение: Получение полимеров.
2. Исходное сырье для органического синтеза.
Билет 3. Алкины, общая химическая формула. Ацетилен, строение, свойства, применение ацетилена.
Алкины - непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь.
Алкины образуют гомологический ряд с общей формулой CnH2n-n
Строение алкинов
Простейшим представителем алкинов, его родоначальником является ацетилен (этин) С2Н2. Строение его молекула можно выразить такими формулами:
СН≡СН
Получение ацетилена
В природе ацетилен не встречается.
В промышленности - неполное разложение метана: 2СН4→С2Н2 + 3Н2
В лаборатории – карбидный способ: СаС2 + 2H2O → С2Н2 + Са(ОН)2
Химические свойства ацетилена:
+ О2 (горение)
-разложение
-полимеризация (димеризация –образуется винилацетилен, тримеризация – образуется бензол))
+ галогены (присоединение)- с бромной водой – качественная реакция на двойную связь
+ галогеноводороды (присоединение)
+ вода (присоединение, гидратация – образуется этаналь, уксусный альдегид). Гомологи образуют кетоны.
+ водород (присоединение, гидрирование)
+ KMnO4(обесцвечивание раствора) – качественная реакция на тройную связь связь
Применение:
3. Получение полимеров.
4. Исходное сырье для органического синтеза.
Билет № 4






 +основания
+основания



