Однако на отщеплении внешнесферных ионов процесс электролитической диссоциации не заканчивается. Комплексные ионы, в свою очередь, подвергаются обратимой электролитической диссоциации, уже как слабые электролиты, по схеме:
[ML n ]  M + n L
M + n L
Такая диссоциация, разумеется, протекает ступенчато: лиганды удаляются из внутренней сферы постепенно, один за другим (точнее, происходит реакция замещения лиганда на молекулы растворителя - воды).
Для упрощения записи в качестве примера взят незаряженный комплекс, а продукт диссоциации представлен в негидратированном виде.
Аналогичным образом происходит и обратный процесс - образование комплекса. Сначала во внутренней сфере появляется один лиганд, затем второй, третий и так далее:
M + L  [ML]
[ML]
[ML] + L  [ML2]
[ML2]
[ML2] + L  [ML3]
[ML3]
…….
[ML(n -1)] + L  [ML n ]
[ML n ]
Процесс комплексообразования завершается, когда число присоединившихся монодентатных лигандов L станет равным координационному числу комплексообразователя M. При этом устанавливается динамическое равновесие, поскольку наряду с образованием комплексов идет и их диссоциация.
5.4. Ступенчатая и полная константы образования
Состояние равновесия реакций комплексообразования можно охарактеризовать ступенчатой константой образования Ki (обр) комплекса, а именно:
M + L  [ML]; K 1(обр) = [ML] / {[M] ´ [L]}
[ML]; K 1(обр) = [ML] / {[M] ´ [L]}
[ML] + L  [ML2]; K 2(обр) = [ML2] / {[ML] ´ [L]}
[ML2]; K 2(обр) = [ML2] / {[ML] ´ [L]}
Для n -ой ступени комплексообразования ступенчатая константа образования Kn равна:
[ML(n -1)] + L  [MLn]; Kn (обр) = [ML n ] / {[ML(n -1)] ´ [L]}
[MLn]; Kn (обр) = [ML n ] / {[ML(n -1)] ´ [L]}
Существует и другой способ описания равновесия при комплексообразовании – с помощью полных (или суммарных) констант образования данного комплекса bi(обр):
M + L  [ML]; b1(обр) = [ML] / {[M] ´ [L]}
[ML]; b1(обр) = [ML] / {[M] ´ [L]}
M + 2 L  [ML2]; b2(обр) = [ML2] / {[M] ´ [L]2}
[ML2]; b2(обр) = [ML2] / {[M] ´ [L]2}
M + 3 L  [ML3]; b3(обр) = [ML3] / {[M] ´ [L]3}
[ML3]; b3(обр) = [ML3] / {[M] ´ [L]3}
…….
M + n L  [ML n ]; b n (обр) = [ML n ] / {[M] ´ [L] n }
[ML n ]; b n (обр) = [ML n ] / {[M] ´ [L] n }
5.5. Константы образования и прочность комплексов
Полная константа образования комплекса b n (обр) характеризует устойчивость комплексного соединения: чем больше значение b n (обр), тем более устойчив комплекс данного состава. Например, сравнивая константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона:
(1) Ag+ + 2 NH3  [Ag(NH3)2]+; b 2(обр) = 2,5 . 106
[Ag(NH3)2]+; b 2(обр) = 2,5 . 106
(2) Ag+ + 2 CN-  [Ag(CN)2]-; b2(обр) = 1,2 . 1021
[Ag(CN)2]-; b2(обр) = 1,2 . 1021
сделаем очевидный вывод о большей прочности второго комплекса – аниона [Ag(CN)2]-, поскольку, судя по большему значению константы образования, равновесие в реакции (2) сильнее сдвинуто вправо, чем в (1).
Индекс n у константы образования комплекса равен координационному числу центрального атома в том комплексном соединении, которое оценивается.
Нетрудно заметить, что величина b n (обр) связана со ступенчатыми константами образования Ki (обр) соотношением:
b n (обр) = K 1(обр) ´ K 2(обр) ´ K 3(обр) ´ … ´ Kn (обр)
Константы нестойкости
Если вместо равновесия в реакциях образования комплексов рассматривать обратный процесс – реакции диссоциации комплексов (или реакции обмена лигандов на молекулы растворителя), то соответствующие константы будут носить название ступенчатых констант нестойкости комплексов:
[ML]  M + L; K 1(нест) = [M] ´ [L] / [ML]
M + L; K 1(нест) = [M] ´ [L] / [ML]
[ML2]  [ML] + L; K 2(нест) = [ML] ´ [L] / [ML2]
[ML] + L; K 2(нест) = [ML] ´ [L] / [ML2]
…….
[ML n ]  [ML(n -1)] + L; Kn (нест) = [ML(n -1)] ´ [L] / [ML n ];
[ML(n -1)] + L; Kn (нест) = [ML(n -1)] ´ [L] / [ML n ];
и общих (суммарных) констант нестойкости комплексов:
[ML]  M + L; b1(нест) = [M] ´ [L] / [ML]
M + L; b1(нест) = [M] ´ [L] / [ML]
[ML2]  M + 2 L; b2(нест) = [M] ´ [L]2 / [ML2]
M + 2 L; b2(нест) = [M] ´ [L]2 / [ML2]
[ML3]  M + 3 L; b3(нест) = [M] ´ [L]3 / [ML3]
M + 3 L; b3(нест) = [M] ´ [L]3 / [ML3]
…….
[ML n ]  M + n L; b n (нест) = [M] ´ [L] n / [ML n ]
M + n L; b n (нест) = [M] ´ [L] n / [ML n ]
Ступенчатые и общие константы образования и нестойкости комплексов соотносятся друг с другом как обратные величины:
b n (обр) = 1 / b n (нест); Kn (обр) = 1 / Kn (нест),
поэтому для сравнения прочности комплексов могут использоваться справочные данные как по значениям констант образования, так и констант нестойкости.
56.
Рассмотрим вначале наиболее простой, но весьма распространенный случай комплексов, образуемых лигандами L типа (СН3)3Р, NH3, H2O, ОН-, Н-, которые используют для связывания с центральным атомом металла неподеленную гибридную пару электронов или пару электронов на s-орбитали (гибрид-ион). Начнем рассмотрение с наиболее характерного типа координации — октаэдрического. Координационные связи в комплексе МL6k+, где М — переходный металл, образуются при донировании электронов с сигма-орбиталей лигандов на вакантные 3d-, 4s-, 4p- орбитали металла (возьмем атом металла третьего периода). Чтобы рассчитать валентные МО комплекса, выберем координатные оси, как показано на рис. 1, расположив вдоль них лиганды.
Полный базис валентных АО состоит из 15 орбиталей: девяти — металла, шести — лигандов. Только такие комбинации лигандных АО будут обобщаться в форме МО с различными орбиталями металла, которые преобразуются по одинаковым представлениям симметрии в точечной группе ОА. Нетрудно подобрать соответствующие комбинации сигма-АО лигандов (называемые групповыми орбиталями). Рис. 2,а иллюстрирует выбор групповой орбитали еg-симметрии, комбинирующейся с dx2- y2 - орбиталью металла. Из рис. 2,б ясно, почему любая комбинация сигма-АО лигандов дает нулевое перекрывание с rf-орбиталями металла типа t2g.
57. Согласно методу валентных связей (ВС) между комплексообразователем и лигандами возникает ковалентная связь по донорно-акцепторному механизму.
Рассмотрим образование комплексного соединения из 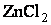 и аммиака NH3:
и аммиака NH3:
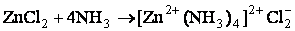

Электронная формула иона цинка
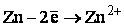 : 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0
: 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0
Ион цинка имеет свободные атомные орбитали 4 s и 4 p и является акцептором. Атомные орбитали неравноценны и подвергаются гибридизации, с образованием четырех равноценных гибридных орбиталей.
У атома азота в молекуле аммиака имеется неподеленная пара электронов, и он служит донором:
: N-H.
При их взаимодействии Zn2+ и 4NH3 образуется комплексный ион [Zn(NH3)4]2+. Так как, атомные орбитали цинка подвергались sp 3-гибридизации, то комплексный ион будет иметь тетраэдрическое строение.
При образовании донорно-акцепторной связи в комплексах могут использоваться: s-, p-, d - орбитали. Если гибридизации подвергаются s - и p - орбитали, то наблюдается sp -гибридизация, которая приводит к образованию линейной структуры комплекса с координационным числом комплексообразователя равным 2. -[Ag(NH3)2]+. Если у комплексообразователя участвуют в гибридизации s и 2 р атомные орбитали (sp 2-гибридизация), то образуется плоская треугольная структура комплекса. При sp 2 d – гибридизации структура образующегося комплекса – квадратная, координационное число равно 4. При sp 3 d 2 – гибридизации структура комплекса октаэдрическая, координационное число равно 6 и т.п.
Метод ВС позволяет предсказать состав, структуру комплекса, магнитные и оптические свойства.
Если в комплексе все электроны спарены, то свойства комплекса - диамагнитные (выталкивается из магнитного поля), если имеются неспаренные электроны, то свойства комплекса парамагнитные (втягивается в магнитное поле).
Окраска комплексных соединений зависит от типа лигандов и комплексообразователя. Из-за расщепления энергии d - орбиталей в октаэдрическом поле лигандов появляется возможность перехода электронов с низкоэнергетических d – подуровней на уровни с более высокой энергией. При этом комплексы поглощают кванты света определенных диапазонов длин волн и имеют соответствующую окраску.
Таким образом, метод ВС позволяет объяснить механизм образования химических связей и свойства комплексных соединений.
58. Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул)[1][2], в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде[1][3]; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества[3]. Известно свыше 400 разновидностей простых веществ[2].
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.)[2].
Примеры простых веществ: молекулярные (O2, O3, H2, Cl2) и атомарные (He, Ar) газы; различные формы углерода, иод (I2), металлы (не в виде сплавов).
Молекулярные вещества - это вещества, мельчайшими структурными частицами которых являются молекулы
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.



 M + n L
M + n L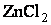 и аммиака NH3:
и аммиака NH3: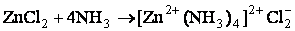

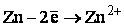 : 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0
: 1 s 22 s 22 p 63 s 23 p 63 d 104 s 04 p 0

