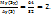Примеры решения типовых задач
Основные законы химии
Пример 2.1. Определить массу молекулы газа, если масса 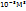 газа (н.у.) равна 0,1785*
газа (н.у.) равна 0,1785* 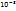 кг.
кг.
Решение. Исходя из молекулярного объема газа(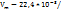 моль), определяем массу одного газа:
моль), определяем массу одного газа:
0,1785 * 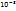 кг газа занимают объем
кг газа занимают объем 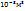
М кг -----‘’----- 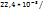 моль
моль
М= 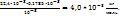
Число молекул в 1 моль любого вещества равно постоянной Авогадро (6,022 * 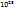 ). Следовательно, масса молекулы(m) газа равна
). Следовательно, масса молекулы(m) газа равна
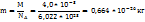
Пример 2.2. В 100 л (н.у.) воздуха содержится 6* 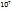 л ксенона. В каком объеме воздуха содержится
л ксенона. В каком объеме воздуха содержится 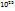 молекул ксенона?
молекул ксенона?
Решение. Из закона Авагадро вытекает, что 1 моль любого гаща при нормальных условиях занимает объе 22,4л и содержит 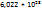 молекул. Следовательно:
молекул. Следовательно:
6,022* 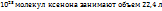
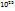 -----‘’----- V л
-----‘’----- V л

Зная содержание ксенона в воздухе, можно определить, в каком объеме воздуха содержится 372 л ксенона.
В 100л воздуха содержится 6* 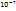 л ксенона
л ксенона
В V -----‘’----- 372 л ксенона
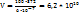 ,
,
Пример 2.3. Сколько молекул содержится в 1 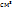 газа при -
газа при - 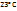 и 19мм рт.ст?
и 19мм рт.ст?
Решение. Объем газа при нормальных условиях составляет.
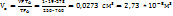 ,
,
в число молекул в этом объеме равно:
6,02* 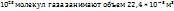
N -----‘’----- 2,73 * 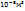
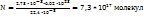 .
.
Приме 2.4. Вычислите плотоность этана  по водороду и воздуху.
по водороду и воздуху.
Решение. Из закона Авагадро вытекает, что отностильная плотность одного г. А по другому равна отношению молекулярных масс этих газов, т.е. D= 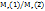 . Если
. Если 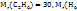 )=2
)=2  то относительная плотность этана по водороду равна
то относительная плотность этана по водороду равна
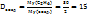 .
.
Относительная плотность этана по воздуху:
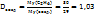 .
.
т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха
Пример 2.5. Какое количество хлората калия нужно разложить, чтобы получить 200 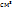 кислорода при н.у.?
кислорода при н.у.?
Решение. В присутствии катализатора разложение протекает согласно уравнению:
2KCI 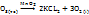
Из уравнения видно, что 2 моль 2KCI 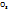 дают 3 моль
дают 3 моль 
Исходя из молярного объема кислорода и молярной массы хлората калия (92,5 г/моль), находим массу разложившегося KCL 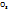 для получения 200
для получения 200 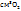 :
:
2*92,5 г KCL 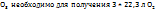
mKCL 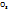 -----‘’----- 200
-----‘’----- 200  :
:
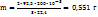 .
.
2.4.2. Определение атомных, молекулярных и молярных масс
Пример 2.6. Удельная теплоемкость металла 0,385 Дж/г*К. Вычислите точную атомную массу металла, если его молярная масса эквивалентов 32,68 г/моль.
Решение. Зная удельную теплоемкость металла, можно найти его приближенную молярную массу.
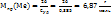 .
.
Из определения молярной массы эквивалентов металла находим его валентность
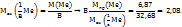
Округляем полученное значение до целого В=2 (Валентность имеет только целое значение).
Находим точное значение молярной массы атомов
М(М)= 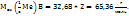
Молярная масса атомов численное равна атомной массе. В периодической системе Д.И. Менделеева находим, что металл с атомной массой 65,36 – цинк.
Пример 2.7. Определить атомную массу фосфора. Исходя их массового состава молекулярной массы перечисленных ниже соединений
| Название соединения
| Молекулярная масса
| Содержание
Фосфора, %
|
| Оксид фосфора (V)
|
| 43,66
|
| Фосфорная кислота
|
| 31,63
|
| Дифосфин
|
| 91,71
|
| Пирофорная кислота
|
| 34,81
|
Вычисляем, скольким атомным единицам массы соответствует содержание фосфора в молекулах указанных веществ.
В оксиде фосфора(V) на долю фосфора приходится
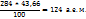
В фосфорной кислоте

В дифосфине
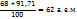
В пирофосфорной кислоте

Из полученных данных видно, что наименьшее количество соответствует  , остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
, остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
Вывод химических формул
Формула вещества показывает, атомы каких элементов и в каком количестве входят в состав молекулы вещества. Различают формулы простейшие(эмпирические) и молекулярные(истинные).
Простейшая формула показывает наиболее простой возможный атомный состав молекул вещества. Два вывода простейшей формулы вещества необходимо знать его состав (т.е. атомы каких химических элементов входят в молекулу вещества и массу каждого элемента в определенной массе вещества) и атомные массы образующих вещество элементов.
Молекулярная формула показывает действительное число атомов каждого элемента в молекуле (для веществ молекулярного строения). Для вывода молекулярной формулы кроме состава и атомных масс элементов необходимо знать молекулярную массу вещества.
Пример 2.16. Вещества содержит 26,53% калия, 35,37% хрома и 38,10% кислорода. Найти его простейшую формулу.
Решение. Обозначим число атомов калия, хрома и кислорода в простейшей формуле соответственно через х, у и z, т.е. 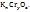
Соотношение атомов в молекуле равно соотношению моль атомов химических элементов в молярной массе вещества, т.к. согласно закону Авогадро, одинаковые количества вещества содержат одно и то же число частиц (т.е. одинаковое число моль атомов содержат одинаковое число атомов).
x: y: z = n(K):n(Cr):n(O)
Число моль находят делением массы на молярную массу, т.е.
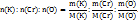
Но молярные массы атомов численно равны атомным массам данных химических элементов. В условии задачи дан массовый процент элементов в веществе, т.е. в 100г вещества содержится 26,53г калия, 35,37г хрома и 38,10г кислорода. Зная массы атомов химических элементов из условия задачи и атомные массы изпериодической систем элементов, найдем простейшее соотношение атомов в молекуле вещества.

Число атомов в молекуле дробным быть не может, поэтому чтобы выразить полученное соотношение целыми числами, разделим все три числа на наименьшее


Пример 2.17. Найти молекулярную формулу вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность этого вещества по воздуху равна 4,41.
Решение. Зная состав вещества и молярные массы атомов элементов, которые численно равны атомным массам, находим простейшую формулу вещества, т.е. отношение числа атомов углерода(s) и водорода(y).
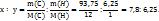
Чтобы выразить полученные отношение целыми числами, разделим все члены правйо части равенства на наименьшее
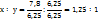
и умножим оба члена полученного отношения на 4.
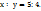
Таким образом, простейшая формула углеводорода 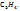 Этой формуле отвечаем молекулярная масса, равная
Этой формуле отвечаем молекулярная масса, равная
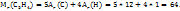
Молекулярную массу истинного вещества находим из его плотности по воздуху
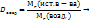

Молекулярную массу истинного вещества находим из его плотности по воздуху
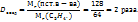
Таким образом, молекулярная формула соединения (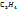 )=
)= 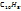
В результате химических реакций атомы химических элементов перегруппироваться из молекул исходных веществ в молекулу конечных продуктов, массы же их остаются постоянными. Поэтому элементный количественный состав можно найти из известной массы продуктов реакции.
Пример 2.18 При полном сжигании 1,33г некоторого вещества получилось 0,77г 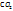 и 2,24
и 2,24 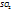 . Найти простейшую формулу вещества
. Найти простейшую формулу вещества
Решение. Анализируя процесс горения
Вещество+ 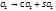
Можно установить, что в веществе были углерод и сера. Кроме этих двух элементов, в состав вещества может входить кислород.
Так как весь углерод, содержащийся в веществе, перешел в 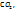 найдем массу углерода в 0,77г
найдем массу углерода в 0,77г 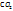 . Молярная масса
. Молярная масса 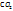 равна 44г/моль и исходя из формулы, в 44г
равна 44г/моль и исходя из формулы, в 44г 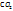 содержится 12г углерода. Найдем массу углерода в 0,77г
содержится 12г углерода. Найдем массу углерода в 0,77г 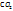 . Молярная масса
. Молярная масса 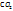 равна 44г/моль и исходя из формулы, в 44г
равна 44г/моль и исходя из формулы, в 44г 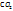 содержится 12г углерода. Найдем массу углерода в 0,77г
содержится 12г углерода. Найдем массу углерода в 0,77г 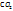
В 44г 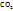 -------12г С
-------12г С
В 0,77г 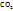 ------m(C)
------m(C)
m(C)= 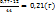
Аналогично находим массу серы M(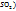 64г/моль
64г/моль
В 64г 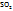 -------32г S
-------32г S
В 2,24г 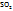 ------m(S)
------m(S)
m(S)= 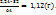
Таким образом, в сгоревшем веществе 0,21г углерода и 1,12 серы. Так как сумма масс серы и углерода m(C)+m(S)=0,21+1,12=1,33г равна массе сгоревшего вещества, значит кислорода в веществе не было. Выведем простейшую формулу вещества 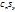 :
:
x:y = 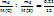 :
: 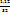 =0,0175: 0.035 = 1: 2.
=0,0175: 0.035 = 1: 2.
Следовательно, простейшая формула вещества С 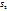
При установлении формулы газообразования вещества используют закн простых объемных отношений совместно с законом Авогадро.
Пример 2.19. При каталитическом окислении 160мл некоторого газа 200мл кислорода образуется 160мл оксида азота(II) и 240мл водяного пара. Объемы газов измерены при одинаковых условиях. Найдите формулу газа.
Решение. Следовательно, закону простых объемных отношений
V(газа):V(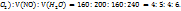
На основании закона Авогадро можно сделать вывод, что в таком соотношении молекул газы выступают и образуются в результате реакции, т.е. данные коэффициенты являются коэффициентами реакции:
4x+5 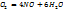
На основании уравнения реакции видно, что в молекулу неизвестного газа входит 1 атом азота и три атома водорода, т.е. формула гада 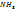
Примеры решения типовых задач
Пример 3.1. 17,5г 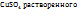 в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность
в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность 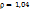 г/мл.
г/мл.
Решение. Расчет концентрации можно производить на основе определений соответствующих способов выражения состава растворе.
Определение массовой доли ω(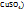 в %
в %
1. Найдем массу полученного раствора.
Т.к. 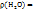 1 г/мл, то m(
1 г/мл, то m(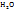 ) =
) = 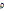 *V = 1 г/мл * 420мл = 420г.
*V = 1 г/мл * 420мл = 420г.
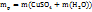 =17,5+420=437,5г
=17,5+420=437,5г
2. Рассчитаем массовую долю 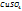 , %, в полученном растворе:
, %, в полученном растворе:
в 437,5г растворе содержится 17,5г 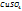
в 100г -----‘’----- x г 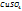
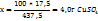
Т.е. массовая доля ω 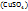 =4,0%
=4,0%
Определение титра раствора
1. Зная, что в 1л (1000мл) раствора с ω 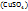 =4% содержится 41,6г
=4% содержится 41,6г 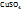 (см. выше), определим:
(см. выше), определим:
41,6г 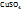 – 1000мл раствора
– 1000мл раствора
xг 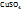 - 1мл раствора
- 1мл раствора

Пример 3.2. Какой объем раствора KOH с ω(KOH)=5%, плотность которого 1,04г/мл, требуется для реакции полного осаждения Fe из 50мл раствора с ω 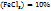 .
.
Решение.
1. Определим массу 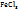 , содержащуюся в 50 мл 10%-го раствора:
, содержащуюся в 50 мл 10%-го раствора:
в 100г раствора содержится 10г 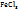
в (50-1,09)г раствора ----‘’---- mr 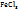
m(
2. По уравнения реакции:
3KOH + 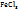 = Fe
= Fe 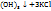
3,56г-162,5г
Вычисляем массу KOH, требуемую для реакции с содержащимися в растворе 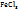
162,5г 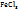 , взаимодействует с 168 г KOH
, взаимодействует с 168 г KOH
5,45г 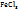 -----‘’----- m г KOH
-----‘’----- m г KOH
m(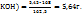
3. По массе KOH, концентрации раствора и плотности его вычисляем объем раствора KOH
в 100г 5%-го раствора KOH - 5г KOH
в 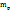 г -----‘’----- - 5,64 г KOH
г -----‘’----- - 5,64 г KOH
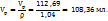
Пример 3.3. Для нейтрализации 70мл раствора соляной кислоты потребовалось 200мл 0,3H раствора NaOH. Какова молярная концентрация эквивалентов HCl?
Решение. Эту задачу следует решать, используя соотношение:
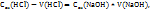
Из которого получаем:
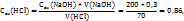
Следовательно, раствор соляной кислоты 0,86 H.
Примечание. Молекулярную концентрацию эквивалентов вещества необходимо рассматривать применительно к реакциям. Так, например, при полной нейтрализации серной кислоты едким натром:
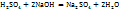
Число эквивалентности Z( =2;
=2;
эквивалент Э(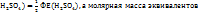
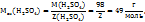
следовательно, в данном случае 1H раствором 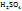 будет раствор, в литре которого содержится 49г
будет раствор, в литре которого содержится 49г 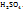
Для реакции частичной нейтрализации и непонятного обмена эквивалентов 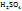 будет определятся реакцией:
будет определятся реакцией:
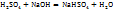
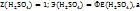
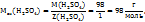
Поэтому в этом случае 1H раствором 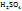 будет раствор, в титре которого содержится 98г
будет раствор, в титре которого содержится 98г 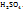
Пример 3.4. Рассчитайте молярную концентрацию эквивалентов растворенного вещества следующих растворах: 0,2М р-р Al 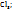 0,6Mp-p
0,6Mp-p 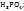 0,7Mp-p
0,7Mp-p  принимая максимальное значение числа эквивалентности.
принимая максимальное значение числа эквивалентности.
Решение. Воспользоваться отношением: 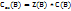 .
.
Чтобы перейти от молярной концентрации вещества к молярной концентрации эквивалентов, нужно молярную концентрацию С(В) умножить на число эквивалентности Z(B).
При обратном переходе молярную концентрацию эквивалентов необходимо разделить на число эквивалентности Z(B).
Для электролитов 1:1 (NaCl, KOH, HI и др.) молярная концентрация вещества равна молярной концентрации эквивалентов вещества, т.к. Z(B)=1.
Для сложных электролитов (Al 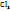 ;
; 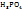 ;
; 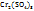 и др.) молярная концентрация эквивалентов
и др.) молярная концентрация эквивалентов 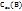 больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
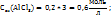
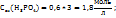
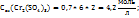
Пример 3.5. Приготовить 70мл раствора с ω(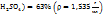 путем смешения раствора ω(
путем смешения раствора ω(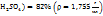 и ω(
и ω(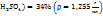 .
.
Решение. Задачу удобней решать по правилу смешения (правилу креста), согласно которому массы смешиваемых растворов обратно пропорциональны разностям концентраций смеси и отдельных е компонентов.
1. Записываем друг под другом массовые доли некоторых растворов, а правее между ними массовую долю раствора, который необходимо приготовить. Затем из большей массовой доли вычитаем заданную и записываем результат справа снизу; из заданной массовой доли вычитаем наименьшую и записываем результат справа вверху


 82 29
82 29

 63
63
 34
34 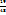
Число 29 и 19 показывают, в каком массовом отношении надо взять растворы ω(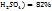 в ω(
в ω(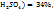 соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(
соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(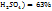 необходимо смешать 29г раствора с ω(
необходимо смешать 29г раствора с ω(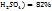 и 19г раствора с ω(
и 19г раствора с ω(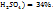
2. Определим массу раствора серной кислоты ω(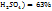 :
:
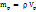 = 1,535*70=107,45г.
= 1,535*70=107,45г.
3. Определим массу в объем раствора с 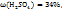 необходимые для искомого раствора.
необходимые для искомого раствора.
Для приготовленных 48г 83%-го р-ра необходимо взять 29г 82%-го р-ра
107,45 ----‘’---- x г
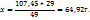
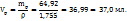
2. Определим массу и объем раствора с ω(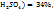 необходимого для приготовления искомого раствора:
необходимого для приготовления искомого раствора:
Для приготовления 48г 63%-го р-ра – 19г 34%-го р-ра
107,45 ----‘’---- y г
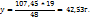
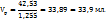
Таким образом для приготовления 70 мл раствора с ω(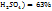 нужно смешать 37,0 мл 82%-го и 33,9 мл 34%-го растворов.
нужно смешать 37,0 мл 82%-го и 33,9 мл 34%-го растворов.
Пример 3.6. Сколько граммов кристаллогидрата Cu 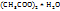 и раствора с ω(Cu
и раствора с ω(Cu 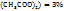 нужно взять для приготовления 580г растворе веществ меди с ω(Cu
нужно взять для приготовления 580г растворе веществ меди с ω(Cu 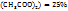 .
.
Решение. Сложность этого примера состоит в том, что кристаллогидрат содержит воду, которая добавляется при приготовлении раствора к воде взятой в качестве растворителя. Имеется несколько способов решения. Приведем один из них.
Кристаллогидрат Cu 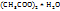 можно рассматривать как твердый водный раствор. Определим
можно рассматривать как твердый водный раствор. Определим 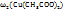 в кристаллогидрате.
в кристаллогидрате.
Cu  Cu
Cu 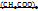
M = 200 г/моль М=182 г/моль
В 200г Cu 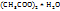 содержится 182г Cu
содержится 182г Cu 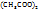
В 100г -----‘’----- xг
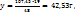 т.е. кристаллогидрат представляет собой раствор с
т.е. кристаллогидрат представляет собой раствор с 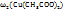 =91%.
=91%.
Теперь сформулируем исходное условие следующим образом: необходимо приготовить 580г раствора ацетата меди с ω(Cu 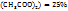 из растворов с
из растворов с 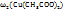 =91% и
=91% и 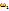 (Cu
(Cu 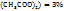 . Найдем их массы, используя правило смешения.
. Найдем их массы, используя правило смешения.


 91 22
91 22

 25
25
 3
3 
Из схемы видно, что для приготовления 88г (22+66) раствора ацетата меди с ω(Cu 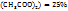 нужно в 66г раствора с
нужно в 66г раствора с  (Cu
(Cu 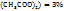 растворить 22г кристаллогидрата меди, а для приготовления 580г 25% раствора массы смешиваемых компонентов определяются из пропорции:
растворить 22г кристаллогидрата меди, а для приготовления 580г 25% раствора массы смешиваемых компонентов определяются из пропорции:
88г 25% р-раCu 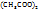 – 66г 3%-го р-ра
– 66г 3%-го р-ра
580г -----‘’-----‘’ 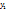 г
г
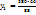 = 435г р-раCu
= 435г р-раCu 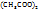 с
с 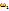 (Cu
(Cu 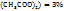 .
.
Аналогично найдем массу кристаллогидрата:
для приготовления 88г 25% р-раCu 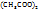 – 22г Cu
– 22г Cu 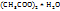
580г -----‘’-----‘’ 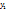 г
г
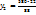 = 145г Cu
= 145г Cu 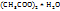 .
.
Пример 3.7. Определить коэффициент растворимости К (масса растворенного вещества (В) в г, приходящаяся на 100г растворителя) и массовую долю растворенного вещества ω(В) в %, если в 84,68 насыщенного раствора содержится 14,56г растворенного вещества
Решение.
1. Определяем ω(В) в %
в 84,68г раствора содержится 14,56г вещества
в 100г -----‘’----- ω(B)
ω(В) =  = 17,2г, т.е.
= 17,2г, т.е.  = 17,2%,
= 17,2%,
Пример 3.8. Масса раствора, насыщенного при 343К, равна 401,11г масса воды в этом растворе на 21,11г больше массы соли. Сколько грамм соли выделится из этого раствора, если его охладить до 293К. Какова массовая доля соли в растворе до и после охлаждения, если в 100г воды при 293К растворяется 65,5г соли?
Решение. Массу соли принимаем за m(B). Тогда масса соли равна (m(B)+21,11), а их сумма: m(B)+(m(B)+21,11) =401,11г представляет собой массу раствора. Решаем полученное уравнение относительно m(B): 2m(B)=401,11-21,11=380г; m(B)=190г, следовательно, в 401,11г насыщенного при 343К раствора содержится 190г соли и 211,11г воды. При охлаждении раствора до 293К масса воды не изменяется.
По условию в 100г воды растворяется 65,5 г соли,
В 211,11 ----‘’---- x г
x = 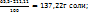
Тогда при охлаждении из раствора выделяется (190,00-137,22) =52,78г соли. Массовая доля соли в растворе при 343К определяется из пропорции:
в 401,11г раствора содержится 190г соли
в 100г ----‘’---- 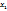 г
г
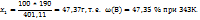
Масса раствора при понижении температуры до 293 уменьшится на 52,78 и будет 401,11-52.78=348,33г.
Массовая доля соли в растворе при 293К вычисляется из пропорции:
в 348,33г раствора содержится 137,22г соли
в 100г ----‘’---- 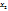

Пример 3.9. При выпаривании 1 кг раствора с массовой долей NaOH=16% удалено 100г воды. Какова массовая доля, %, NaOHв растворе после выпаривания?
Решение. В 1 кг раствора с ω(NaOH)=16% содержится 160г едкого титра. После выпаривания 100г воды из раствора масса его стала 900г (104-100), а масса NaOH осталась прежней, т.е. 160г. Найдем концентрацию раствора после выпаривания воды.
В 900г раствора содержится 160г NaOH
В 100г ----‘’---- x
X= 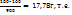 ω (NaOH)=17,78 %.
ω (NaOH)=17,78 %.
Пример 3.10. При температуре 293К и давлении Р-760мм Hg в 100г воды растворяется 71л аммиака. Определить моляльную концентрацию в массовую долю аммиака, %, в растворе.
Решение.
1. Поскольку объем аммиака зафиксирован при Т=293К, необходимо привести его к нормальным условиям, используя соотношение  = const:
= const:
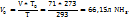
2. В соответствии с законом Авогадро:
22,4л (н.у.) – 1 моль 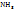
66,15 - x моль
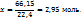
3. 2,95 моль аммиака имеют массу 2,95*17=50,2г, масса полученного по условию раствора составит 100+50.2=150,2г. Теперь моляльную и процентную концентрацию раствора аммиака рассчитывают на основе следующих пропорций:
На 100г воды в растворе приходится 2,95 моль 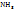
На 1000г ----‘’---- x моль 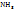
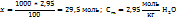
В 150,2г раствора содержится 50,2г 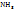
В 100г ----‘’---- x г
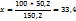
ω (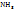 )=33,4%
)=33,4%
Примеры решения типовых задач
Основные законы химии
Пример 2.1. Определить массу молекулы газа, если масса 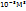 газа (н.у.) равна 0,1785*
газа (н.у.) равна 0,1785* 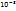 кг.
кг.
Решение. Исходя из молекулярного объема газа(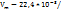 моль), определяем массу одного газа:
моль), определяем массу одного газа:
0,1785 * 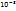 кг газа занимают объем
кг газа занимают объем 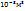
М кг -----‘’----- 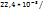 моль
моль
М= 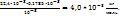
Число молекул в 1 моль любого вещества равно постоянной Авогадро (6,022 * 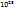 ). Следовательно, масса молекулы(m) газа равна
). Следовательно, масса молекулы(m) газа равна
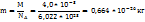
Пример 2.2. В 100 л (н.у.) воздуха содержится 6* 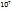 л ксенона. В каком объеме воздуха содержится
л ксенона. В каком объеме воздуха содержится 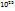 молекул ксенона?
молекул ксенона?
Решение. Из закона Авагадро вытекает, что 1 моль любого гаща при нормальных условиях занимает объе 22,4л и содержит 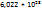 молекул. Следовательно:
молекул. Следовательно:
6,022* 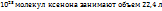
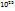 -----‘’----- V л
-----‘’----- V л

Зная содержание ксенона в воздухе, можно определить, в каком объеме воздуха содержится 372 л ксенона.
В 100л воздуха содержится 6* 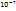 л ксенона
л ксенона
В V -----‘’----- 372 л ксенона
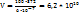 ,
,
Пример 2.3. Сколько молекул содержится в 1 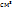 газа при -
газа при - 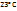 и 19мм рт.ст?
и 19мм рт.ст?
Решение. Объем газа при нормальных условиях составляет.
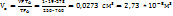 ,
,
в число молекул в этом объеме равно:
6,02* 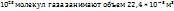
N -----‘’----- 2,73 * 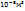
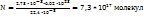 .
.
Приме 2.4. Вычислите плотоность этана  по водороду и воздуху.
по водороду и воздуху.
Решение. Из закона Авагадро вытекает, что отностильная плотность одного г. А по другому равна отношению молекулярных масс этих газов, т.е. D= 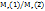 . Если
. Если 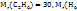 )=2
)=2  то относительная плотность этана по водороду равна
то относительная плотность этана по водороду равна
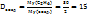 .
.
Относительная плотность этана по воздуху:
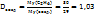 .
.
т.е. этан в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха
Пример 2.5. Какое количество хлората калия нужно разложить, чтобы получить 200 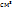 кислорода при н.у.?
кислорода при н.у.?
Решение. В присутствии катализатора разложение протекает согласно уравнению:
2KCI 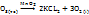
Из уравнения видно, что 2 моль 2KCI 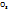 дают 3 моль
дают 3 моль 
Исходя из молярного объема кислорода и молярной массы хлората калия (92,5 г/моль), находим массу разложившегося KCL 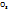 для получения 200
для получения 200 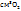 :
:
2*92,5 г KCL 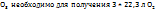
mKCL 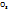 -----‘’----- 200
-----‘’----- 200  :
:
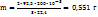 .
.
2.4.2. Определение атомных, молекулярных и молярных масс
Пример 2.6. Удельная теплоемкость металла 0,385 Дж/г*К. Вычислите точную атомную массу металла, если его молярная масса эквивалентов 32,68 г/моль.
Решение. Зная удельную теплоемкость металла, можно найти его приближенную молярную массу.
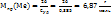 .
.
Из определения молярной массы эквивалентов металла находим его валентность
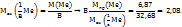
Округляем полученное значение до целого В=2 (Валентность имеет только целое значение).
Находим точное значение молярной массы атомов
М(М)= 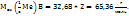
Молярная масса атомов численное равна атомной массе. В периодической системе Д.И. Менделеева находим, что металл с атомной массой 65,36 – цинк.
Пример 2.7. Определить атомную массу фосфора. Исходя их массового состава молекулярной массы перечисленных ниже соединений
| Название соединения
| Молекулярная масса
| Содержание
Фосфора, %
|
| Оксид фосфора (V)
|
| 43,66
|
| Фосфорная кислота
|
| 31,63
|
| Дифосфин
|
| 91,71
|
| Пирофорная кислота
|
| 34,81
|
Вычисляем, скольким атомным единицам массы соответствует содержание фосфора в молекулах указанных веществ.
В оксиде фосфора(V) на долю фосфора приходится
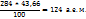
В фосфорной кислоте

В дифосфине
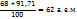
В пирофосфорной кислоте

Из полученных данных видно, что наименьшее количество соответствует  , остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
, остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
Определение молекулярных масс газообразных веществ
Пример 2.8. Вычислить молекулярную массу газа, если 16.02 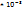 кг его объем 5,6
кг его объем 5,6 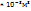 при нормальных условиях.
при нормальных условиях.
Решение. Зная, что молярный объем газа равен 22,4 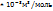 , определяем массу одного моль газа.
, определяем массу одного моль газа.
16.02 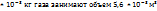
x -----‘’----- 22,4 *5,6 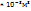
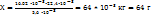 .
.
Следовательно, молярная масса газа равна 64г/моль, а его молекулярная масса – 64.
Пример 2.9. Масса 0,327 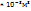 газа при
газа при  и давления 1,040
и давления 1,040 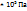 равна 0,828
равна 0,828 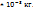 Вычислите молярную массу газа.
Вычислите молярную массу газа.
Решение вычислить молярную массу газа можно, используя уравнение Менделеева-Клапейрона
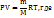
m – масса газа; М- молярная масса газа; R – универсальная газовая постоянная, значение которой определяется принятыми единицами измерения. Если давление измерять в Па, а объем в 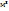 , то R= 8,31 Па*
, то R= 8,31 Па* 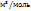 К. Тогда молярная масса газа равна.
К. Тогда молярная масса газа равна.
M= 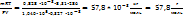 .
.
Пример 2.10. Из скольких атомов состоят молекулы паров серы при температуре 1123К, если плотность их по воздуху равна 2,21.
Решение. Из закона Авогадро вытекает, что относительная плотность (D) одного газа по-другому равна отношению молекулярных масс (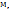 ) этих газов, т.е.
) этих газов, т.е.
M= 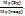
Если D=2,21, средняя молекулярная масса воздуха равна 29, то из вышеприведенного уравнения можно определить молярную массу паров серы.
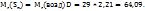
Согласно атомно-молекулярному учению, молекулы состоят их атомов и молярная масса равна всех атомов, входящих в состав молекулы, т.е. 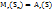 , где
, где
x – число атомов серы в молекуле серы, 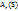 -атомная масса серы, отсюда находим
-атомная масса серы, отсюда находим
n= 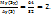
Таким образом, молекула серы при температуре 1123К состоит из двух атомов.



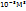 газа (н.у.) равна 0,1785*
газа (н.у.) равна 0,1785* 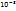 кг.
кг.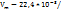 моль), определяем массу одного газа:
моль), определяем массу одного газа: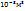
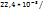 моль
моль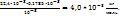
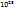 ). Следовательно, масса молекулы(m) газа равна
). Следовательно, масса молекулы(m) газа равна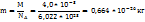
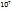 л ксенона. В каком объеме воздуха содержится
л ксенона. В каком объеме воздуха содержится 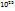 молекул ксенона?
молекул ксенона?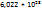 молекул. Следовательно:
молекул. Следовательно: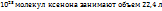

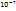 л ксенона
л ксенона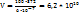 ,
,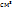 газа при -
газа при - 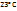 и 19мм рт.ст?
и 19мм рт.ст?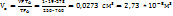 ,
,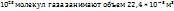
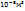
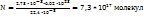 .
. по водороду и воздуху.
по водороду и воздуху.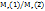 . Если
. Если 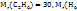 )=2
)=2  то относительная плотность этана по водороду равна
то относительная плотность этана по водороду равна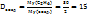 .
.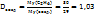 .
.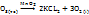
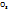 дают 3 моль
дают 3 моль 
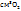 :
: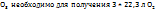
 :
: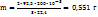 .
.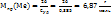 .
.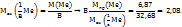
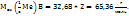
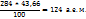

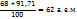

 , остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
, остальные количества кратны данной величине. Значит, атомная масса фосфора 31.
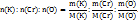



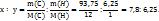
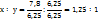
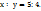
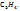 Этой формуле отвечаем молекулярная масса, равная
Этой формуле отвечаем молекулярная масса, равная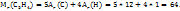
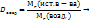

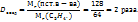
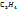 )=
)= 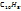
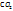 и 2,24
и 2,24 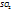 . Найти простейшую формулу вещества
. Найти простейшую формулу вещества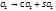
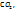 найдем массу углерода в 0,77г
найдем массу углерода в 0,77г 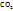 -------12г С
-------12г С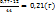
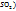 64г/моль
64г/моль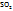 -------32г S
-------32г S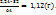
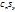 :
: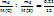 :
: 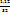 =0,0175: 0.035 = 1: 2.
=0,0175: 0.035 = 1: 2.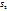
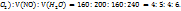
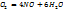
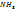
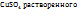 в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность
в 420мл воды. Рассчитайте массовую долю, моляльную, молярную концентрации и титр полученного раствора, если его плотность 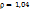 г/мл.
г/мл.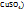 в %
в %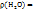 1 г/мл, то m(
1 г/мл, то m(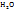 ) =
) = 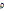 *V = 1 г/мл * 420мл = 420г.
*V = 1 г/мл * 420мл = 420г.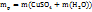 =17,5+420=437,5г
=17,5+420=437,5г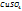 , %, в полученном растворе:
, %, в полученном растворе: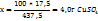
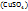 =4,0%
=4,0%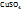 (см. выше), определим:
(см. выше), определим:
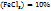 .
.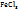 , содержащуюся в 50 мл 10%-го раствора:
, содержащуюся в 50 мл 10%-го раствора:
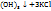
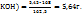
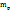 г -----‘’----- - 5,64 г KOH
г -----‘’----- - 5,64 г KOH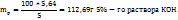
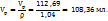
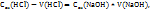
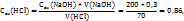
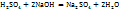
 =2;
=2;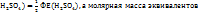
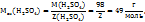
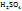 будет раствор, в литре которого содержится 49г
будет раствор, в литре которого содержится 49г 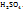
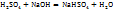
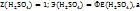
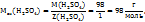
 0,6Mp-p
0,6Mp-p  0,7Mp-p
0,7Mp-p  принимая максимальное значение числа эквивалентности.
принимая максимальное значение числа эквивалентности.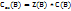 .
.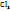 ;
; 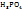 ;
; 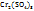 и др.) молярная концентрация эквивалентов
и др.) молярная концентрация эквивалентов 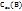 больше, чем молярная концентрация вещества В, т.к. Z(B)>1.
больше, чем молярная концентрация вещества В, т.к. Z(B)>1.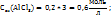
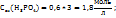
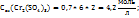
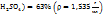 путем смешения раствора ω(
путем смешения раствора ω(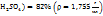 и ω(
и ω(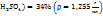 .
.

 82 29
82 29
 63
63 34
34 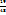
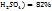 в ω(
в ω(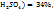 соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(
соответственно. Т.е. для приготовления 48г, раствора серной кислоты с ω(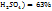 необходимо смешать 29г раствора с ω(
необходимо смешать 29г раствора с ω(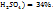
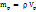 = 1,535*70=107,45г.
= 1,535*70=107,45г.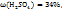 необходимые для искомого раствора.
необходимые для искомого раствора.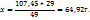
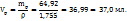
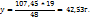
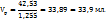
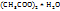 и раствора с ω(Cu
и раствора с ω(Cu 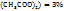 нужно взять для приготовления 580г растворе веществ меди с ω(Cu
нужно взять для приготовления 580г растворе веществ меди с ω(Cu 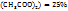 .
.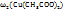 в кристаллогидрате.
в кристаллогидрате. Cu
Cu 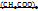
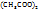
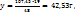 т.е. кристаллогидрат представляет собой раствор с
т.е. кристаллогидрат представляет собой раствор с 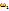 (Cu
(Cu 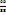
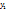 г
г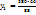 = 435г р-раCu
= 435г р-раCu 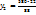 = 145г Cu
= 145г Cu  = 17,2г, т.е.
= 17,2г, т.е. 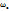 = 17,2%,
= 17,2%,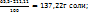
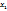 г
г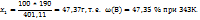
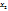

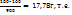 ω (NaOH)=17,78 %.
ω (NaOH)=17,78 %. = const:
= const: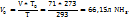
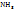
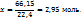
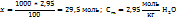
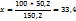
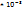 кг его объем 5,6
кг его объем 5,6 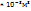 при нормальных условиях.
при нормальных условиях.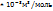 , определяем массу одного моль газа.
, определяем массу одного моль газа.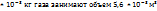
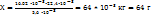 .
. и давления 1,040
и давления 1,040 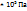 равна 0,828
равна 0,828 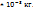 Вычислите молярную массу газа.
Вычислите молярную массу газа.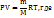
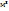 , то R= 8,31 Па*
, то R= 8,31 Па* 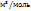 К. Тогда молярная масса газа равна.
К. Тогда молярная масса газа равна.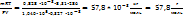 .
.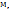 ) этих газов, т.е.
) этих газов, т.е.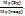
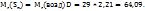
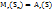 , где
, где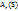 -атомная масса серы, отсюда находим
-атомная масса серы, отсюда находим