

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
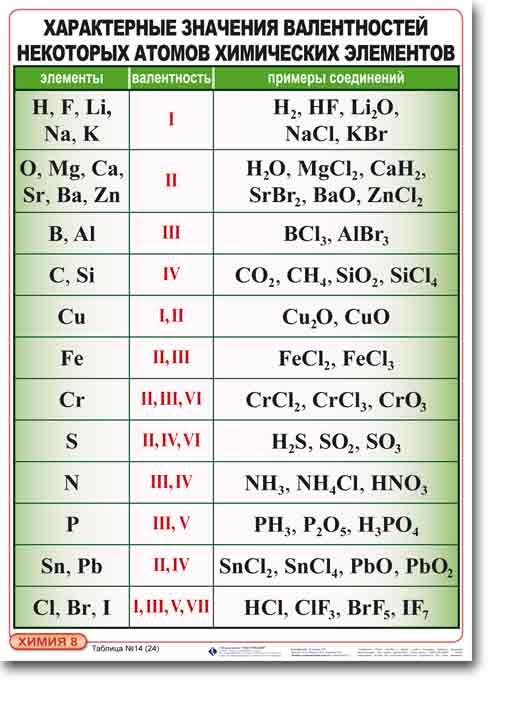
Основные представления о валентности химических элементов.
Валентность - свойство атомов одного элемента удерживать определенное количество атомов другого элемента.



соединяются два атома одновалентного (H2O) или один атом двухвалентного (CaO). Значит, валентность элемента можно представить как число, которое показывает, со сколькими атомами одновалентного элемента может соединяться атом данного элемента. Валентность элемента – это число связей, которое образует атом:
одновалентного элемента (HСl). С атомом двухвалентного элемента 
Na – одновалентен (одна связь)
H – одновалентен (одна связь) С одним атомом одновалентного элемента соединяется один атом другого
O – двухвалентен (две связи у каждого атома)
S – шестивалентна (образует шесть связей с соседними атомами)
Правила определения валентности
элементов в соединениях
1. Валентность водорода принимают за I (единицу). Тогда в соответствии с формулой воды Н2О к одному атому кислорода присоединено два атома водорода.
2. Кислород в своих соединениях всегда проявляет валентность II. Поэтому углерод в соединении СО2 (углекислый газ) имеет валентность IV.
3. Высшая валентность равна номеру группы.
4. Низшая валентность равна разности между числом 8 (количество групп в таблице) и номером группы, в которой находится данный элемент, т.е. 8 - N группы.
5. У металлов, находящихся в «А» подгруппах, валентность равна номеру группы.
6. У неметаллов в основном проявляются две валентности: высшая и низшая.
Например: сера имеет высшую валентность VI и низшую (8 – 6), равную II; фосфор проявляет валентности V и III.
7. Валентность может быть постоянной или переменной.
|
|
Алгоритм составления формулы соединения оксида фосфора
| Последовательность действий | Составление формулы оксида фосфора |
| 1. Написать символы элементов | Р О |
| 2. Определить валентности элементов | V II P O |
| 3. Найти наименьшее общее кратное численных значений валентностей | 5•2 = 10 |
| 4. Найти соотношения между атомами элементов путем деления найденного наименьшего кратного на соответствующие валентности элементов | 10: 5 = 2, 10: 2 = 5; P: О = 2: 5 |
| 5. Записать индексы при символах элементов | Р2 О5 |
| 6. Формула соединения (оксида) | Р2О5 |
Запомните!
Главное квантовое число n
Описывает:
· среднее расстояние от орбитали до ядра;
· энергетическое состояние электрона в атоме.
Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки.
Магнитное квантовое число m
Орбитальное квантовое число
Орбитальное квантовое число l определяет форму электронного облака. Различным формам электронного облака соответствуют различные значения энергии, т.е. в пределах одного энергетического уровня происходит его расщепление на энергетические подуровни. Орбитальное квантовое число l=0 (n-1). Энергетические подуровни обозначаются: s(l=0), р(1=1), d(l=2), f(l=3).
При п=1; 1=0. Такому значению l соответствует форма электронного облака в виде сферы. Электроны, l которых равно 0, называются s-электронами. На первом энергетическом уровне могут находиться только s -электроны, которые образуют один энергетический подуровень 1s.
При п = 2; I = 0, 1. Значению l = 1 соответствует электронное облако в виде "объемной восьмерки". Электроны, l которых равно 1, называются р-электронами. На втором энергетическом уровне могут находиться и s-, и р-электроны, которые образуют два энергетических подуровня 2s и 2р.
При п = 3; l = 0. 1, 2. Значению 1=2 соответствует форма электронного облака в виде "четырехлепесткового соцветия". Электроны, l которых равно 2, называются d - электронами. На третьем энергетическом уровне могут находиться и s-, и р-, и (d-электроны, которые могут образовывать три энергетических подуровня Зs, Зр, 3d.
|
|
При n = 4; l = 0, 1, 2, 3. Значению l = 3 соответствует сложная, трудно изображаемая форма электронного облака. Электроны, l которых равно 3, называются f-электронами. На четвертом энергетическом уровне могут находиться и s-, и р-, и с/-, и /-электроны, которые могут образовывать четыре энергетических подуровня 4s, 4p, 4d, 4f.
Количество подуровней в уровне равно номеру уровня, но не превышает 4.
Магнитное квантовое число
Магнитное квантовое число ml характеризует пространственную ориентацию электронного облака. Магнитное квантовое число ml = - l l.
При l = 0; m l = 0, т.е. у s-электронного облака отсутствует ориентация.
При l = l, ml = -1, 0, 1. Три значения ml соответствуют трем ориентациям р-электронных облаков в пространстве по направлениям координатных осей X, Y, Z::рx, ру, рz.
При l = 2; m l = - 2, -1, 0, 1, 2. Этим пяти значениям m l соответствует пять пространственных положений d-электронных облаков, причем три d-орбитали имеют диагональное расположение между осями X, Y, Z (dxy, dxz dyz;); две остальные d-орбитали направлены вдоль осей координат (dx2y2, dz2).
При l = 3; m l = -3, -2, -1, 0, 1, 2, 3. Этим семи значениям ml соответствуют семь пространственных положений f -электронных облаков.
Атомные орбитали
Совокупность положений электрона в атоме, характеризуемых тремя квантовыми числами п, l, ml, называется атомной орбиталыо.
На s-подуровне содержится только одна атомная орбиталь, на р-подуровне - 3, на d-подуровне - 5, а на f -подуровне - 7.
Каждому значению l соответствует орбиталь особой формы, например s-орбиталь имеет сферическую форму, р-орбиталь – гантель.
В одной и той же оболочке энергия подуровней возрастает в ряду Es <Ep <Ed <Ef <Eg. В первой оболочке (n = 1) может быть одна s-; во второй (n = 2) две s- и р-, в третьей (n = 3) s-, р- и d-, в четвертой (n = 4) s-, р-, d- и f- подоболочки и т. д.
Спиновое квантовое число
Наличие у электронов собственного механического момента, связанного с его вращением вокруг собственной оси, получило название спина (spin, англ. - веретено).
Величину и ориентацию этого спина характеризует спиновое квантовое число m s = - 1/2, 1/2.
Поскольку спин - величина векторная, то электроны, имеющие одинаковое направление, называют параллельными, противоположное - антипараллельными.
|
|
Таким образом, состояние электрона в атоме однозначно характеризуется четырьмя квантовыми числами.
Спиновое квантовое число (ms) характеризует механический момент движения электронов и имеет два значения +1/2 и –1/2, соответствующие противоположным направлениям вращения. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками ↑↓. Каждаяэлектроннаяорбитальватоме (или атомная орбиталь (АО)) характеризуется тремя квантовыми числами: n, l и ml. Общие число атомных орбиталей в оболочках равно n2. Условно атомную орбиталь обозначают в виде клеточки. Состояние электрона в атоме полностью характеризуется четырьмя квантовыми числами n, l, ml, и ms.

| 
|
| S - орбиталь | Три p – орбитали |

|
| Пять d – орбиталей |
Основные представления о валентности химических элементов.
|
|
|

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!