

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
О возможности произвольного протекания реакции термической диссоциации карбоната, которая в общем случае может быть описана уравнением
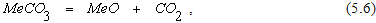
можно судить, исходя из величины изменения энергии Гиббса. При протекании реакции (5.6) в условиях отличных от стандартных

Если MeO и MeCO3 являются чистыми веществами, из уравнения (5.7) получим
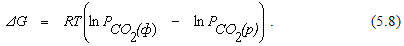
Из уравнения (5.8) видно, что численное значение изменения энергии Гиббса реакции (5.6) при заданной температуре определяется соотношением между упругостью диссоциации карбоната и фактической величиной парциального давления в газовой фазе. Первая из этих величин отражает свойства карбоната и зависит только от температуры, вторая не зависит от температуры и является характеристикой среды, в которой находится карбонат.
Между этими величинами возможны следующие соотношения:

Сказанное выше иллюстрируется схемой на рисунке 5.1а. Точки, лежащие вне кривой, отвечают произвольным значениям PCO2(ф). Точки, расположенные на кривой, относятся к равновесным системам и описывают зависимость упругости диссоциации карбоната от температуры.

Рисунок 5.1 – График для определения направления реакций образования и термической диссоциации карбонатов: а – при любом парциальном давлении СО2 в газовой фазе; б – при постоянном давлении СO2 в газовой фазе
Область выше кривой соответствует неравновесным системам, в которых  и реакция (5.6) протекает в направлении образования карбоната. Область ниже кривой отвечает неравновесным системам, в которых
и реакция (5.6) протекает в направлении образования карбоната. Область ниже кривой отвечает неравновесным системам, в которых  . В этих условиях реакция (5.6) протекает в направлении диссоциации углекислых соединений.
. В этих условиях реакция (5.6) протекает в направлении диссоциации углекислых соединений.
На практике часто возникает необходимость определить направлении реакции в среде заданного состава, например, в атмосферном воздухе. Принцип решения такой задачи иллюстрируется схемой на рисунке 5.1б. В этом случае PCO2(ф) – постоянная величина, показанная на графике прямой параллельной оси абсцисс. Из рисунка видно, что условие PCO2(ф) = PCO2(MeCO3) может выполняться только при одной температуре, которую называют температурой начала разложения в газовой фазе с постоянным парциальным давлением CO2(T(p)).
|
|
При 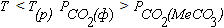 и диссоциация карбоната не возможна. При
и диссоциация карбоната не возможна. При  и реакция (5.6) протекает в направлении диссоциации карбоната.
и реакция (5.6) протекает в направлении диссоциации карбоната.
При температурах вблизи T(p) диссоциация карбоната протекает с малой скоростью. Быстрое разложение карбоната, которое называют химическим кипением, начинается, когда упругость его диссоциации становится равной общему давлению над твердыми фазами (Pобщ).
В качестве примера выполним расчет температур начала разложения и химического кипения в атмосферном воздухе карбоната кальция, упругость диссоциации которого при различных температурах рекомендуется рассчитывать по уравнению

ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ ГАЗООБРАЗНЫМИ ВОССТАНОВИТЕЛЯМИ. Общая термодинамическая характеристика реакций восстановления.
В общем виде реакция между оксидом металла и восстановителем (В) может быть описана уравнением

Реакцию (6.1) можно рассматривать как результат последовательного протекания следующих частных реакций

В соответствии с принятой схемой

Если вещества взаимодействуют в стандартных состояниях, с учетом соотношения

выражение (6.2) можно привести к виду

Из формулы (6.4) получим

Из формул (6.2) и (6.5) видно, что направление протекания реакции (6.1) в стандартных условиях можно установить, исходя из соотношения стандартных значений изменения энергии Гиббса реакций образования оксидов металла и восстановителя или соотношения величин упругости диссоциации этих веществ.
Если  реакция (6.1) будет протекать в направлении образования оксида восстановителя и восстановления металла, то есть в направлении образования более прочного оксида. При этом, чем больше различие между
реакция (6.1) будет протекать в направлении образования оксида восстановителя и восстановления металла, то есть в направлении образования более прочного оксида. При этом, чем больше различие между  , тем больше численное значение константы равновесия реакции и полнота превращения.
, тем больше численное значение константы равновесия реакции и полнота превращения.
|
|
Если  , система находится в состоянии термодинамического равновесия.
, система находится в состоянии термодинамического равновесия.
Если  , произвольное протекание реакции (6.1) возможно только в направлении окисления металла.
, произвольное протекание реакции (6.1) возможно только в направлении окисления металла.
Если реакция (6.1) протекает в условиях, отличающихся от стандартных, вывод о направлении реакции также может быть получен из соотношения величин изменения энергии Гиббса реакций образования оксидов металла и восстановителя или значений равновесного парциального давления кислорода в газовой фазе для этих реакций.
|
|
|

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!