Доменная печь представляет собой агрегат шахтного типа, в который сверху загружают железорудные и шлакообразующие материалы, а также топливо, которым является кокс. Опускаясь в нижнюю часть доменной печи, кокс постепенно нагревается до температур близких к 1500оС. Через расположенные в нижней части доменной печи фурмы в печь подается дутье, которое в простейшем случае представляет собой воздух, предварительно нагретый до температур 800 – 1000оС. В результате горения кокса перед фурмами доменной печи развиваются температуры свыше 2000оС.
При таких температурах горение кокса перед фурмами протекает преимущественно по реакции
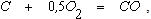
которая при наличии в газовой фазе избытка кислорода сопровождается реакцией

В результате протекания этих реакций в непосредственной близости от фурм в газовой фазе быстро уменьшается концентрация кислорода и увеличивается содержание СО2. Так как обе реакции являются экзотермическими, для этой зоны характерны наиболее высокие температуры (рисунок 2.2).

Рисунок 2.2 – Зависимость состава газовой фазы и температуры в слое горящего углерода от расстояния от места ввода кислорода
После практически полного использования кислорода на некотором расстоянии от фурм получает развитие эндотермическая реакция

в результате протекания которой температура газов несколько понижается. При высоких температурах эта реакция необратимо протекает в направлении образования СО. Поэтому конечным продуктом горения является газ, состоящий из азота и оксида углерода.
Если газ увлажнен, газификация углерода частично протекает также в результате взаимодействия с водяным паром по реакции

При этом продуктом горения является смесь из азота, СО и Н2, которую принято называть горновым газом.
ОБЩАЯ ТЕРМОДИНАМИЧЕСКАЯ ХАРАКТЕРИСТИКА РЕАКЦИЙ ОБРАЗОВАНИЯ И ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ ОКСИДОВ.
Упругость диссоциации оксидов. Оксиды образуются в результате взаимодействия различных веществ с газообразным кислородом по экзотермическим реакциям типа

Система состоит из трех веществ, связанных между собой одним уравнением реакции, следовательно k = 2. Если металл и оксид металла являются чистыми веществами,
количество находящихся в равновесии фаз f = 3. Тогда в соответствии с правилом фаз Гиббса количество степеней свободы системы получим равным
С = k + n – f = 2 +2 – 3 = 1.
Это означает, что, не нарушая фазового состояния системы, можно произвольно изменять только один из ее параметров – температуру.
Согласно принципу ЛеШателье повышение температуры способствует протеканию экзотермической реакции (3.1) в направлении диссоциации оксида на металл и газообразный кислород. Поэтому с ростом температуры химическое сродство окисляемых элементов к кислороду и прочность их оксидов уменьшаются.
Константа равновесия реакции (3.1) может быть записана в виде

Если металл и его оксид являются чистыми веществами, уравнение (3.2) можно записать в виде
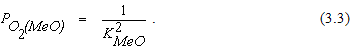
Равновесное парциальное давление кислорода для реакций образования или термической диссоциации оксидов называется упругостью диссоциации оксида. Ее величина связана с константой равновесия реакции и, следовательно, является функцией температуры. Если в системе отсутствуют растворы, упругость диссоциации оксидов может быть использована для оценки химического сродства элементов к кислороду и сравнительной прочности различных оксидов.
В каждом конкретном случае направление реакции (3.1) можно определить, исходя из величины изменения энергии Гиббса системы
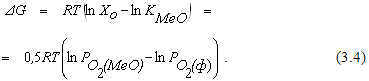
Из соотношения (3.4) видно, что направление реакции зависит от соотношения величин упругости диссоциации оксида и фактического парциального давления кислорода в газовой фазе. Если  , реакция (3.1) протекает в сторону окисления металла. На рисунке 3.1 таким неравновесным системам отвечает поле диаграммы выше равновесной кривой. Протекание реакции в направлении диссоциации оксида становится возможным в условиях, когда
, реакция (3.1) протекает в сторону окисления металла. На рисунке 3.1 таким неравновесным системам отвечает поле диаграммы выше равновесной кривой. Протекание реакции в направлении диссоциации оксида становится возможным в условиях, когда  . Это условие выполняется в неравновесных системах, которые характеризует поле диаграммы, расположенное ниже равновесной кривой.
. Это условие выполняется в неравновесных системах, которые характеризует поле диаграммы, расположенное ниже равновесной кривой.
Сведения об изменении энергии Гиббса реакций образования некоторых оксидов, а также данные об упругости их диссоциации при различных температурах представлены в таблице 3.1.
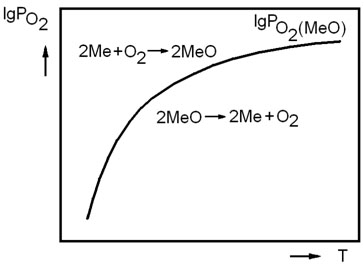
Рисунок 3.1 – Зависимость упругости диссоциации оксида от температуры
Таблица 3.1 – Влияние температуры на упругость диссоциации оксидов

Анализ данных таблицы 3.1 свидетельствует о высоком химическом сродстве элементов к кислороду. Поэтому в атмосфере, содержащей даже очень малые концентрации кислорода, реакции необратимо протекают в направлении образования оксидов.
В атмосфере воздуха термическая диссоциация большинства оксидов не осуществима, так как для этого потребуются температуры, которые нельзя получить в обычных условиях. Например, температура начала разложения FeO при PO2 = 21000 Па составляет около 3500оС. Для оксидов марганца, кремния и других элементов эти температуры увеличиваются до 4000 – 5000оС и более. Поэтому в естественных условиях большинство металлов, кроме благородных, встречается в земной коре в окисленном состоянии.
При температурах металлургических процессов лишь высшие оксиды некоторых металлов в атмосфере воздуха могут подвергаться термической диссоциации. Например, в реакциях

равновесное парциальное давление кислорода становится равным 21000 Па при температурах равных соответственно 1380, 940 и 460оС. Поэтому нагрев этих оксидов до более высоких температур приводит к их термической диссоциации, которая протекает, например, в процессе агломерации.
Упругость диссоциации оксидов при образовании растворов
В реальных металлургических процессах взаимодействующие вещества обычно находятся в твердых или жидких растворах.
Если в качестве стандартных состояний при определении активностей участвующих в реакции веществ принять чистый металл и чистый его оксид, то при наличии ненасыщенных растворов их активности отличаются от единицы и определяются свойствами и составом раствора. В этом случае равновесная величина парциального давления кислорода в газовой фазе  зависит не только от температуры, но и от активности компонентов в растворах.
зависит не только от температуры, но и от активности компонентов в растворах.
Для реакции


откуда

Величина 1/К2 численно равна упругости диссоциации оксида для реакции, протекающей с участием чистых веществ. Это позволяет записать соотношение (3.10) в виде

Заменив активности металла и оксида их концентрациями, получим

Анализ уравнения (3.12) позволяет сделать следующие выводы:
1. При переходе оксида металла в раствор и понижении его концентрации равновесное парциальное давление кислорода в газовой фазе уменьшается, что можно эквивалентно повышению прочности оксида.
2. При переходе окисляемого металла в раствор и понижении его концентрации равновесное парциальное давление кислорода в газовой фазе увеличивается.
ТЕРМОДИНАМИЧЕСКИЕ ОСОБЕННОСТИ РЕАКЦИЙ ОБРАЗОВАНИЯ И ТЕРМИЧЕСКОЙ ДИССОЦИАЦИИ ОКСИДОВ ЖЕЛЕЗА.
Физические свойства железа. В зависимости от температуры твердое железо может существовать в нескольких структурных модификациях. При температурах менее 910оС устойчивым является -Fe, которое имеет объемноцентрированную кубическую кристаллическую решетку. При температурах 910 – 1401оС железо существует в виде -Fe, для которого характерна гранецентрированная кубическая кристаллическая решетка. При температурах 1401 – 1539оС устойчивым является -Fe, кристаллическая решетка которого является объемноцентрированной кубической.
Температура плавления химически чистого железа равна 1539оС. Технически чистое железо, полученное путем окислительного рафинирования, плавится при температуре около 1530оС.
Теплота плавления железа составляет 15,2 кДж/моль или 271,7 кДж/кг.
Кипение железа происходит при температуре 2735оС, хотя авторами некоторых исследований установлены значительно более высокие значения температуры кипения железа (3227 – 3230оС).
Теплота испарения железа составляет 352,5 кДж/моль или 6300 кДж/кг.
Зависимость давления насыщенного пара железа (PFe, Па) от температуры может быть описана уравнением  Расчеты по уравнению (4.1) свидетельствуют о том, что при 1600оС давление насыщенного пара железа составляет 13,3 Па; при 2200оС – около 10 кПа; при 2735оС – 100 кПа. Плотность жидкого железа при 1550 – 1650оС равна 6700 – 6800 кг/м3, при температуре кристаллизации она увеличивается до 6850 кг/м3. Плотность твердого железа при температуре кристаллизации равна 7450 кг/м3, при комнатной температуре – 7800 кг/м3.
Расчеты по уравнению (4.1) свидетельствуют о том, что при 1600оС давление насыщенного пара железа составляет 13,3 Па; при 2200оС – около 10 кПа; при 2735оС – 100 кПа. Плотность жидкого железа при 1550 – 1650оС равна 6700 – 6800 кг/м3, при температуре кристаллизации она увеличивается до 6850 кг/м3. Плотность твердого железа при температуре кристаллизации равна 7450 кг/м3, при комнатной температуре – 7800 кг/м3.
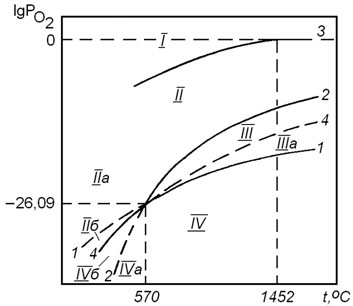
Влияние температуры на упругость диссоциации оксидов железа. Обладая переменной валентностью, железо при взаимодействии с кислородом образует несколько оксидов по реакциям  Результаты расчета равновесных парциальных давлений кислорода в реакциях (4.2), (4.4) и (4.6) при различных температурах показаны на рисунке 4.1. Из рисунка видно, что равновесное парциальное давление кислорода в реакции (4.6) является высоким и достигает 100 кПа при температуре 1452оС. Это позволяет характеризовать
Результаты расчета равновесных парциальных давлений кислорода в реакциях (4.2), (4.4) и (4.6) при различных температурах показаны на рисунке 4.1. Из рисунка видно, что равновесное парциальное давление кислорода в реакции (4.6) является высоким и достигает 100 кПа при температуре 1452оС. Это позволяет характеризовать
реакцию (4.6) как обратимую в широком интервале температур. Равновесные парциальные давления кислорода в реакциях (4.2) и (4.4) очень малы. При анализе данных на рисунке 4.1 нужно обратить внимание на то, что при низких температурах 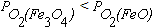 . Это означает, что Fe3O4 является более прочным оксидом. Поэтому при низких температурах оксид FeO не образуется. В этих условиях взаимодействие железа с кислородом протекает по реакции
. Это означает, что Fe3O4 является более прочным оксидом. Поэтому при низких температурах оксид FeO не образуется. В этих условиях взаимодействие железа с кислородом протекает по реакции
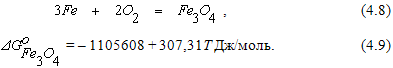
 Т.к.
Т.к.  с ростом температуры упругость диссоциации оксида Fe3O4 увеличивается быстрее упругости диссоциации оксида FeO. При 570оС PO2(FeO) = PO2(Fe3O4), то есть прочность оксидов одинакова. При температурах выше 570оС
с ростом температуры упругость диссоциации оксида Fe3O4 увеличивается быстрее упругости диссоциации оксида FeO. При 570оС PO2(FeO) = PO2(Fe3O4), то есть прочность оксидов одинакова. При температурах выше 570оС 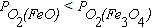 . Это означает, что при высоких температурах наиболее устойчивым из оксидов железа является FeO.
. Это означает, что при высоких температурах наиболее устойчивым из оксидов железа является FeO.
Из сказанного выше следует, что в зависимости от температуры окисление металлического железа до высшего его оксида может протекать по следующим схемам:
При температурах менее 570оС металлическое железо при взаимодействии с кислородом образует оксид Fe3O4 по реакции (4.8), который затем превращается в Fe2O3 по реакции (4.6).
При температурах выше 570оС в результате взаимодействия металлического железа с кислородом образуется оксид FeO по реакции (4.2), после чего протекают реакции (4.4) и (4.6).
В поле диаграммы на рисунке 4.1 можно выделить следующие области. Область I диаграммы является полем устойчивости оксида Fe2O3. В системах, состояние которых описывается точками в этом поле диаграммы, выполняется условие 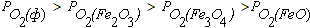 .При этом металлическое железо, а также оксиды FeO и Fe3O4 должны быть окислены до Fe2O3.
.При этом металлическое железо, а также оксиды FeO и Fe3O4 должны быть окислены до Fe2O3.
Область II диаграммы является полем устойчивости оксида Fe3O4. В системах, состояние которых описывается точками в этом поле диаграммы, выполняется условие 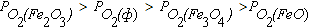 . При этом оксид Fe2O3 подвергаются диссоциации по реакции (4.6), а металлическое железо и FeO окисляются до Fe3O4 по реакциям (4.2), (4.4) и (4.8).
. При этом оксид Fe2O3 подвергаются диссоциации по реакции (4.6), а металлическое железо и FeO окисляются до Fe3O4 по реакциям (4.2), (4.4) и (4.8).
Область III диаграммы является полем устойчивости оксида FeO. В системах, состояние которых описывается точками в этом поле диаграммы, выполняется условие 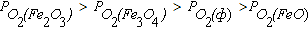 . При этом оксиды Fe2O3 и Fe3O4 подвергаются диссоциации по реакциям (4.6) и (4.4), а металлическое железо окисляется до FeO по реакции (4.2).
. При этом оксиды Fe2O3 и Fe3O4 подвергаются диссоциации по реакциям (4.6) и (4.4), а металлическое железо окисляется до FeO по реакции (4.2).
Область IV диаграммы является полем устойчивости
металлического железа. В системах, состояние которых описывается точками в этом поле диаграммы, окисление железа не происходит, так как выполняется условие  .
.



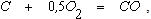






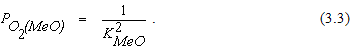
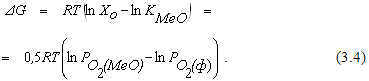
 , реакция (3.1) протекает в сторону окисления металла. На рисунке 3.1 таким неравновесным системам отвечает поле диаграммы выше равновесной кривой. Протекание реакции в направлении диссоциации оксида становится возможным в условиях, когда
, реакция (3.1) протекает в сторону окисления металла. На рисунке 3.1 таким неравновесным системам отвечает поле диаграммы выше равновесной кривой. Протекание реакции в направлении диссоциации оксида становится возможным в условиях, когда  . Это условие выполняется в неравновесных системах, которые характеризует поле диаграммы, расположенное ниже равновесной кривой.
. Это условие выполняется в неравновесных системах, которые характеризует поле диаграммы, расположенное ниже равновесной кривой.


 зависит не только от температуры, но и от активности компонентов в растворах.
зависит не только от температуры, но и от активности компонентов в растворах.




 Расчеты по уравнению (4.1) свидетельствуют о том, что при 1600оС давление насыщенного пара железа составляет 13,3 Па; при 2200оС – около 10 кПа; при 2735оС – 100 кПа. Плотность жидкого железа при 1550 – 1650оС равна 6700 – 6800 кг/м3, при температуре кристаллизации она увеличивается до 6850 кг/м3. Плотность твердого железа при температуре кристаллизации равна 7450 кг/м3, при комнатной температуре – 7800 кг/м3.
Расчеты по уравнению (4.1) свидетельствуют о том, что при 1600оС давление насыщенного пара железа составляет 13,3 Па; при 2200оС – около 10 кПа; при 2735оС – 100 кПа. Плотность жидкого железа при 1550 – 1650оС равна 6700 – 6800 кг/м3, при температуре кристаллизации она увеличивается до 6850 кг/м3. Плотность твердого железа при температуре кристаллизации равна 7450 кг/м3, при комнатной температуре – 7800 кг/м3. Результаты расчета равновесных парциальных давлений кислорода в реакциях (4.2), (4.4) и (4.6) при различных температурах показаны на рисунке 4.1. Из рисунка видно, что равновесное парциальное давление кислорода в реакции (4.6) является высоким и достигает 100 кПа при температуре 1452оС. Это позволяет характеризовать
Результаты расчета равновесных парциальных давлений кислорода в реакциях (4.2), (4.4) и (4.6) при различных температурах показаны на рисунке 4.1. Из рисунка видно, что равновесное парциальное давление кислорода в реакции (4.6) является высоким и достигает 100 кПа при температуре 1452оС. Это позволяет характеризовать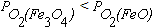 . Это означает, что Fe3O4 является более прочным оксидом. Поэтому при низких температурах оксид FeO не образуется. В этих условиях взаимодействие железа с кислородом протекает по реакции
. Это означает, что Fe3O4 является более прочным оксидом. Поэтому при низких температурах оксид FeO не образуется. В этих условиях взаимодействие железа с кислородом протекает по реакции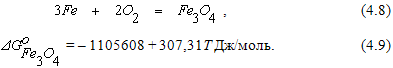
 Т.к.
Т.к.  с ростом температуры упругость диссоциации оксида Fe3O4 увеличивается быстрее упругости диссоциации оксида FeO. При 570оС PO2(FeO) = PO2(Fe3O4), то есть прочность оксидов одинакова. При температурах выше 570оС
с ростом температуры упругость диссоциации оксида Fe3O4 увеличивается быстрее упругости диссоциации оксида FeO. При 570оС PO2(FeO) = PO2(Fe3O4), то есть прочность оксидов одинакова. При температурах выше 570оС 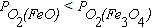 . Это означает, что при высоких температурах наиболее устойчивым из оксидов железа является FeO.
. Это означает, что при высоких температурах наиболее устойчивым из оксидов железа является FeO.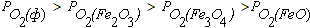 .При этом металлическое железо, а также оксиды FeO и Fe3O4 должны быть окислены до Fe2O3.
.При этом металлическое железо, а также оксиды FeO и Fe3O4 должны быть окислены до Fe2O3.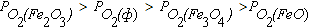 . При этом оксид Fe2O3 подвергаются диссоциации по реакции (4.6), а металлическое железо и FeO окисляются до Fe3O4 по реакциям (4.2), (4.4) и (4.8).
. При этом оксид Fe2O3 подвергаются диссоциации по реакции (4.6), а металлическое железо и FeO окисляются до Fe3O4 по реакциям (4.2), (4.4) и (4.8).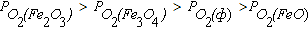 . При этом оксиды Fe2O3 и Fe3O4 подвергаются диссоциации по реакциям (4.6) и (4.4), а металлическое железо окисляется до FeO по реакции (4.2).
. При этом оксиды Fe2O3 и Fe3O4 подвергаются диссоциации по реакциям (4.6) и (4.4), а металлическое железо окисляется до FeO по реакции (4.2). .
.


