Типовые примеры решения задач
Пример 1. Вычислите относительную молекулярную массу серной кислоты, химическая формула которой Н2SO4.
Решение. Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов (их взять из периодической таблицы Д.И.Менделеева), образующих соединение с учетом числа атомов:
Мr (Н2SO4)= 1×2+32+16×4=98
Ответ: Мr (Н2SO4)=98
Пример 2. Вычислите массовую долю кислорода в веществе, формула которого SО3.
Решение. Массовая доля элемента в веществе (w) показывает, какую часть относительной молекулярной массы вещества составляет относительная атомная масса элемента, умноженная на индекс (n) при знаке элемента в формуле. Массовая доля – величина безразмерная. Выражается в долях от единицы или в процентах.
Вычисляем относительную молекулярную массу SО3:
Мr (SO3) = 32+16×3=80
Вычисляем массовую долю кислорода.
Относительная атомная масса кислорода из периодической таблицы Д.И.Менделеева Аr(О) =16
Составим пропорцию: Мr (SO3) 80 - 100%


w(О)=60%
Ответ: w(О)=60%
Пример 3. Какое количество вещества оксида меди (II) содержится в 120 г его массы?
Решение. Используем формулу  ,
,
где n- количество вещества;
m- масса вещества;
М – молярная масса вещества, численно равна относительной молекулярной массе
Относительная молекулярная масса Мr(СuО)=64+16=80, следовательно, молярная масса
М (СuО)=80г/моль.
Пользуясь соотношением 
находим количество вещества: n(СuО)= 
Ответ: n(СuО)= 1,5 моль
Пример 4. Определите массу гидроксида натрия количеством вещества 2 моль.
Решение. Используем формулу  , находим
, находим
Молярная масса М(NаOH)= 23+16+1=40г/моль.
M=nM
m(NаOH)= 2 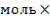 40г/моль=80г.
40г/моль=80г.
Ответ: m(NаOH)=80 г.
Пример 5. Какой объем занимает 4 моль углекислого газа СО2.
Решение. Используем формулу  , где Vm=22,4 л/моль
, где Vm=22,4 л/моль
V(СО2)=n(CO2)  Vm= 4
Vm= 4 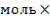 22,4л/моль= 89,6л.
22,4л/моль= 89,6л.
Ответ: V(СО2)=89,6 л.
Пример 6. Вычислите массу осадка, полученного действием раствора, содержащего 8г гидроксида натрия с раствором сульфата меди(II).
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(NаOH)=8г
Найти:
m(Cu(OH)2)-?
|
| 2.Составьте уравнение химической реакции
| Решение:
CuSO4+2 NаOH= Cu(OH)2+Na2SO4
|
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
| CuSO4+2 NаOH= Cu(OH)2+Na2SO4
|
| Под подчеркнутыми формулами подписать по коэффициентам «моли»
| CuSO4+2 NаOH=Cu(OH)2+Na2SO4
2 моль 1 моль
|
| Вычислите количество вещества n, которое записано в «Дано»
|  n(NаOH) =
n(NаOH) = 
|
| Подпишите найденное n под формулой этого вещества
| CuSO4+2 NаOH= Cu(OH)2+Na2SO4
2 моль 1 моль
0,2 моль
|
| Под формулой вещества, массу которого надо найти, поставьте х моль
| CuSO4+2 NаOH= Cu(OH)2+Na2SO4
2 моль 1 моль
0,2 моль х моль
|
| Из полученной пропорции выразите х
| 2 моль 1 моль
0,2 моль х моль
х =  –
это количество вещества n(Cu(OH)2) –
это количество вещества n(Cu(OH)2)
|
| Зная n(Cu(OH)2) найдите массу Cu(OH)2
| m=nM
m(Cu(OH)2)= n Cu(OH)2  M Cu(OH)2
M Cu(OH)2 =64+(16+1) M Cu(OH)2
M Cu(OH)2 =64+(16+1)  2=98г/моль
m(Cu(OH)2)=0,1 2=98г/моль
m(Cu(OH)2)=0,1 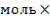 98г/моль=9,8г 98г/моль=9,8г
|
| Запишите ответ
| Ответ: m(Cu(OH)2)=9,8г
|
Задача. Какую массу оксида кальция можно получить при термическом разложении 600 г известняка, содержащего 10% примесей?
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(СаСО3)=600г
W(примесей)=10%
Найти:
m(CаO)-?
|
| 2.Составьте уравнение химической реакции
| Решение:
СаСО3 = СаО+СО2
|
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
| СаСО3 = СаО +СО2
|
| 4.Найдите массу чистого вещества (освободиться от примесей)
| 600г - 100%
Х г - 10% Х=  - масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г - масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г
|
| 5.Под подчеркнутыми формулами подпишите по коэффициентам «моли»
| СаСО3 = СаО +СО2
1 моль 1 моль
|
| 6.Вычислите количество вещества n, которое записано в «Дано». Для расчета берите уже массу чистого вещества
|  n(СаСО3) =
n(СаСО3) = 
|
| 7.Подпишите найденное n под формулой этого вещества
| СаСО3 = СаО +СО2
1 моль 1 моль
5,4 моль
|
| 8.Под формулой вещества, массу которого надо найти, поставьте х моль
| СаСО3 = СаО +СО2
1 моль 1 моль
5,4 моль х моль
|
| 9.Из полученной пропорции выразите х
| 1 моль 1 моль
5,4 моль х моль
х =  –
это количество вещества n(СаО) –
это количество вещества n(СаО)
|
| 10.Зная n(CаО) найдите массу CаO
| m=nM
m(CаO)= n (CаO)  M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4 M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4  г/моль=302,4г г/моль=302,4г
|
| 11.Запишите ответ
| Ответ: m(СаО)=302,4г
|
Задача. Определите массовую долю (в %) КОН в растворе, если КОН массой 40 г растворен в воде массой 160 г.
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(КОН)=40 г
m(воды)=160 г
Найти:
W (КОН)-?
|
| 2. Запишите формулу нахождения массовой доли вещества в растворе
| 
|
| 3.Вычислите общую массу раствора
| m(раствора)=m(КОН)+m(Н2О)
m(раствора)=40+160=200г
|
| 4.Подставьте известные величины в формулу
| 
|
| 5.Запишите ответ
| Ответ: 
|
Задача 1. Какое количество теплоты выделится при сгорании в кислороде 12 г водорода. Термохимическое уравнение горения водорода:
2Н2 + О2 → 2Н2О + 571,6 кДж
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(Н2)=12 г
Найти:
Q -?
|
| 2.Составьте уравнение химической реакции.
| Решение:
2Н2 + O2 = 2Н2О+ 571,6 кДж
|
| 3.В уравнении подчеркните, что записано в «Дано»
| 2Н2 + O2 = 2Н2О+ 571,6 кДж
|
| 4.Под подчеркнутой формулой подпишите число моль:
| 2Н2 + O2 = 2Н2О+ 571,6 кДж
2 моль
|
| 5.Вычислите количество вещества n, которое записано в «Дано».
|  n(Н2) =
n(Н2) = 
|
| 6.Подпишите найденное n под формулой этого вещества
| 2Н2 + O2 = 2Н2О+ 571,6 кДж
2 моль
6 моль
|
| 7.Составьте пропорцию:
| при сгорании 2 моль выделится 571,6 кДж теплоты
при сгорании 6 моль выделится х кДж теплоты
|
| 8.Из полученной пропорции выразите х
| 1 моль 571,6 кДж
6 моль х кДж
х =  – это Q – это Q
|
| 9. Запишите ответ
| Q= 
|
Задача 2. Составьте термохимическое уравнение, если известно, что при сгорании 1 г магния выделяется 25,6 кДж теплоты.
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(Мg)=1 г
Q=25,6 кДж
Найти:
Q' -?
|
| 2. Чтобы составить термохимическое уравнение реакции, нужно вычислить тепловой эффект реакции, написать уравнение горения магния и указать в нем значение этой величины.
|
|
| 3.Составьте уравнение химической реакции.
| Решение:
2Мg + O2 = 2МgО
|
| 4.При анализе условия и уравнения горения магния делают вывод, что, для того чтобы найти тепловой эффект реакции, нужно вычислить количество теплоты, которое выделится при сгорании 2 моль
|
|
| 5.В уравнении подчеркните, что записано в «Дано»
| 2Мg + O2 = 2МgО
|
| 6.Под подчеркнутой формулой подпишите число моль:
| 2Мg + O2 = 2МgО
2 моль
|
| 7.Вычислите количество вещества n, которое записано в «Дано».
|  n(Мg) =
n(Мg) = 
|
| 8.Подпишите найденное nпод формулой этого вещества
| 2Мg + O2 = 2МgО
2 моль
0,04 моль
|
| 9.Составьте пропорцию:
| при сгорании 0,04 моль магния выделится 25,6 кДж теплоты
при сгорании 2 моль магния выделится х кДж теплоты
|
| 10.Из полученной пропорции выразить х
| 0,04 моль 25,6 кДж
2 моль х кДж
х = 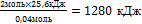
|
| 11. Запишите ответ
| 2Мg + O2 = 2МgО + 1280 кДж
|
Задача 3. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Количество продукта, рассчитанное по уравнению, является максимально возможным значением (теоретическое значение,mтеор). На практике из-за потерь обычно получают меньшее количество (практическое значение,mпракт., mпракт < mтеор).
Практический выход продукта определяется отношением его практического количества к теоретическому: ᶮ = 
При получении продукта в газообразном или жидком состоянии часто определяют отношение не масс, а объемов готового вещества. В этом случае вычисляют объемную долю выхода продукта: ᶮ=  .
.
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(НNО3)=252 г
ᶮ(соли)=90%
Найти:
m(соли)-?
|
| 2.Составьте уравнение химической реакции.
Рассчитайте массу соли по уравнению – это теоретическая масса соли
| Решение:
NаОН + НNO3 = NаNO3+Н2О
|
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
| NаОН + НNO3 = NаNO3 +Н2О
|
| 5.Под подчеркнутыми формулами подпишите по коэффициентам число моль
| NаОН + НNO3 = NаNO3 +Н2О
1 моль 1 моль
|
| 6.Вычислите количество вещества n, которое записано в «Дано».
|  n(НNO3) =
n(НNO3) = 
|
| 7.Подпишите найденное n под формулой этого вещества
| NаОН + НNO3 = NаNO3 +Н2О
1 моль 1 моль
4 моль
|
| 8.Под формулой вещества, массу которого надо найти, поставьте х моль
| NаОН + НNO3 = NаNO3 +Н2О
1 моль 1 моль
4 моль х моль
|
| 9.Из полученной пропорции выразите х
| 1 моль 1 моль
4 моль х моль
х =  –
это количество вещества n(NаNO3) –
это количество вещества n(NаNO3)
|
| 10.Зная n(NаNO3) найдите массу NаNO3
| m=nM
m (NаNO3)= n (NаNO3)  M (NаNO3)
M (NаNO3=23+ 14+16 M (NаNO3)
M (NаNO3=23+ 14+16  =85г/моль
m(NаNO3)=4 =85г/моль
m(NаNO3)=4  г/моль=340г – теоретическая масса соли г/моль=340г – теоретическая масса соли
|
| 11.Вычислите практическую массу полученной соли
| 340 г - 100%
Х г - 90%
х = 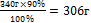 - практическая масса NаNO3 - практическая масса NаNO3
|
| 11.Запишите ответ
| Ответ: m (NаNO3) =306 г
|
Задача. Какая масса воды образуется при взаимодействии серной кислоты со 100 г 10%-ного раствора гидроксида натрия?
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
Mр-ра(NаОН)=100г
W(NаОН)=10%
Найти:
m(Н2О)-?
|
| 2.Составьте уравнение химической реакции
| Решение:
2NаОН + Н2SO4 = Nа2SO4+2Н2О
|
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
| 2NаОН + Н2SO4 = Nа2SO4+ 2Н2О
|
| 4.Найдите массу NаОН в растворе
| 100г - 100%
Х г - 10% Х=  – масса NаОН – масса NаОН
|
| 5.Под подчеркнутыми формулами подписать по коэффициентам «моли»
| 2NаОН + Н2SO4 = Nа2SO4+ 2Н2О
2 моль 2 моль
|
| 6.Вычислите количество вещества n, которое записано в «Дано».
|  n(NаОН) =
n(NаОН) = 
|
| 7.Подпишите найденное n под формулой этого вещества
| 2NаОН + Н2SO4 = Nа2SO4+ 2Н2О
2 моль 2 моль
0,25 моль
|
| 8.Под формулой вещества, массу которого надо найти, поставьте х моль
| 2NаОН + Н2SO4 = Nа2SO4+ 2Н2О
2 моль 2 моль
0,25 моль х моль
|
| 9.Из полученной пропорции выразите х
| 2 моль 2 моль
0,25 моль х моль
х =  –
это количество вещества n(Н2О) –
это количество вещества n(Н2О)
|
| 10.Зная n(Н2О) найдите массу Н2О
| m =nM
m (Н2О)= n (Н2О)  M (Н2О)
M (Н2О) =1 M (Н2О)
M (Н2О) =1  2+16=18г/моль
m(Н2О)=0,25 2+16=18г/моль
m(Н2О)=0,25  г/моль=4,5г г/моль=4,5г
|
| 11.Запишите ответ
| Ответ: m(Н2О)=4,5г
|
Задача. Вычислите массу осадка, полученного действием раствора, содержащего 8 г сульфата меди (II), на раствор, содержащий 10 г гидроксида натрия.
Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т.е. в соответствии с уравнением реакции и расчетным уравнением.
Чаще один реагент берется в избытке, а следовательно, другой реагент окажется в недостатке. Избыток реагента вступать в реакцию не будет.
Расчет получаемых количеств, масс и объемов (для газов) продуктов проводят только по реагенту в недостатке.
| Последовательность действий
| Пример выполнения действий
|
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений
| Дано:
m(СuSO4)=8г
m(NaOH)=10г
Найти:
m(Cu(OН)2)-?
|
| 2.Составьте уравнение химической реакции
| Решение:
СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
|
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти»
| СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
|
| 4.Под подчеркнутыми формулами подпишите по коэффициентам число моль
| СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
1 моль 2 моль 1 моль
|
| 5.Под формулой вещества, массу которого надо найти поставьте х моль
| СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
1 моль 2 моль 1 моль
х моль
|
| 6.Вычислите количество веществ n, которые записаны в «Дано».
|  n(СuSO4) =
n(СuSO4) =  – то, что есть по условию задачи
n(NaOH) = – то, что есть по условию задачи
n(NaOH) =  - то, что есть по условию задачи - то, что есть по условию задачи
|
| 7.Подпишите найденное n под формулами этих веществ
| СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
1 моль 2 моль 1 моль
0,05 моль 0,25 моль х моль
|
| 8. Найдите, какое из исходных веществ СuSO4 или NaOH взято в избытке, составив пропорцию (х можно подставить или под СuSO4 или NaOH)
|  Х=
Х=  - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4. - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
|
| 9.Выразите х уже через СuSO4.
| СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4
1 моль 2 моль1 моль
0,05 моль 0,25 моль х моль
|
| 10.Из полученной пропорции выразите х
| 1 моль 1 моль
0,05 моль х моль
х =  –
это количество вещества n(Cu(OН)2) –
это количество вещества n(Cu(OН)2)
|
| 11.Зная n(Cu(OН)2) найдите массу Cu(OН)2
| m=nM
m(Cu(OН)2)= n (Cu(OН)2)  M (Cu(OН)2)
M (Cu(OН)2) =64+17 M (Cu(OН)2)
M (Cu(OН)2) =64+17  =98г/моль
m(Cu(OН)2)=0,05 =98г/моль
m(Cu(OН)2)=0,05  г/моль=4,9г г/моль=4,9г
|
| 12.Запишите ответ
| Ответ: m(Cu(OН)2)=4,9г
|





 ,
,

 , находим
, находим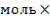 40г/моль=80г.
40г/моль=80г. , где Vm=22,4 л/моль
, где Vm=22,4 л/моль Vm= 4
Vm= 4  n(NаOH) =
n(NаOH) = 
 –
это количество вещества n(Cu(OH)2)
–
это количество вещества n(Cu(OH)2)
 M Cu(OH)2
M Cu(OH)2 =64+(16+1)
M Cu(OH)2
M Cu(OH)2 =64+(16+1)  - масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г
- масса примесей,
Тогда масса чистого СаСО3 равна 600-60=540г
 n(СаСО3) =
n(СаСО3) = 
 –
это количество вещества n(СаО)
–
это количество вещества n(СаО)
 M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4
M (СаО)
M (CаО) =40+16=56г/моль
m(СаО)=5,4  г/моль=302,4г
г/моль=302,4г




 – это Q
– это Q


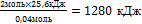

 .
.
 –
это количество вещества n(NаNO3)
–
это количество вещества n(NаNO3)
 =85г/моль
m(NаNO3)=4
=85г/моль
m(NаNO3)=4  г/моль=340г – теоретическая масса соли
г/моль=340г – теоретическая масса соли
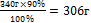 - практическая масса NаNO3
- практическая масса NаNO3
 – масса NаОН
– масса NаОН

 –
это количество вещества n(Н2О)
–
это количество вещества n(Н2О)
 г/моль=4,5г
г/моль=4,5г
 – то, что есть по условию задачи
n(NaOH) =
– то, что есть по условию задачи
n(NaOH) =  - то, что есть по условию задачи
- то, что есть по условию задачи
 Х=
Х=  - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
- должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
 –
это количество вещества n(Cu(OН)2)
–
это количество вещества n(Cu(OН)2)
 =98г/моль
m(Cu(OН)2)=0,05
=98г/моль
m(Cu(OН)2)=0,05  г/моль=4,9г
г/моль=4,9г



