Химия кремния
Содержание
§ 1. КРЕМНИЙ И ЕГО СВОЙСТВА 3
§ 2. БИНАРНЫЕ СОЕДИНЕНИЯ КРЕМНИЯ 5
И ИХ ПРОИЗВОДНЫЕ
§ 3. КИСЛОРОДНЫЕ СОЕДИНЕНИЯ КРЕМНИЯ 6
§ 4. СИЛИЦИДЫ 14
§ 5. СОЕДИНЕНИЯ КРЕМНИЯ С УГЛЕРОДОМ 15
§ 6. ГИДРИДЫ КРЕМНИЯ, ИЛИ СИЛАНЫ 17
§ 7. ГАЛОГЕНИДЫ КРЕМНИЯ 18
§ 8. БОРИДЫ И НИТРИДЫ КРЕМНИЯ 21
§ 9. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
О КРЕМНИЙОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ 22
§ 10. СИЛИКАТЫ И АЛЮМОСИЛИКАТЫ 25
§ 11. СИЛИКАТЫ ЩЕЛОЧНЫХ МЕТАЛЛОВ 32
§ 12. РАСТВОРИМОЕ СТЕКЛО 33
§ 13. СИЛИКАТЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ 34
§ 14. СИЛИКАТЫ И ГИДРОСИЛИКАТЫ АЛЮМИНИЯ 39
§ 15. СИЛИКАТЫ ДРУГИХ МЕТАЛЛОВ 45
§ 16. АЛЮМОСИЛИКАТЫ 48
§ 17. ОСНОВНЫЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ
В СИЛИКАТНЫХ ПРОИЗВОДСТВАХ 51
КРЕМНИЙ И ЕГО СВОЙСТВА
Кремний в свободном виде в природе не встречается, но его соединения широко распространены в земной коре и мантии. Впервые кремний в элементарном виде был получен при прокаливании смеси, состоящей из металлического калия и кремнефторида калия, по уравнению реакции
4К +K2SiF6 = 6KF + Si
Образующийся KF и оставшийся K2SiF6 хорошо растворимы в воде и поэтому при обработке, продуктов реакции водой удаляются в виде водного раствора. Оставшийся темно-бурый осадок пл. 2000 кг/м3 (2,0 г/см3) * представляет собой тонко-дисперсную разновидность элементарного кремния. Подобным образом кремний может быть выделен из K2SiF6 металлическим натрием или металлическим алюминием.
Практически для лабораторных целей кремний получают нагреванием смеси, состоящей из тонкоизмельченного кремнезема SiO2 и металлического магния:
SiО2+ 2Mg = 2MgO + Si
Получающийся в продуктах реакции оксид, магния растворяется соляной кислотой. Остаток, состоящий из смеси непрореагировавшей части кремнезема и образовавшегося кремния, обрабатывается фтористоводородной кислотой. При этом кремнезем, реагируя с HF, превращается в газообразный фтористый кремний SiF4 по уравнению реакции
SiO2 + 4HF = 2H2O + SiF4
в остатке получается элементарный кремний в тонкодисперсном состоянии.
Для технического использования кремний получают восстановлением кремнезема коксом в электрических печах. В зависимости от условий эта реакция может протекать как в одну, так и в две фазы. Однофазовая реакция
SiO2 + 2C = Si+2CO
Двухфазовая реакция
I фаза 2SiO2 + 6С = 2SiC + 4CO
II фаза SiO2 + 2SiC = 3Si + 2СО
Суммарная 3SiO2 + 6С = 3Si + 6СО
Некоторое время полагали, что получающийся описанными способами темно-бурый тонкодисперсный порошок представляет собой аморфную разновидность элементарного кремния. Это было опровергнуто рентгеноструктурным анализом, установившим, что так называемый аморфный кремний в действительности представляет собой кристаллический кремний в чрезвычайно раздробленном виде. Если такой кремний растворить в расплавленном цинке, алюминии или в серебре и затем медленно охладить расплав, то элементарный кремний получается в виде хорошо развитых кристаллов.
Кристаллический кремний в чистом виде представляет собой твердое (по шкале твердости 7)*, хрупкое, стального цвета с красноватым оттенком и металлическим блеском вещество, кристаллизующееся в виде октаэдров кубической системы. Плотность его колеблется от 2,35 до 2,49 г/см3 и в среднем принимается равной 2,42 г/см3. Плавится кремний, при 1420° С, а кипит при 3500° С. В чистом виде кремний почти не электропроводен, но в присутствии даже незначительного количества примесей он становится электропроводным. С повышением температуры электропроводность кремния возрастает. Кремний — полупроводник. В присутствии примесей Pb, As, Bi он обладает электронной проводимостью; в присутствии В, Al, In — «дырочной».
В периодической системе элементов кремний находится в третьем ряду четвертой группы. Порядковый номер его 14. Он имеет пять изотопов, три из них с атомными массами 28, 29 и 30 существуют в природных соединениях кремния и два радиоактивных изотопа с атомными массами 27 и 31получены искусственным путем. Элементарный кремний представляет собой смесь перечисленных трех изотопов, поэтому элементарная масса атома кремния в химических расчетах принимается равной 28,06. Высшая степень окисления его равна четырем (—4 и +4). Он подобно углероду образует различные химические соединения как простого, так и сложного состава. В некоторых соединениях максимальное координационное число кремния равно шести, например у фторосиликатов H2SiF6.
Элементарный кремний способен соединяться при обычных температурах с газообразным фтором (жидкий фтор с кремнием не реагирует). Будучи в тонкодисперсном состоянии, кремний поглощает пары воды и газообразный водород и при нагревании обратно их не выделяет. Минеральные кислоты, в том числе и плавиковая кислота, на крупнокристаллический кремний действуют весьма слабо.
С увеличением степени дисперсности активность реакции с кислотами несколько повышается, при этом кремний частично растворяется во фтористоводородной и азотной кислотах, а также в смесях, состоящих из HF и НNОз, КСlOз, HNO3 с добавками фторидов и т. д. Растворы едких щелочей, реагируя с кремнием, выделяют водород и образуют соли кремниевых кислот по уравнению
Si + 2КОН + Н2О = K2SiO3 + 2Н2
Эта же реакция происходит и в том случае, когда количество едкой щелочи в водном растворе незначительно, и она, по существу, является в основном катализатором, образующим промежуточное соединение K2SiO3, которое тут же гидролизуется на Н2SiOз и КОН по уравнению
K2Si03 + 2Н2О = H2SiO3 + 2KOH
Из расплавленных едких щелочей кремний вытесняет водород
Si +4NaOH = Na4Si04 +2Н2
Галогеноводородные соединения, реагируя с элементарным кремнием, выделяют водород и образуют соответствующие галогенокремниевые соединения. При нагревании кремний разлагает также фториды, бромиды и иодиды некоторых металлов, вытесняя из них соответствующий металл:
4AgF + Si = SiF4 + 4Ag
Серная кислота окисляет кремний до кремнезема.
При нагревании химическая активность кремния возрастает, Так, около
300° С начинается взаимодействие его с хлором, при 500° С с бромом и при более высоких температурах с иодом. С кислородом кремний вступает в реакцию при 400° С и выше; при этом образуется кремнезем в виде белого дыма:
Si +O2=SiO2
Сера при белом калении образует сульфиды кремния, а азот при 1300° С — нитриды кремния. При тех же высоких температурах кремний непосредственно взаимодействует с углеродом и бором.
Многие оксиды металлов при высоких температурах восстанавливаются кремнием до металла, что используется в металлургической промышленности. Исключение составляют оксиды щелочных и щелочноземельных металлов, кроме оксида бария, а также оксиды алюминия и бора. При повышенных температурах кремний разлагает и аммиак с образованием нитрида кремния.
В земной коре кремний является одним из наиболее распространенных химических элементов. По подсчетам А. П. Виноградова, количество кремния составляет 27,5%. Он занимает второе место после кислорода, количество которого достигает примерно 49%. По тем же подсчетам углерод, фосфор, сера и марганец вместе составляют всего лишь 0,67%, алюминий 7,45%, железо 4,2%, кальций 3,25%, калий, магний и натрий каждый в отдельности не превышают пo 2,5% и водород—1,0%.
Среди минералов и горных пород, содержащих кремний и доступных исследованию, преобладают породы, содержащие 55% полевошпатовых минералов, затем 15% силикатов различных элементов, 12% кремнезема в виде кварца и халцедона, 3% слюды, 1,5% глины. Полагают, что соединения кремния в виде кремнийсодержащих горных пород простираются в глубь земли не менее чем на 1000-км от ее поверхности. Присутствие кремния в значительном количестве в составе каменных метеоритов и тектитов, а также в составе верхней оболочки солнца (что было доказано спектральным анализом) показывает, что этот элемент имеет не только земное, но и космическое распространение.
В элементарном виде кремний используется для получения технического водорода, а также изготовления полупроводников, широко применяющихся в электронной технике, для создания солнечных батарей, обеспечивающих питание электроэнергией космические корабли, и для других целей.
БИНАРНЫЕ СОЕДИНЕНИЯ КРЕМНИЯ
И ИХ ПРОИЗВОДНЫЕ
Вещества, молекулы которых состоят из атомов только двуххимических элементов, называются бинарными соединениями. Свыше 80 химических элементов способны непосредственно соединяться с кремнием, образуя с ним свыше 160 бинарных соединий специальных целей, а также в качестве исходного сырья для получения сложных кремнийсодержащих веществ. К наиболее рас-
дом, затем с металлами, углеродом, водородом, галогенами, серой
и т. д.
СИЛИЦИДЫ
Бинарные соединения кремния с металлами, у которых степень окисления кремния —4, называются силицидами. Среди природных минералов силициды не обнаружены. В химии их получают искусственным путем. В настоящее время известны силициды лития, натрия, калия, рубидия, цезия, магния, кальция, стронция, бария, титана, циркония, гафния, церия, тория, ванадия, ниобия, титана, хрома, молибдена, вольфрама, марганца, железа, никеля, кобальта, иридия, платины и некоторых других элементов. Со многими из перечисленных металлов кремний образует два, три или несколько видов силицидов, состав которых может быть выражен как Me2Si, MeSi, MeSi2, MeSi3 и т. д., где Me — металл. Кроме этих известны силициды и более сложного состава. Получают силициды следующими методами:
1. Прямым соединением металла с элементарным кремнием по уравнению реакции
Me + Si → MeSi
Осуществляют ее или горячим прессованием при высоких температурах смеси, состоящей из тонкоизмельченных реагентов, или растворением элементарного кремния в расплавленном металле, или взаимодействием раскаленного металла с парами кремния.
2. Восстановлением оксида металла элементарным кремнием по схеме
2МеО + 3Si → 2MeSi + SiO2
или восстановлением смеси, состоящей из тонкоизмельченных оксидов металла, диоксида кремния и восстановителя —либо углерода
MeO + SiO2 + 3C → MeSi+3CO
либо алюминиевого или магниевого порошка в присутствии серы
МеО + Al(Mg) + SiO2 + S → MeSi + Mg + шлак
3. Замещением металлом галогенида в галогенопроизводных
силанах. Реакция протекает в присутствии водорода:
Me + SiCl4 + 2H2 = MeSi + 4HC1
Связь между атомами кремния и металла в обычных силицидах металлическая, а в силицидах, богатых кремнием, может быть выражена в виде структуры










 Si Si Si Si Si
Si Si Si Si Si
Как лабораторные, так и промышленные способы получения силицидов требуют высоких температур и обычно осуществляются в электропечах, в графитовых, корундовых или бериллиевых тиглях в вакууме или в атмосфере аргона.
Вода на силициды не действует. Минеральные кислоты, за исключением фтористоводородной, на большинство силицидов оказывают лишь слабое разрушающее воздействие. Исключение составляют силициды лития и силициды щелочноземельных металлов. Едкие щелочи в расплавленном состоянии в присутствии кислорода воздуха разлагают силициды с образованием соответствующих силикатов.
Силициды хорошо кристаллизуются. Многие из них огнеупорны. Например, силицид циркония Zr5Si плавится при 2250° С, силицид молибдена MoSi2 при 2030°. Благодаря этому их используют в электронагревательных приборах для продолжительной работы при высоких температурах. Некоторые силициды, как силицид магния MgSi и силицид молибдена MoSi2, обладают высоким электрическим сопротивлением, которое с повышением температуры увеличивается у MoSi2. В то же время силициды железа представляют собой полупроводники. Одни силициды используются в металлических процессах в качестве восстановителей (силициды кальция) и ферросилиция для полного раскисления сталей и удаления из них серы и фосфора, а другие, например силициды железа, марганца, вольфрама и ванадия, служат для введения этих металлов в состав соответствующих сплавов.
ГИДРИДЫ КРЕМНИЯ, ИЛИ СИЛАНЫ

 Водородные соединения кремния принято называть гидридами кремния, или силанами. Подобно насыщенным углеводородам гидриды кремния образуют гомологический ряд, в котором атомы кремния соединены между собой одинарной связью
Водородные соединения кремния принято называть гидридами кремния, или силанами. Подобно насыщенным углеводородам гидриды кремния образуют гомологический ряд, в котором атомы кремния соединены между собой одинарной связью

 —Si—Si —Si —Si —Si— и т. д.
—Si—Si —Si —Si —Si— и т. д.
Простейшим.представителем
этого гомологического ряда является моносилан, или просто силан, SiH4, строение молекулы которого подобно строению метана, затем следует
дисилан H3Si—SiH3, который по строению молекулы подобен этану, затем трисилан H3Si—SiH2—SiH3,
тетрасилан H3Si—SiH2—SiH2—SiH3,
пентасилан H3Si—SiH2—SiH2—SiH2^-—SiH3 и последний из полученных силанов этого гомологического ряда
гексасилан Н3Si—SiH2—SiH2—SiH2—SiH2—SiH3. Силаны в чистом виде в природе не встречаются. Получают их искусственным способом:
1. Разложением силицидов металлов кислотами или щелочами по уравнению реакции
Mg2Si+ 4HCI = 2MgCl2 + SiH4
при этом образуется смесь силанов, которую затем разделяют дробной перегонкой при весьма низких температурах.
2. Восстановлением галогеносиланов гидридом лития или алюмогидридом лития:
SiCl4 + 4 LiH = 4LiCl + SiH4
Этот способ получения силалов впервые описан в 1947 г.
3. Восстановлением галогеносиланов водородом. Реакция протекает при 300 — 400° С в реакционных трубках, наполненных контактной смесью, содержащей, кремний, металлическую медь и в качестве катализаторов 1 — 2% галогенидов алюминия.
Несмотря на сходство в молекулярном строении ситанов и предельных углеводородов, физические свойства их различны.
По сравнению с углеводородами силаны менее устойчивы. Наиболее устойчивым из них является моносилан SiH4, разлагающийся на кремний и водород только при красном калении. Другие силаны с большим содержанием кремния при значительно более низких температурах образуют низшие производные. Например, дисилан Si2H6 дает при 300° С силан и твердый полимер, а гексасилан Si6H14 разлагается медленно даже при нормальных температурах. При соприкосновении с кислородом силаны легко окисляются, а некоторые из них, например моносилан SiH4, самовоспламеняются при —180° С. Силаны легко гидролизуются на диоксид кремния и водород:
SiH4 + 2H20 = SiO2 + 4H2
У высших силанов этот процесс совершается с расщеплением
связи — Si — Si — Si — между атомами кремния. Например, три-
силан Si3H8 дает три молекулы SiO2 и десять молекул газообразного водорода:
H3Si - SiH2 - SiH3 + 6Н3О = 3SiO2 + 10Н2
В присутствии едких щелочей в результате гидролиза силанов образуется силикат соответствующего щелочного металла и водород:
SiH4 + 2NaOH + H20 = Na2Si03 + 4H2
ГАЛОГЕНИДЫ КРЕМНИЯ







 К бинарным соединениям кремния относятся также и галогеносиланы. Подобно гидридам кремния — силанам — они образуют гомологический ряд химических соединений, в которых атомы галогенида непосредственно соединены с атомами кремния, связанными между собой одинарными связями
К бинарным соединениям кремния относятся также и галогеносиланы. Подобно гидридам кремния — силанам — они образуют гомологический ряд химических соединений, в которых атомы галогенида непосредственно соединены с атомами кремния, связанными между собой одинарными связями
и т. д. в цепочки соответствующей длины. Благодаря такому сходству галогеносиланы можно рассматривать как продукты замещения водорода в силанах на соответствующий галоген. При этом замещение может быть полным и неполным. В последнем случае получаются галогенопроизводные силанов. Наивысшим, известным до настоящего времени галогеносилаиом считается хлорсилан Si25Cl52. Галогеносиланы и их галогенопроизводные в природе в чистом виде не встречаются и могут быть получены исключительно искусственным путем.
1. Непосредственным соединением элементарного кремния с галогенами. Например, SiCl4 получают из ферросилиция, содержащего от 35 до 50% кремния, обрабатывая его при 350—500° С сухим хлором. При этом в качестве основного продукта получают SiCl4 в смеси с другими более сложными галогеносиланами Si2С16, Si3Cl8 и т. д. по уравнению реакции
Si + 2Cl2 = SiCl4
Это же соединение может быть получено хлорированием смеси кремнезема с коксом при высоких температурах. Реакция протекает по схеме
SiO2+ 2C=Si +2CO
 Si + 2C12 =SiС14
Si + 2C12 =SiС14
SiO2 + 2C + 2Cl2 = 2CO + SiCl4
Тетрабромсилан получают бромированием при красном калении элементарного кремния парами брома:
Si + 2Вг2 = SiBr4
или смеси кремнезема с коксом:
SiO2 + 2C = Si+2CO
Si + 2Br3 = SiBi4
 SiO2 + 2С + 2Br2 = 2CO + SiBr4
SiO2 + 2С + 2Br2 = 2CO + SiBr4
При этом одновременно с тетрасиланами возможно образование силанов высших степеней. Например, при хлорировании силицида магния получают 80% SiCI4, 20% SiCl6 и 0,5—1% Si3Cl8; при хлорировании силицида кальция состав продуктов реакции выражается в таком виде: 65% SiС14; 30% Si2Cl6; 4% Si3Cl8.
2. Галогенирование силанов галогецоводородами в присутствии катализаторов А1Вг3 при температурах свыше 100° С. Реакция протекает по схеме
SiH4 + НВг = SiH3Br + Н2
SiН4 + 2НВг = SiH2Br2 + 2H2
3. Галогенирование силанов хлороформом в присутствии катализаторов АlСl3:
Si3H8 + 4СНС13 = Si3H4Cl4 + 4СН2С13
Si3H8 + 5СНСl3 = Si3Н3С15 + 5СН2С12
4. Тетрафторид кремния получают действием на кремнезем плавиковой кислотой:
SiO2 + 4HF= SiF4 + 2H20
5. Некоторые полигалогеносиланы могут быть получены из простейших галогеносиланов галогенировалием их соответствующим галогенидом. Например, тетраиодсилан в запаянной трубке при 200—300° С, реагируя с серебром, выделяет гексаиоддисилан по
Иодсиланы могут быть получены при взаимодействии иода с силанами в среде четыреххлористого углерода или хлороформа, а также в присутствии катализатора AlI3 при взаимодействии силана с йодистым водородом
Галогеносиланы менее прочны, чем подобные им по строению галогенопроизводные углеводородов. Они легко гидролизуются, образуя силикагель и галогеноводородную кислоту:
SiCl4 + 2H2O = Si02 + 4HCl
Простейшими представителями галогеносиланов являются SiF4,SiCl4, SiBr4 и SiI4. Из них в технике в основном используются тетрафторсилан и тётрахлорсилан. Тетрафторсилан SiF4 -бесцветный газ с острым запахом, на воздухе дымит, гидролизуется на кремнефтористрводородную кислоту и силикагель. Получают SiF4 действием фтористоводородной кислоты на кремнезем по уравнению реакции
SiО2 + 4HF = SlF4 + 2H20
Для промышленного получения. SiF4 используют плавиковый шпат CaF2, кремнезем SiO2 и серную кислоту H2SO4. Реакция протекает в две фазы:
2CaF2 + 2H3SO4 = 2СаSО4 + 4HF
 SiO2 + 4HF = 2H2O + SiF4
SiO2 + 4HF = 2H2O + SiF4
2CaF2 + 2H2S04 + SiO2 = 2CaSO4 + 2H2O + SiF4
Газообразное состояние и летучесть тетрафторсилана используется для травления известковонатриевых силикатных стекол фтористым водородом. При взаимодействии фтористого водорода со стеклом образуется тетрафторсилан, фторид кальция, фто-_ рид натрия и вода. Тетрафторсилан, улетучиваясь, освобождает новые более глубокие слои стекла для реакции с фтористым водородом. На месте реакции остаются CaF2 и NaF, которые растворяются в воде и тем самым освобождают доступ фтористому водороду для дальнейшего проникновения к свежеоголенной поверхности стекла. Протравленная поверхность может быть матовой или прозрачной. Матовое травление получается при действий на стекло газообразного фтористого водорода, прозрачное — при травлении водными растворами плавиковой кислоты. Если пропускать тетрафторсилан в воду, получаются H2SiF6 и кремнезем в виде геля:
3SiF4 + 2Н2О = 2H2SiF6 + Si02
Кремнефтористоводородная кислота относится к числу сильных двухосновных кислот, в свободном состоянии не получена, при выпаривании разлагается на SiF4 и 2HF, которые улетучиваются; с едкими щелочами образует кислые и нормальные соли:
H2SlF6 + 2NaOH.= Na2SiF6 + 2H2O
с избытком щелочей дает фторид щелочного металла, кремнезем и воду:
H2SiF6 + 6NaOH = 6NaF+SiO2 + 4H2O
Выделяющийся в этой реакции кремнезем реагирует с едкой ще-
лочью и приводит к образованию силиката:
SiO2 + 2NaOH = Na2SiO3+H2O
Соли кремнефтористоводородной кислоты называются силикофторидами или флюатами. В настоящее время известны кремнефто-риды Na, H, Rb, Cs, NH4, Cu, Ag, Hg, Mg, Ca, Sr, Ba, Cd, Zn, Mn, Ni, Co, Al, Fe, Cr, Pb и т. д.
В технике для различных целей используются кремнефториды натрия Na2SiF6, магния MgSiF6*6HgO, цинка ZnSiF6 * 6H2O, алюминия Al2(SiF6)3, свинца PbSiF6, бария BaSiF6 и др. Кремнефториды обладают антисептическими и уплотняющими свойствами; в то же время они являются антипиренами. Благодаря этому их используют для пропитки древесины, чтобы предотвратить преждевременное загнивание ее и уберечь от воспламенения при пожарах. Кремнефторидами пропитывают также искусственные и естественные камни строительного назначения для уплотнения их. Сущность пропитки заключается в том, что раствор кремнефторидов, проникая в поры и трещины камня, реагирует с карбонатом кальция и некоторыми другими соединениями и образует нерастворимые соли, отлагающиеся в порах и уплотняющие их. Это значительно повышает сопротивляемость камня выветриванию. Материалы, которые совсем не содержат карбоната кальция или содержат его мало, предварительно обрабатываются аванфлюатами, т.е. веществами, содержащими в растворенном виде соли кальция, силикаты щелочных металлов и другие вещества, способные образовывать с флюатами нерастворимые осадки. В качестве флюатов используются кремнефториды магния, цинка и алюминия. Процесс флюатирования может быть представлен в таком виде:
MgSiF6 + 2СаСО3 = MgF2 + 2CaF2 + SiO2 + 2СО2
ZnSiF6 + ЗСаС03 = 3CaF6 + ZnCO3 + SiO2 + 2CO2
Al2(SiF6)3 + 6CaCO3 =. 2A1F3 + 6CaF2 + 3SiO2 + 6CO2
Кремнефториды щелочных металлов получаются при взаимодействии кремнефтористоводородной кислоты с растворами солей этих металлов:
2NaCl + H2SiF6 = Na2SlF6 + 2НС1
Это студенистые осадки, растворимые в воде и практически нерастворимые в абсолютном спирте. Поэтому их используют в количественном анализе при определении кремнезема объемным методом. Для технических целей используется кремнефторид натрия, получающийся в виде белого порошка в качестве побочного продукта в производстве суперфосфата. Из смеси Na2SiF6 и А12О3 при 800° С образуется криолит 3NaF٠AlF3,который широко применяется в производстве зубных цементов и является хорошим глушителем как в стекольном деле, так и при изготовлении непрозрачных глазурей и эмалей.
Кремнефторид натрия как один из компонентов вводится в со- став химически стойких замазок, изготовляемых на жидком стекле:
Na2SiF6 + 2Na2SiO3 = 6NaF + 3SiO2
Выделяющийся по этой реакции кремнезем придает затвердевшей замазке химическую устойчивость. В то же время Na2SiF6 является ускорителем твердения. Кремнефторид натрия вводится также в качестве минерализатора в сырьевые смеси при производстве цементов.
Тетрахлорсилан SiCl4 —бесцветная, дымящая.на воздухе, легко гидролизующаяся жидкость, получающаяся хлорированием карборунда или ферросилиция действием на силаны при повышенных температурах
Тетрахлорсилан — основной исходный продукт для получения многих кремнийорганических соединений.
Тетрабромсилан SiBr4 — бесцветная, дымящая на воздухе, легко гидролизующаяся на SiО2 и НВг жидкость, получающаяся при температуре красного каления, при пропускании над раскаленным элементарным кремнием паров брома.
Тетраиодсилан SiI4 — белое кристаллическое вещество, получающееся при пропускании смеси паров иода с диоксидом углерода над раскаленным элементарным кремнием.
Бориды и нитриды кремния
Боридами кремния называют соединения кремния с бором. В настоящее время известно два борнда кремния: триборид кремния B3Si и гексаборид кремния B6Si. Это чрезвычайно твердые, химически стойкие и огнеупорные вещества. Получают их сплавлением в электрическом токе тонкоизмельченной смеси, состоящей из 5 вес. ч. элементарного кремния и 1 вес. ч. бора. Сцекшуюся массу очищают расплавленным карбонатом калия. Г. М. Самсонов и В. П. Латышев получили триборид кремния горячим прессованием при 1600—18000С.
Триборид кремния с пл. 2,52 г/см3 образует черные пластин-
чатого строения ромбические кристаллы, просвечивающиеся
в тонком слое в желто-бурых тонах. Гексаборид кремния с пл.
2,47 г/см3 получается в виде непрозрачных опаковых зерен непра-
вильной формы.
Бориды кремния плавятся около 2000° С, но окисляются весьма медленно даже при высоких температурах. Это дает возможность использовать их в качестве специальных огнеупоров. Твердость боридов кремния весьма высока, и в этом отношении они приближаются к карборунду.
Соединения кремния с азотом называются нитридами кремния. Известны следующие нитриды: Si3N4, Si2N3 и SIN. Нитриды кремния получаются при прокаливании элементарного кремния в атмосфере чистого азота в температурном интервале от 1300 до 1500° С. Нормальный нитрид кремния Si3N4 может быть получен из смеси кремнезема с коксом, прокаливаемой в атмосфере чистого азота при 1400—1500° С:
6С + 3Si02 + 2N3 ͢ Si3N4 + 6CO
Si3N4 — серовато-белый огнеупорный и кислотостойкий порошок, улетучивающийся лишь свыше 1900° С. Нитрид кремния гидролизуется с выделением кремнезема и аммиака:
Si3N4 + 6H2O = 3SiO2 + 4NH3
Концентрированная серная кислота при нагревании медленно разлагает Si3N4, а разбавленная кремнефтористоводородная разлагает его более энергично.
Нитрид кремния состава Si2N3 получается тоже действием азота при высоких температурах на элементарный кремний или на карбоазоткремний C2Si2N + N2=2C + Si2N3.
Кроме бинарных соединений кремния с азотом в настоящее время известно много других более сложных, в основе которых лежит непосредственная связь атомов кремния с атомами азота, например: 1) аминосиланы SiH3NH2, SiH2(NH2)2, SiH(NH2}3, Si(NH2)4; 2) силиламины NH2(SiH3), NH(SiH3)2, N(SiH3)3; 3) азотсодержащие соединения кремния более сложного состава.
ОБЩИЕ ПРЕДСТАВЛЕНИЯ
СИЛИКАТЫ И АЛЮМОСИЛИКАТЫ
По общепринятой в химии терминологии силикатами следует
называть соли кремниевых кислот. Однако, поскольку кремниевые
кислоты в чистом виде не выделены, силикатами называют хими-
ческие соединения, в которых кремний присутствует в составе
иона [SiO4]4- или производных последнего.
Химический состав силикатов принято выражать формулами оксидов тех элементов, которые входят в рассматриваемое химическое вещество, например, формулу ортосиликата натрия Na4SiO4 записывают 2Na2O • SiO2, вместо CaSi03 пишут CaO . SiO2, вместо H4Al2Si2O9—Al203 . 2SiO2 . 2H2O и т. д. В основе пространственного строения кристаллических силикатов находится четырехзарядный ион [Si04]4- (см. рис. 1) и его различные сочетания. В зависимости от этого силикаты классифицируются на следующие группы:
1. Силикаты с изолированными, т. е. не связанными между собой непосредственно тетраэдрами [Si04]4-. В кристаллической структуре таких силикатов связь между ионами [SiO4]4- осуществляется ионами тех металлов, какие входят в состав соответствующего соединения. Примером такого кристаллического строения силикатов служит минерал форстерит 2MgO . Si02 (рис.2). Ионы [SiO4]4- изображены треугольниками, в вершинах которых находятся ионы кислорода (рис. 2), а в центре треугольника — ион кремния. Этот ион виден только тогда, когда весь тетраэдр [SiO4]4- повернут к нам кремнием и от нас кислородом, т. е. когда четвертая кислородная вершина тетраэдра [SiO4]4- находится по ту сторону от нас и от атома кремния. Атомы магния соединены с соседними тетраэдрами [SiO4]4- через ближайшие к нему ионы кислорода. Такое строение присуще ортосиликатам магния, кальция, железа (II), никеля, кобальта, марганца, цинка и других ме-таллов. 2. Силикаты с изолированными группами — [Si207]6-, [Si309]6-, [Si4О12]8- и [Si6O18]12- — кремнекислородных тетраэдров получаются в том случае, когда два, три или больше простейших тетраэдра-ионов [SiO4]4- соединяются между собой общими ионами кислорода (рис
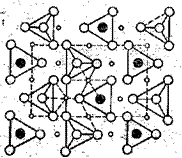
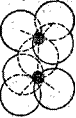

Рис. 2. Структура форстерита: Рис. 3. Условное обозначение иона [Si2O7]6-
ляется остальная часть воды, представленная гидроксильными группами. Этот процесс сопровождается разрушением кристаллической структуры каламина.
Представителем силикатов, состоящих из изолированных кольцевых радикалов [Si3O9]6-, [Si6018]12- и др., соединенных между собой и металлическими катионами, может служить минерал берилл Be3Ala[Si6018].
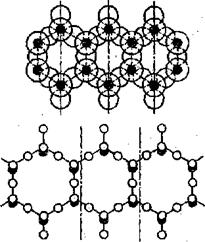 3. Силикаты с непрерывными цепочечными радикалами [Si206l6- и ленточными радикалами [Si4O11]6-, а также радикалом [Si6017]10- представляют собой следующую группу силикатов. По цепочечной структуре кремнекислородные тетраэдры соединяются между собой в бесконечные цепочки при помощи общих атомов кислорода, принадлежащих одновременно двум смежным тетраэдрам (рис.6). При этом у каждого кремнекислородного тетраэдра [SiO4]4- два атома свободны, два других атома общие с соседними кремнекислородными тетраэдрами. Цепочечный радикал [Sl206]4- находится между
3. Силикаты с непрерывными цепочечными радикалами [Si206l6- и ленточными радикалами [Si4O11]6-, а также радикалом [Si6017]10- представляют собой следующую группу силикатов. По цепочечной структуре кремнекислородные тетраэдры соединяются между собой в бесконечные цепочки при помощи общих атомов кислорода, принадлежащих одновременно двум смежным тетраэдрам (рис.6). При этом у каждого кремнекислородного тетраэдра [SiO4]4- два атома свободны, два других атома общие с соседними кремнекислородными тетраэдрами. Цепочечный радикал [Sl206]4- находится между
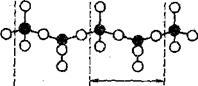
Рис. 6. Условное обозначение. Условное обозначение строения ленточной структуры радикала [S4O11]6-
строения, цепочечной структуры
радикала [Si2O6]4-
штриховыми линиями (рис. 6). Примером силикатов с одинарными анионными цепочками служат минералы — диопсид CaMg[Si2O6], геденбергит CaFe[Si2Oe], жадеит NaAI[Si2O6] и др,
4. Если две цепочки расположены параллельно друг другу в одной плоскости так, что одна из них представляет собой зеркальное отражение второй и обе они соединены между собой общими третьими в тетраэдрах атомами кислорода, то получается ленточная структура, состоящая из двух спаренных между собой цепочек кремнекислородных тетраэдров. Радикал такой структуры (рис. 7) содержит четыре атома кремния и одиннадцать атомов кислорода. Формула этого радикала записывается в виде [Si4O11]6-. Из природных силикатов такой структурой обладают, амфиболы, например антофиллит Mg7[Si4O11], термолит Ca2Mg5[Si4O11]2[OH]2 и др.
Подобная структура присуща силикатам с анионными лентами [Si6O17]10-. К минералам с такой структурой относится волластонит Ca6[Si6O17]О.
5. Более сложной структурой считают листовую, состоящую теоретически из сочетания бесконечно большого количества тетраэдров, соединенных друг с другом тремя общими атомами кислорода (рис. 8). Такое сочетание кремнекислородных тетраэдров
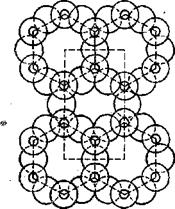
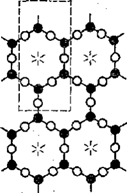
Рис. 8. Листовая структура радикала [S4O10]4-
образует плоский лист. В этой структуре четвертые атомы кислорода каждого из кремнекислородных тетраэдров валентны и могут располагаться либо по одну сторону листа, либо поочередно по обе стороны его. В первом случае они образуют химически активный слой всего листа, во втором два активных слоя, при помощи которых лист в целом может присоединять к себе различные катионы. Химическая формула силикатов листовой структуры выражается радикалом [Si2O5]2-∞. В природе к листовой структуре силикатов относят слюдообразиые минералы. Слоистое строение этих минералов обусловливает способность расщепления их на тонкие листочки. К этой группе минералов относится тальк Mg3tSi4










 Водородные соединения кремния принято называть гидридами кремния, или силанами. Подобно насыщенным углеводородам гидриды кремния образуют гомологический ряд, в котором атомы кремния соединены между собой одинарной связью
Водородные соединения кремния принято называть гидридами кремния, или силанами. Подобно насыщенным углеводородам гидриды кремния образуют гомологический ряд, в котором атомы кремния соединены между собой одинарной связью

 Si + 2C12 =SiС14
Si + 2C12 =SiС14 SiO2 + 2С + 2Br2 = 2CO + SiBr4
SiO2 + 2С + 2Br2 = 2CO + SiBr4 SiO2 + 4HF = 2H2O + SiF4
SiO2 + 4HF = 2H2O + SiF4


 3. Силикаты с непрерывными цепочечными радикалами [Si206l6- и ленточными радикалами [Si4O11]6-, а также радикалом [Si6017]10- представляют собой следующую группу силикатов. По цепочечной структуре кремнекислородные тетраэдры соединяются между собой в бесконечные цепочки при помощи общих атомов кислорода, принадлежащих одновременно двум смежным тетраэдрам (рис.6). При этом у каждого кремнекислородного тетраэдра [SiO4]4- два атома свободны, два других атома общие с соседними кремнекислородными тетраэдрами. Цепочечный радикал [Sl206]4- находится между
3. Силикаты с непрерывными цепочечными радикалами [Si206l6- и ленточными радикалами [Si4O11]6-, а также радикалом [Si6017]10- представляют собой следующую группу силикатов. По цепочечной структуре кремнекислородные тетраэдры соединяются между собой в бесконечные цепочки при помощи общих атомов кислорода, принадлежащих одновременно двум смежным тетраэдрам (рис.6). При этом у каждого кремнекислородного тетраэдра [SiO4]4- два атома свободны, два других атома общие с соседними кремнекислородными тетраэдрами. Цепочечный радикал [Sl206]4- находится между





