

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Химическая связь в молекулах объясняется только электрическим притяжением и отталкиванием.
Ниже нами будут объяснены постоянная направленность электрических сил в атоме, которая и приводит к образованию молекул определённой формы. А уже форма молекул, и как следствие, расположение вокруг молекулы бионов, и является причиной различных химических свойств веществ и соединений. Заметим, что именно одинаковость форм является причиной повторяемости свойств атомов, расположенных в разных периодах, но принадлежащих одинаковым группам в периодической системе Меделеева.
Здесь мы ещё раз отметим принципиальную разницу в подходе общей теории взаимодействий к строению атомов и молекул и взглядах, описаных в учебниках. Мы рассматриваем атом или молекулу как единое целое, в отличии от квантового подхода в котором, ядро само по себе, а электроны сами по себе. Чтобы вам была понятна разница посмотрите анимацию.
Слева атом с точки зрения общей теории взаимодействий, справа в классическом представлении (если такой образ можно использовать). Химическая связь основанная на электрическом притяжении является стабильной, в противовес связи основанной на "... мгновенных флуктуациях".
Виды химической связи
В молекулах, есть два вида химической связи, но в обоих случаях для связи необходимы вакансии в электронных оболочках реагентов, а также постоянство формы атомов. При проведении химической реакции нам просто надо создать условия для притяжения отрицательных областей одного атома с положительными областями другого. Вакансия является носителем положительного заряда, а электрон отрицательного. Когда электрон одного атома заполняет вакансию в другом атоме, возникает первый вид химической связи (пример на рисунке).
|
|

Розовым обозначена область молекулы с частично положительным зарядом, представляющая собой электронную оболочку натрия, лишённую одного электрона + ядро атома натрия.
Этот вид химической связи, так называемая ионная связь.

Это второй вид химической связи – ковалентная.
Во втором случае, вакантные области двух атомов кислорода взаимно поглощаются. При этом конечно вакантную область занимают электроны второго атома. Я хочу, чтобы вы уяснили принципиальное отличие одного вида химической связи, от другого. А именно.
В первом случае, на поверхности образующейся молекулы остаётся определённая область с частично положительным зарядом (внутренние электронные оболочки и ядро одного из атомов составляющих молекулу, не полностью погружены в общий электронный поверхностный слой). В случае с водородом, это является причиной возникновения водородных связей. В остальных случаях именно это оказывается причиной объединения отдельных молекул в общее целое (в кристалл). Причём вид кристаллической решётки как раз и обусловлен расположением (направлением от центра молекулы) вакантных областей и областей занятых электронами. При разной температуре (энергии молекулы) распределение таких областей может меняться (как в случае с серой или фосфором).
Во втором случае, молекулу целиком покрывает электронный слой. Так как, в таком виде химической связи, от каждого атома участвует и вакансия и электрон. Такие вещества, чаще всего оказываются газами, или являются довольно инертными (примеры смотрите далее). Заметьте, что нам теперь не понадобятся Вандерваальсовы силы (основанные, якобы, на мгновенных флюктуациях электронной плотности атомов). Каким образом устроен атом водорода, мы описали ранее. Да и устройство химических элементов первых трёх периодов не должно вызвать дополнительных вопросов.
Отметим ещё раз основные положения строения атомов химических элементов в общей теории взаимодействий. Электроны не вращаются вокруг ядра, а концентрично занимают области пространства вокруг него. Кратность восьми законченных электронных оболочек атомов объясняется подчинением принципу непрерывности, который в данном случае означает следующее. Электронная область принимает такую форму, чтобы заполнять как можно меньший объём пространства. А сами электроны, по возможности более равномерно распределяются в нём. На начальном этапе, то есть, при небольшом количестве электронов, такому требованию удовлетворяет сферическая область, поделённая именно на 8 частей.
Приведём ещё раз рисунок.

|
|
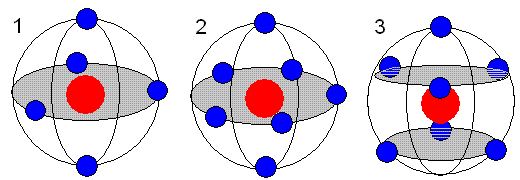
Проще говоря, первый электрон займёт любую ячейку (для примера №1). Второй в таком случае расположится в ячейке №7. При наличие трёх электронов они с наибольшей вероятностью составят фигуру в виде равностороннего треугольника (границы ячеек условны). Когда вокруг ядра находятся четыре электрона, конфигурация их расположения (при минимальной энергии) будет тетраэдрической. При шести электронах в атоме, они займут места в вершинах октаэдра. Случаи для 5 и 7 электронов показаны на рисунке.
На рисунке показаны электронные оболочки атомов с 5 или 7 атомами на внешнем радиусе. Расположение электронов в углах равнобедренных треугольников (рис. 1 и 3) или в вершинах правильного пятиугольника (рис. 2)
Объяснением амфотерных свойств химических элементов будет являться то, что атом проявляет свои свойства по разному, в зависимости от того с чем он взаимодействует, то есть использует ли он для связи пики или вакансии.
Картина для атомов длинных периодов усложняется лишь тем, что количество ячеек, а, следовательно, и возможных пиков, возрастает до двадцати.
Химическая связь в металлах
Нарисуем схематично два атома металлов.


Чёрными стрелками обозначены места вакансий, которых у металлов достаточно много. Синими – возможное соединение металлов (для примера взяты два разных металла) при образовании сплава. То есть электроны занимают вакантные места в другом атоме.
Такова в общих чертах новая теория химической связи, не основанная на квантовых представлениях, но использующая, например, Льюисовы структуры.
Рисунки сложных молекул приведены ниже.
|
|

Глядя на рисунок, становится ясным, почему серная кислота при замещении атомов водорода другими ионами, сохраняет в остальном свою целостность. Здесь особая роль оказывается у вакантной (В-В) связи между атомами кислорода. Сила этой кислоты также может быть объяснена. Видим, что на атоме серы верхний электронный слой отдан в вакантные области других атомов. Вернитесь немного назад и посмотрите ещё раз график. Так как масса атома водорода мала, то потенциальная яма будет не глубокой, и видимо в этом причина того, что водород достаточно легко замещается другими атомами. Думаю, что весь ряд электрического напряжения можно объяснить используя этот подход и, конечно, учитывая влияние электронов в атомах реагентов (их отталкивание с электронами молекулы серной кислоты). Ещё раз приведём этот рисунок, с той лишь целью, чтобы показать причины объединения двух и более молекул серной кислоты в жидкость.
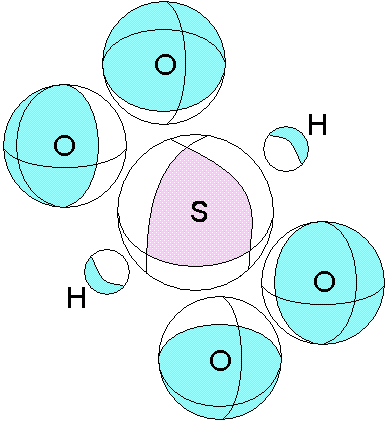 Розовым показана область с частично положительным зарядом (атом серы без 6 электронов). Голубым показаны областис частично отрицательным зарядом. Такие области двух разных молекул взаимодействуют, что и приводит к образованию вещества. Расположение этих областей и распределение (величина) заряда в них ответственны за агрегатное состояние образующегося вещества, в данном случае жидкое. Если бы сила положительной области была меньше, то образовывался бы газ. В том случае когда обе области, и положительная и отрицательная имеют значительную величину, и распределены более неравномерно, образуются твердые вещества.
Розовым показана область с частично положительным зарядом (атом серы без 6 электронов). Голубым показаны областис частично отрицательным зарядом. Такие области двух разных молекул взаимодействуют, что и приводит к образованию вещества. Расположение этих областей и распределение (величина) заряда в них ответственны за агрегатное состояние образующегося вещества, в данном случае жидкое. Если бы сила положительной области была меньше, то образовывался бы газ. В том случае когда обе области, и положительная и отрицательная имеют значительную величину, и распределены более неравномерно, образуются твердые вещества.
Такой углеводород как метан.

Вернёмся к одной из самых, как кажется, простых молекул. Вода, в нашей интерпретации, будет выглядеть следующим образом. 
Молекула воды. Нарисунке показаны три варианта химических связей атомов водорода с атомом кислорода.
Рисунок объясняет разнообразие свойств воды, в том числе энергоинформационные.
В первом случае обе связи вакантные. Во втором пиковые. В третьем случае, одна связь вакантная, другая пиковая. С учётом возможного соединения этих трёх видов молекул воды между собой, можно объяснить такие необычные свойства жидкости жизни. Может возникнуть обманчивое впечатление, что притягиваются между собой две вакантные области. Это конечно не так. Имеющиеся в атоме электроны занимают вакантную область второго атома, а его электроны оказываются в вакантной области первого атома. Приведённые нами обозначения используются для простоты изложения, но никогда нельзя забывать об их схематичности.
|
|
Легко понять, что вакантная связь будет являться более прочной по сравнению с вакантно-пиковой, так как она, по сути, состоит из двух вакантно- пиковых.
Какие надо выдумать гибридизации и многоцентровости связей, чтобы объяснить такое разнообразие свойств воды? В нашем случае, думаю, многое понятно из рассмотрения рисунка.
Чтобы с помощью формул показать молекулы веществ, пришлось ввести новые обозначения, для вакансий. Для пиков мы оставили старое обозначение, используемое ранее для электронов. Например, азотная кислота, с использованием новой номенклатуры будет выглядеть так.

И здесь, как и в случае с серной кислотой, легче всего замещается атом водорода. Остальные связи, то есть в комплексе, оказываются значительно сильнее.
Думаю, что ненужность гибридизации орбиталей мы уже показали. Теперь развенчаем миф о многоцентровости связей.
Атом бора. Гидриды бора.
Сделаем мы это на примере соединений бора, а именно, его гидридов. Бор имеет три пика и пять вакансий. Молекулы диборана и тетраборана - 10 будет выглядеть следующим образом.

Мало того, что размещение электронов вокруг ядра даёт нам возможность понять число возможных присоединённых атомов. Оно ещё и позволяет установить во многих случаях геометрическое расположение атомов в молекуле. Связи между атомами бора вакантные, а между атомами бора и водорода, вакантно-пиковые.
Легко можно показать и строение других гидридов бора, причем, не используя для этого многоцентровые связи. Направления связей, также хорошо согласуются с принятой нами основой в виде пространственных каркасов, имеющих форму правильных многогранников.
Строение молекулы бензола

Может быть, вы считаете, что выдумывание новых обозначений является излишним усложнением. Тогда пример с бензолом, приведённый выше должен был вас переубедить.
Ещё лучше преимущества новой системы обозначений проявляются при рассмотрении координационных соединений. Такие соединения ранее показывались с помощью эмпирических формул, из которых нельзя понять, как в молекуле соединены между собой атомы. Причём с помощью валентностей объяснить различные комплексы не удаётся.
Тайна крещенской воды
Многие из Вас знают, хотя много и тех кто сомневаются в этом, что вода набранная из природных источников в день Крещения (19 января) обладает рядом замечательных свойств.
Например, она может простоять, не испортившись очень долго. Помимо, так сказать химических способов сделать эту воду устойчивой к процессу протухания, таких как внесение в неё небольшого количества ионов серебра (священнослужители при обряде освящения держат некоторое время в воде серебряные кресты), есть на мой взгляд и другая, если так можно выразиться информационная причина такого аномального поведения святой воды взятой на крещение.
Обратите внимание, что праздник крещения приходится на самый пик зимних морозов, что, конечно же, тоже значительно сокращает количество вредных микроорганизмов в воде. Однако и это, на мой взгляд, не самое главное.
Основным моментом, оказывающим воздействие на свойства воды, является воздействие мыслей человека.
Выше, в этой главе, мы описали три различных варианта молекулы воды. Так вот, под воздействием мыслей человека, структура воды, то есть расположение различных видов её молекул, принимает вид очень близкий к структуре, существующей у воды в её кристаллическом состоянии, то есть близкой к структуре льда. Связь в молекуле может и не меняться, изменяется расположение молекул относительно друг друга.
Это и является объяснением такой продолжительной способности воды сохранять свою свежесть. Мы ведь не удивляемся, что лёд может годами существовать в Антарктиде, или месяцами в нашем холодильнике, и при этом не протухать.
Напомню, что организм человека на две трети состоит из воды. Следовательно, если вы употребили внутрь или облились Крещенской водой, то вода составляющая ваш организм начинает "воспринимать" структуру вновь употреблённой воды, и перестраивать свою структуру подобно ей.
Но как мы помним, структура Крещенской воды близка структуре льда, и, следовательно, в ней болезнетворные бактерии и вирусы чувствуют себя не комфортно. Они стараются покинуть организм, а это оказывает на него положительное воздействие.
Многие, конечно, слышали о наговорах на воду. Я думаю, что механизм их действия точно такой же. При наговоре воздействие может быть не только положительным, но, к сожалению, и отрицательным.
Подробности информационного воздействия мыслей на вещество можно посмотреть на странице
|
|
Имическая связь
Химическая связь взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей, образуемых данным атомом с соседними атомами [см. также Валентность ]. Э. Франкленд в 1852 предложил концепцию, согласно которой каждый элемент образует соединения, связываясь с определённым числом эквивалентов др. элементов, при этом один эквивалент соответствует количеству, требуемому одной валентностью. Ф. А. Кекуле и А. В. Г. Кольбе в 1857 в соответствии с представлениями валентности выдвинули положение, что углерод обычно имеет валентность 4, образует 4 связи с др. атомами. А. С. Купер в 1858 указал, что атомы углерода, связываясь между собой, могут образовывать цепочки. В его записи химические формулы имели очень большое сходство с современными, связи изображались чёрточками, соответствующими валентным связям между атомами. Термин "химическое строение" впервые ввёл А. М. Бутлеров в 1861. Он подчёркивал, сколь существенно выражать строение единой формулой, показывающей, как в молекуле соединения каждый атом связан с др. атомами. Согласно Бутлерову, все свойства соединения предопределяются его молекулярным строением; он высказал уверенность, что точную структурную формулу можно установить по результатам изучения путей синтеза данного соединения. Следующий шаг, заключавшийся в приписывании молекулам пространственной трёхмерной структуры, был сделан в 1874 Я. Х. Вант-Гоффом и Ж. А. Ле Белем.
В 19 в. валентная связь изображалась чёрточкой между символами двух химических элементов. Природа этой связи была совершенно неизвестна. После открытия электрона делались многочисленные попытки развить электронную теорию Х. с. Наиболее успешными были работы Г. Н. Льюиса, который в 1916 предложил рассматривать образование Х. с., называемой теперь ковалентной связью, как результат того, что пара электронов становится общей для двух атомов. Разработка квантовой механики (1925) и использование многих экспериментальных методов (молекулярной спектроскопии, рентгенографии кристаллов, газовой электронографии, методов изучения магнитных свойств) для определения длин связей (межатомных расстояний), углов между связями, числа неспаренных электронов и других структурных параметров молекул и кристаллов привели к более глубокому пониманию природы Х. с.
Электронная структура атомов. Электронам в атоме приписываются различные орбитали, которые характеризуются главным квантовым числом n, орбитальным квантовым числом l и магнитным квантовым числом ml (см. Квантовые числа, Квантовая химия). Имеется одна наиболее устойчивая орбиталь с n = 1, образующая К -оболочку. L -Оболочка с n = 2 включает одну орбиталь с l = 0 и ml = 0 и три с l = 1 и ml = -1, 0 и +1. Их называют 1 s -орбиталь, 2 s -орбиталь и три 2 р -орбитали. М -Оболочка состоит из 3 s -орбитали, трёх 3 р -орбиталей и пяти 3 d -орбиталей. Электрон имеет спин со спиновым квантовым числом s = 1/2, который может ориентироваться относительно определённого направления двумя различными путями - с компонентами, даваемыми магнитным спиновым квантовым числом ms, равным + 1/2 или -1/2. В атоме не может быть двух электронов с одинаковыми значениями всех квантовых чисел. Следовательно, 1 s -орбиталь, образующая К -оболочку, может быть занята только одним электроном с положительным или отрицательным спином или же двумя электронами (электронной парой), одним - с положительным спином, другим - с отрицательным.
Заполнение определённых оболочек и подоболочек приводит к особой устойчивости атомов, наблюдающейся у атомов инертных газов. В этих устойчивых структурах электронная конфигурация заполненной оболочки гелия 1 s2, неона 2 s2 2 p6, аргона 3 s2 3 p6, криптона 3 d10 4 s2 4 p6, ксенона 4 d10 5 s2 5 p6, радона 4 f14 5 d10 6 s2 6 p6, эка-радона 5 f14 6 d10 7 s2 7 p6. [О заполнении электронных оболочек см. также Атом, Периодическая система элементов.]
Ковалентная связь. В 1927 датский физик О. Бурро выполнил квантовомеханический расчёт молекулярного нона водорода и показал, что единственный электрон в этом ионе На занимает орбиталь, называемую молекулярной орбиталью, которая простирается вокруг обоих протонов. Теоретический расчёт энергии связи этого молекулярного иона, т. е. разности между суммарной энергией отдельного атома и протона и энергией иона в его основном состоянии, привёл к значению 255 кдж × моль-1, прекрасно согласующемуся с экспериментом. Вскоре было отмечено, что электронную структуру молекулярного иона водорода можно рассмотреть, используя волновую функцию основного состояния атома водорода. По мере сближения атома водорода и протона появляется возможность выхода электрона из области, окружающей одно ядро, в область, окружающую второе ядро, причём в каждом случае электрон занимает 1 s -орбиталь. Молекулярная орбиталь, образованная как сумма этих двух 1 s -орбиталей, является хорошим приближением к молекулярной орбитали, полученной Бурро путём решения волнового уравнения Шрёдингера. Если образовать волновую функцию как разность двух 1 s -орбиталей, то это, как было показано, отвечает не притяжению, а отталкиванию. Первая волновая функция является симметричной линейной комбинацией двух 1 s -функций и отвечает устойчивому состоянию, образованию одноэлектронной ковалентной связи, тогда как вторая функция, являющаяся антисимметричной линейной комбинацией тех же 1 s -функций, отвечает неустойчивому состоянию. Иногда говорят, что образование одноэлектронной ковалентной связи в молекуле водорода соответствует резонансу данного электрона между двумя атомными орбиталями или между двумя атомами водорода.
В том же году (1927) было выполнено два квантовомеханических расчёта Х. с. в молекуле водорода. Американский физик Э. У. Кондон использовал метод молекулярных орбиталей, приписав молекуле водорода структуру, в которой за основу была принята орбиталь H2+, рассчитанная Бурро, причём к этой орбитали были отнесены оба электрона с противоположными спинами. Немецкие физики В. Гейтлер и Ф. Лондон отнесли один электрон, с положительным спином, к 1 s -орбитали одного атома водорода, а второй, с отрицательным спином, к 1 s -орбитали др. атома водорода. Волновая функция для данной молекулы была суммой этой функции и функции, в которой два электрона менялись местами - электрон с положительным спином относился ко второму атому, а с отрицательным - к первому атому. Оба расчёта, как Кондона, так и Гейтлера и Лондона, привели к выводу об устойчивости молекулы водорода с энергией связи, превышающей приблизительно в 1,7 раза энергию связи в молекулярном ионе водорода. Связь между двумя атомами водорода в молекуле водорода - прототип связи с поделенной электронной парой по Льюису, обычно называют ковалентной связью.
На основании формальных результатов квантовомеханического рассмотрения Х. с. можно сделать следующий простой вывод: атомы могут образовывать ковалентную связь (осуществляемую парой электронов) за счёт каждой стабильной орбитали, занятой первоначально одним электроном; при этом образуется связь такого типа, как описанная выше для молекулы водорода, а её стабильность может быть связана с тем же самым явлением резонанса. Иными словами, для образования ковалентной связи необходимо наличие двух электронов с противоположными спинами и по одной стабильной орбитали у каждого из двух связываемых атомов.
Атом водорода с единственной стабильной орбиталью (1 s) может образовывать лишь одну ковалентную связь. Атом углерода и другие атомы второго периода (бор, азот, кислород) могут образовывать не более четырёх ковалентных связей с использованием четырёх орбиталей L -оболочки. Квантовомеханическое рассмотрение приводит также к выводу, что каждая дополнительная связь, образующаяся в молекуле, в общем случае ведёт к дальнейшей стабилизации молекулы, а следовательно, наиболее устойчивы такие электронные структуры молекулы, в которых все стабильные орбитали атомов либо использованы для образования связей, либо заполнены неподелёнными парами электронов.
Метану CH4, например, приписывается следующая структура валентных связей:
?
Чёрточки означают поделенные электронные пары. Можно сказать, что поделенная электронная пара занимает 1 s -орбиталь каждого атома водорода и одну из четырёх орбиталей L -оболочки атома углерода. Атомы водорода, т. о., комплектуют завершенную К -оболочку (как в атоме гелия), а атом углерода, который также имеет неподелённую пару 1 s -электронов, комплектует завершенную L -оболочку (как в атоме неона).
Представление о гибридных орбиталях, формирующих связи, даёт решение проблемы, волновавшей химиков и физиков в ранний период квантовой теории. Четыре орбитали L -оболочки делятся на два вида - 2 s -орбиталь и три 2 р -орбитали, а четыре связи атома углерода, как показывают химические свойства соединений углерода, оказываются одинаковыми. В действительности вместо 2 s -орбитали и трёх 2 р -орбиталей может образовываться набор эквивалентных sp3 -гибридных орбиталей, называется тетраэдрическими орбиталями; они направлены к вершинам правильного тетраэдра и обладают большей силой связи, чем s -орбиталь или р -орбиталь (Л. Полинг,1931).
Для молекулы воды H2O можно записать следующую валентную структуру:
Атом кислорода окружен двумя неподелёнными парами электронов и двумя поделенными парами. 2 s -Орбиталь несколько более стабильна, нежели 2 р -орбитали, так что неподелённые электронные пары прежде всего заполняют 2 s -орбиталь. Если бы две связи в молекуле воды были образованы р -орбиталями атома кислорода, то угол между связями был бы равен 90?, поскольку при угле 90? друг относительно друга р -орбитали имеют максимальную силу связи. Расчёты показывают, что максимальная устойчивость достигается в том случае, когда орбитали, образующие связи в молекуле воды, в небольшой мере имеют также s -характер, соответственно валентный угол между связями несколько больший, чем 90?. Экспериментальное значение валентного угла в молекуле H2O 104,5?, а валентные углы в гидридах H2S, H2Se и H2Te равны 92, 91 и 90? соответственно.
Двойная ковалентная связь между атомами углерода имеется в этилене C2H4, а тройная связь - в ацетилене C2H2. Валентные структуры для этих молекул следующие:
В образовании двойной связи участвуют две поделенные электронные пары, а в образовании тройной связи - три пары. В каждой из этих структур атом углерода приобретает электронную конфигурацию неона, будучи окружен четырьмя поделенными парами электронов. Можно сказать, что атом углерода образует четыре одинарные (ординарные, простые) связи, направленные к вершинам тетраэдра. В двойной и тройной связях имеются две или три изогнутые связи. Интересно, что в этих случаях расстояния между атомами углерода равны соответственно 133 пм и 120 пм, что с точностью до 1 пм совпадает со значениями, соответствующими изогнутым связям при нормальной длине одинарной связи 154 пм в молекуле этана. Такое соответствие подтверждает правильность представления, что двойная и тройная связи могут быть описаны моделью изогнутых связей.
Энергия двойной углерод-углеродной связи на 73 кдж × моль-1 меньше, чем сумма энергий двух одинарных связей, энергия же тройной связи на 220 кдж × моль-1 меньше суммы энергий трёх одинарных связей. Эти различия в устойчивости могут быть связаны с напряжённостью изогнутых связей. Энергия напряжения благоприятствует превращению кратных связей в одинарные, и именно поэтому вещества с кратными связями легко присоединяют водород; такие вещества принято называть ненасыщенными, а соответствующие соединения, имеющие только одинарные связи, например этан, называются насыщенными.
Резонанс и структура бензола. Правила построения валентных структур на основании представлений о поделенных парах электронов и использования устойчивой орбитали каждого из двух атомов, между которыми образуется ковалентная связь, позволяют написать структурные формулы для очень большого числа веществ, однако для некоторых веществ одна валентная структура не даёт вполне адекватного представления о свойствах. Веществом именно такого рода является, например, озон O3. Спектроскопические исследования озона показали, что атомы в его молекуле расположены под углом 117? (угол между связями у центрального атома кислорода), а каждая из двух связей кислород - кислород имеет длину 128 пм. Есть все основания приписать молекуле озона следующую валентную структуру:
Эта структура представляется удовлетворительной, поскольку каждый из атомов кислорода окружен четырьмя парами электронов, причём некоторые пары поделенные, а некоторые неподелённые. Однако если приписать формальные заряды атомам, разделив поделенные пары электронов поровну между двумя атомами, то центральный атом будет иметь положительный заряд, а атом, связанный с ним одинарной связью, - отрицательный. Такую электронную структуру нельзя считать вполне удовлетворительной, поскольку межатомное расстояние, отвечающее двойной связи, должно быть приблизительно на 21 пм меньше, чем расстояние для одинарной связи, тогда как согласно наблюдениям эти расстояния равны. Такое расхождение можно объяснить, приняв и вторую валентную структуру для данной молекулы:
Приведённые структуры эквивалентны. При квантовомеханическом рассмотрении молекулы озона ей приписывается волновая функция, которая представляет собой сумму волновых функций для этих двух валентных структур. Установлено, что подобная волновая функция отвечает среднему значению длины связи, одному и тому же для обеих связей, и, кроме того, эта волновая функция соответствует большей стабильности, нежели каждая из волновых функций отдельных валентных структур. Такая дополнительная стабилизация описывается как энергия резонанса, соответствующая резонансу молекулы между двумя структурами. Отсюда следует, что озон нельзя удовлетворительно описать одной валентной структурой обычного типа, тогда как комбинация двух валентных структур приводит к удовлетворительному описанию молекулы в её основном состоянии.
Этот факт не противоречит основному принципу, выдвинутому в 1861 Бутлеровым, - каждое вещество имеет определённое молекулярное строение, которое обусловливает свойства данного вещества (см. Химического строения теория, Электронные теории в органической химии). Молекула озона в её основном состоянии имеет определённое единственное строение. Оно может быть представлено одной формулой:
Стрелки в этой формуле показывают, что двойная связь и одинарная связь могут меняться местами. Структура с двойной связью в одном положении и одинарной связью в другом не представляет какого-либо состояния молекулы озона, однако две резонирующие валентные структуры вместе взятые или структурная формула, в которой символически показано, что двойная и одинарная связи меняются местами, дают приемлемое представление о действительном единственном строении молекулы озона в основном состоянии.
Аналогичная ситуация наблюдается при рассмотрении молекулы бензола, строение которой казалось химикам загадочным до разработки (1928-33) теории резонанса (называемая также мезомерией). Кекуле указывал, что четырёхвалентность углерода в бензоле можно показать с помощью структурной формулы с чередующимися простыми и двойными связями. Однако таких структур может быть две:
Были предприняты попытки обнаружить изомеры таких веществ, как о -дихлорбензол (атомы хлора присоединены к атомам углерода, связанным двойной связью в случае первого изомера и одинарной связью в случае второго). Однако обнаружить такие изомеры не удалось, и было признано, что все шесть углерод-углеродных связей в бензольном кольце эквивалентны друг другу. Детальное квантовомеханическое рассмотрение бензола показало. что его молекула имеет гексагональную симметрию и что все шесть углерод-углеродных связей эквивалентны. Этот факт позволяет сказать, что основное состояние молекулы бензола может быть представлено двумя структурами Кекуле, налагающимися одна на другую или резонирующими между собой. В соответствии с квантовомеханическими расчётами реальная молекула бензола должна быть приблизительно на 150 кдж × моль-1 устойчивее, нежели гипотетическая молекула, описываемая лишь одной структурой Кекуле. Эта дополнительная устойчивость обусловливает повышенную сопротивляемость бензола гидрогенизации по сравнению с обычными ненасыщенными соединениями.
Молекула бензола в её основном состоянии может быть представлена единственной формулой, такой, как:.? Кружок, проведённый внутри шестиугольника, означает, что данная структура описывает реальную молекулу, то есть отвечает большей устойчивости по сравнению со структурой Кекуле, и отражает эквивалентность всех шести углерод-углеродных связей. И всё же предпочтительнее бензол изображать двумя структурами Кекуле с оговоркой, что действительная структура молекулы соответствует резонансу между этими двумя структурами. Зная свойства, присущие одинарным связям и двойным связям, можно предсказать свойства, отвечающие структуре Кекуле и суперпозиции двух структур Кекуле. Длина одинарной углерод-углеродной связи 154 пм, а двойной связи - 133 пм. Для суперпозиции двух структур Кекуле ожидается среднее значение, более близкое, вследствие резонансной стабилизации, к значению для двойной связи. Наблюдаемое значение 140 пм согласуется с расчётным. Кроме того, если принять тетраэдрическую структуру каждого углеродного атома с деформированными (изогнутыми) двойными связями (общее ребро двух тетраэдров), можно предсказать, что молекула бензола должна быть плоской с атомами углерода в углах правильного шестиугольника и атомами водорода в углах большего правильного шестиугольника, лежащего в той же плоскости. Эти предсказания подтверждены опытными данными.
Ионная связь. Расплавленный хлорид натрия - хороший проводник электричества. Эту расплавленную соль можно считать состоящей из положительных ионов натрия Na+ и отрицательных ионов хлора Cl- в достаточно компактном состоянии, при котором в условиях термического равновесия каждый ион обладает возможностью медленно перемещаться. Под действием приложенного электрического поля ионы натрия передвигаются в направлении отрицательного электрода, а ионы хлора - в направлении положительного электрода, обусловливая проводимость электрического тока.
Ион натрия Na+ - это атом натрия, потерявший один электрон и приобретший устойчивую электронную конфигурацию неона, а ион хлора Cl- - атом хлора, присоединивший один электрон и приобретший устойчивую электронную конфигурацию аргона. Формула хлорида натрия NaCI определяется стабильностью этих ионов и условием электронейтральности данного вещества. Металлы первой группы периодической системы элементов Менделеева образуют однозарядные ионы и, как принято говорить, имеют ионную валентность +1; металлы второй группы образуют двухзарядные ионы и имеют ионную валентность +2, и т.д. Аналогично галогены, элементы седьмой группы, присоединяют электрон и образуют однозарядные отрицательные ионы, т. е. имеют ионную валентность -1; кислород и его аналоги могут присоединять два электрона с образованием двухзарядных отрицательных ионов со структурой инертных газов и обладают ионной валентностью -2, и т.д. Состав солей определяется ионными валентностями их катионов и анионов при соблюдении условия электронейтральности образующегося соединения.
Кулоновские силы, действующие между ионами, например Na+ и Cl-, приводят к тому, что каждый ион притягивает соседние ионы противоположного знака и создаёт из них окружение. В случае хлорида натрия это приводит к устойчивому упорядоченному расположению, отвечающему кристаллической структуре, при которой каждый ион имеет шесть ближайших соседей противоположного знака и двенадцать соседей того же знака, находящихся на расстоянии в 21/2 раза большем. Общая кулоновская энергия для такого расположения находится суммированием по парам ионов, и она равна -1,7476 e2/R для пары ионов Na+CI-, где R - расстояние между центрами ионов ближайших соседей, е - заряд иона. Следовательно, кристалл стабилизирован кулоновским притяжением, энергия такой системы на 75% превышает энергию системы положительных и отрицательных зарядов, находящихся на тех же расстояниях R друг от друга. Кулоновская энергия кристалла NaCI большая - она составляет около 860 кдж × моль-1, с учётом сродства хлора к электрону затраты такой энергии более чем достаточно для сублимации металлического натрия, ионизации его атомов и диссоциации молекул хлора на атомы, а остальная энергия (410 кдж × моль-1) соответствует энергии образования хлорида натрия из элементов.
Силы притяжения ионов противоположного заряда называются силами ионной валентности. Можно сказать, что в кристалле хлорида натрия, в котором ион натрия имеет координационное число шесть (то есть он окружен шестью ближайшими соседями), общая ионная валентность иона натрия +1 разделяется между соседями, при этом каждую из шести связей между натрием и прилегающим хлором можно рассматривать как ионную связь силой 1/6. Отрицательный заряд иона хлора удовлетворяет шесть ионных связей, каждая силой 1/6, от шести соседних ионов натрия. Согласно правилу валентности, весьма существенному в неорганической химии, сумма и
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!