1. Давление  , здесь dFn – элемента силы давления, действующая перепендикулярно площади. Площадь dS.
, здесь dFn – элемента силы давления, действующая перепендикулярно площади. Площадь dS.

С точки зрения МКТ – давление есть результат взаимодействия атомов и молекулов со стороны сосуда.
2. Температура – в наших ощущениях Т воспринимается, как мера нагретости тела, есть привести в соприкосновении более наргетое тело с менее награтым телам, то через некоторое время их нагретости станут одинаковыми, при этом мы говорим, что температуры тел выровнялись, при этом мы говорим, что от более наргетого тела к менее нагретому прямо тепло.
С точки зрения МКТ температура мера средней кинетической энергии поступательно двух малекул.
3. Объем – простанство, ограниченное границами, для данноц массы газа, чем обльше объемы, тем больще среднее расстояние между молекулами.
Равновесное состояние – такое состяние изалированное системы, в которой она в конце концов самопроизвольно приходит и остается в этом состоянии бесконечно долго, при этом во всех тогках система Т и р окащываются одиноковыми.

Газ, полностью подчиняющимся этому уравнению называется идеальный газ.
Идеальным называется газ, взаимодействия между молекулами у которого можно пренебречь
Процесс называется равновесными, если от проходит через непрерывную последовательность равновесных состояний.
3 формы записи уравнения состояния идеального газа:



N - число молекул в единицу объема
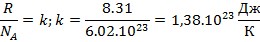

Рассчитаем объем занимаемый газом при натураном условии Т = 273,15К, р = 1,01.105 Па
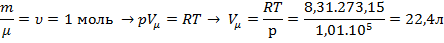
Термодинамический процесс – процесс перехода вещества изодного состояния в дргуое состояние, а возможен за счет сильного воздействия или за счет теплообмена в виде теплоты с окруность средой.
18) Плотность идеального газа.Связь между давлением, концентрацией и
температурой.Изопроцсесы в идеальном газе.
Плотность идеального газа 
Связь между давлением, концентрацией и температурой 
Изопроцессы – такие, в которых один из параметров поддерживается постоянными, а второй параметр является функцией третьего параметры.
1. Изотермический процесс T = const (m=const) 
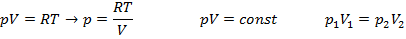
2. Изобаный процесс р = const (m = const) 

3. Изохорный процесс V = const (m=const) 

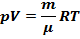
19) Основное уравнение молекулярно - кинетической теории (связь между
давлением и средней кинетической энергией поступательного движения молекул газа). Связь между средней кинетической энергией поступательного движения молекулы и температурой.
Рассмотрим взаимодействия между газом со стенкой сосуды, в которой газ находится.
Основные условия:
1) Газ одноатомный
2) Газ разрежен, поэтому среднее растояние между молекулами высокие, то есть силы взаимодействия между молекулами мало, то можно рассмотрить действия друг с другом.
3) Размеры молекул пренебречь.
4) Рассмотриваем молекулы как упругие, которой обсолютно друга со стенкой сосуды.
Пусть имеем масса одной молекулы mo. Нормаль 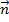
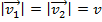


Пусть  : время взаимодействия одной молекулы со стенкой, тогда повторим закон Ньютона
: время взаимодействия одной молекулы со стенкой, тогда повторим закон Ньютона



Рассмотрим действия молекул на стенку площадью S, находящиеся молекулы
Числа ударов молекул от стенки равняестя
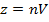
Где n: концентрация молекул в сосуде
V: объем сосуды
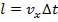
Где: l равняется длину, через который один молекула скоростью проходил за время 

 так как стенки только движуются половину молекул и с коростью vx,
так как стенки только движуются половину молекул и с коростью vx,

Тогда суммарный импульс сил действующих на стенку за время Dt будет равняется.
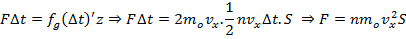
Здезь F: суммарные силы давления, действрующие на стенку за время Dt
Так как скорость  разные между молекулами, то есть должны говорить от среднего квадратного
разные между молекулами, то есть должны говорить от среднего квадратного  .
.


Силы входяющией молекул может оденоковы.
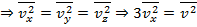
Тогда сила давления: 
По определению 

 Средняя кинетическая энергия одной молекулы
Средняя кинетическая энергия одной молекулы



20) Физический смысл температуры. Средняя квадратичная скорость молекулы газа.
Температура – в наших ощущениях Т воспринимается, как мера нагретости тела, есть привести в соприкосновении более наргетое тело с менее награтым телам, то через некоторое время их нагретости станут одинаковыми, при этом мы говорим, что температуры тел выровнялись, при этом мы говорим, что от более наргетого тела к менее нагретому прямо тепло.
С точки зрения МКТ температура мера средней кинетической энергии поступательно двух малекул.
А вообщее на двух или трех атомный молекулы, скажет что температура есть мера средней кинетичекой энергии поступательного движения одной молекулы.


С редная кинетическая квадратичная скорость называется: 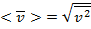


21) Внутренняя энергия идеального газа. Понятие числа степеней свободы молекулы. Теорема о равнораспределении энергии по степеням свободы. Расчет внутренней энергии идеатыюго газа.
Всекая система обладаеют энергией, которой складывается из энергии системы и механической энергии системы и внутренной энергии, которые связаны с внутрением свойства стенки. 
И так 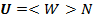
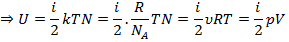

+)Процесс изменения состояния изменяет внутреннюю энергию.
+) Изменение внутренной энергии 
Тогда 
Дифференциальный процесс

Для любой процесса 
Число степеней свободы (i) тела называется минимальным числом независимых переменных, однозначно определяющих положение тела в пространстве (или минимальное число независимых перемещений тела в пространстве)
Теорема Больцмана о равномерном распределении энергии молекул по степеням свободы звучит следующим образом: если система молекул находится в тепловом равновесии при температуре Т, то средняя кинетическая энергия молекул равномерно распределена по степеням свободы, причем на каждую степень свободы приходится жнергия 
22) Теплота. Работа в термодинамике.Первое начало термодинамики. Расчет
величин, входящих в первое начало термодинамики. Применение первого начала термодинамики к изопроцессам в идеальном газе.
Под теплотой и количествами теплоты, понимаем передачу энергии от того телу другому, расчет хаотическое движение максимум, и взаимодействуют друг другу, характеризующему особеность тепломы. Эта передача на молярный уровень.
Теплота подводится или отводится прцесса изменение состояния вещества. Поэтому мы говорим, что теплота функция процесса. Введем движение от энергии функция состояния.
Q – функция процесса
U – функция состояния
DU – изменение внутреннего энергии
DQ – элементальная теплота
dU – безконечно мало изменения внутреннего энергии
Эксперименты установленны, что теплота самопроизвольно передается от теплого к холодному (от большой температуры до меньшой температуры)
Пусть имеем цилиндр с площадью которого S. Пусть под действием с микро подвижностью поршня. Слева от поршня находится газ, который мы можем вводить.
Пусть подействие сила давления действующое на dx, тогда можем говорить из работы сила на перемещение 

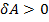 если DV > 0 при этом газ совершил работу
если DV > 0 при этом газ совершил работу
 если DV < 0 при этом внешняя сила совершило работу на газ
если DV < 0 при этом внешняя сила совершило работу на газ
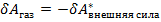
Передача изменения состояния вещества, а изменение внутренней энергии, миожно подводить 2 способ:
1) Либо подводит системе теплоту
2) Либо совершает на систему работы то есть взаимодействием силом

Первый закон термодинамики: Изменение внутренней энергии системы равно сумме работы, совершенной внешними силами над системой, и колическтва теплоты,сообщенного системе.

 : работа внешнего силы
: работа внешнего силы
2 формировка
Обогнячим работу, совершенную системой против внешних сил как 

Первый закон термодинамики: Количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии этой системы и на совершение системой работы над внешними телами.
Q > 0 – подвод тепла
Q < 0 – отвод тепла
Газ расширяется – A > 0
Газ сжимается – A < 0
Температура повышается - 
Температура убывается - 



 , здесь dFn – элемента силы давления, действующая перепендикулярно площади. Площадь dS.
, здесь dFn – элемента силы давления, действующая перепендикулярно площади. Площадь dS.




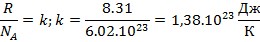

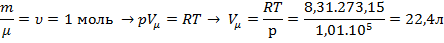



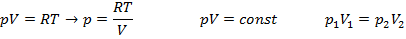


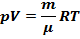
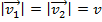


 : время взаимодействия одной молекулы со стенкой, тогда повторим закон Ньютона
: время взаимодействия одной молекулы со стенкой, тогда повторим закон Ньютона


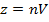
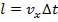


 так как стенки только движуются половину молекул и с коростью vx,
так как стенки только движуются половину молекул и с коростью vx,
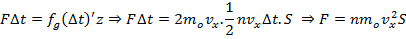
 разные между молекулами, то есть должны говорить от среднего квадратного
разные между молекулами, то есть должны говорить от среднего квадратного 

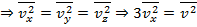



 Средняя кинетическая энергия одной молекулы
Средняя кинетическая энергия одной молекулы




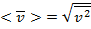



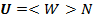
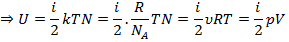








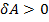 если DV > 0 при этом газ совершил работу
если DV > 0 при этом газ совершил работу если DV < 0 при этом внешняя сила совершило работу на газ
если DV < 0 при этом внешняя сила совершило работу на газ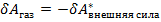

 : работа внешнего силы
: работа внешнего силы






