

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
С.А.Опарина
Малый практикум по дисциплине
Фармакология спорта
Учебно-методическое пособие
Арзамас
| ПРАКТИЧЕСКАЯ РАБОТА №1. Общие реакции на подлинность лекарственных веществ, содержащих катионы и анионы Качество (доброкачественность) лекарственных средств регламентируется Государственной фармакопеей (ГФ), общими фармакопейными статьями (ОФС), фармакопейными статьями (ФС), фармакопейными статьями предприятий (ФСП). Понятие доброкачественности, согласно требованиям ФС, включает три основных блока: подтверждение подлинности, проверка чистоты и проведение количественного анализа. Каждый раздел важен сам по себе, т.к. их выполнение преследует определённые цели и только на основании комплекса всех проведенных исследований можно сделать вывод о качестве лекарственного средства. В фармакопеи разных стран включена ОФС «Общие реакции подлинности». Это связано с тем, что многие лекарственные субстанции содержат одни и те же катионы, анионы или одинаковые функциональные группы в составе органических соединений, проявляющих терапевтическую активность. Общие реакции подлинности могут использоваться для определения идентичных примесей в различных ЛС. | ||||||||||
| Определяемый катион или анион | Условия проведения, Эффект реакции | |||||||||
| I. КАТИОНЫ | ||||||||||
| Аммоний NH4+ | По ГФ X
А. Реакция разложения при нагревании с натрия гидроксидом. Выделяется аммиак, обнаруживаемый по запаху или посинению универсальной индикаторной бумаги
Методика: 1 мл раствора соли аммония (0,002—0,006 г иона аммония) нагревают с 0,5 мл раствора едкого натра:
NH4 Cl + Na OH → NH3↑ + NaCl + H2O
В. Реакция с реактивом Несслера. Образуется осадок красно-бурого цвета.
Методика: 0,01—0,02 г соли аммония растворяют в 1 капле воды, добавляют 1каплю реактива Несслера.

|

| ||||||||
| Алюминий Al3+ | 1. 1. Реакция прокаливания с кобальта нитратом 4 Al3+ + 2Co(NO3)2 → 2Co(AlO2)2 + 4 NO↑ или на фильтровальной бумаге появляется при высушивании синее окрашивание «тинаровая синь» 2. 2. Реакция осаждения натрия гидроксидом или амммиаком Al3+ + 3NaOHэквив → Al(OH)3 ↓ + 3Na+ Белый желатинообразный осадок Al3+ + 3NH4OH → Al(OH)3↓ + 3NH4+ Al(OH)3 + NaOHизбыток → Na[Al(OH)4] Изначально образуется осадок, растворимый в избытке реагента 1. 3.Реакция комплексообразования: - с морином – жёлтое окрашивание, после добавления кислоты уксусной – зелено – желтая флуоресценция; - с ализарином - ярко – красное окрашивание; - с 8 – оксихинолином – белый осадок. | 3. 
| ||||||||
| Барий Ва2+ | Реакция осаждения кислотой серной Ва2+ + H2 SO4 → BaSO4↓ + 2H+ Белый осадок, нерастворимый в воде и минеральных кислотах |  
| ||||||||
| Висмут Bi3+ | По ГФ X А. Реакцияосаждения иона висмута натрия сульфидом. Образуется коричнево-чёрный осадок, который растворяется при добавлении равного объёма концентрированной азотной кислоты Методика: ЛС висмута (около 0,05 г иона висмута) взбалтываю с 3 мл разведенной хлороводородной кислотой и фильтруют. К фильтрату добавляют 1 мл раствора натрия сульфида или сероводород: 2 Bi3+ + 3 S2- → Bi2S3↓ Bi2S3↓ + 8HNO3 → 2 Bi(NO3)3 + 2NO↑ + 3S↓ + 4H2O В. Реакция осаждения калия йодидом с последующим комплексообразованием; образуется черный осадок висмута йодида, растворимый в избытке реактива с образованием раствора желтовато – оранжевого цвета (реактив Драгендорфа K[BiI4 ]). Методика: ЛС висмута (около 0,05 г иона висмута) взбалтываю с 5 мл разведенной серной кислоты и фильтруют. К фильтрату добавляют 2 капли раствора калия йодида: Bi3+ + 3 I- → BiI3↓ BiI3 + I- → [BiI4]- |  
| ||||||||
| Железо (III) Fe3+ | По ГФ X А. Реакция комплексообразования основана на образовании комплекса железа (III) c ферроцианидом калия в кислой среде; образуется синий осадок железа (III) гексацианоферрата (II) – берлинская лазурь. Методика: К 2 мл раствора соли закисного железа (около 0,02 г иона железа) прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора феррицианида калия Fe3+ + K4 [Fe(CN)6] → KFe[Fe(CN)6]↓ + 3K+ В. Реакция осаждения аммония сульфидом. Образуется черный осадок. Осадок растворим в разведенных минеральных кислотах. Методика: К раствору соли окисного железа (около 0,02 г иона железа) прибавляют раствор сульфида аммония 2 Fe3+ + 3 (NH4)2 S →Fe2S3↓ + 6NH4+ С. Реакция комплексообразования с аммония роданидом в кислой среде; появляется красное окрашивание. Методика: К 2 мл раствора соли окисного железа (около 0,001 г иона железа) прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1—2 капли раствора роданида аммония Fe Cl3 + 3 NH4 SCN → Fe(SCN)3 + 3 NH4Cl |

| ||||||||
| Железо (II) Fe2+ | По ГФ X А. Реакция комплексообразования основана на образовании комплекса железа (II) c феррицианидом калия в кислой среде; образуется синий осадок железа (II) гексацианоферрата (III) турнбулевая синь. Методика: К 2 мл раствора соли закисного железа (около 0,02 г иона железа) прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора феррицианида калия Fe SO4 + K3[ Fe(CN)6] →KFe[Fe(CN)6]↓ + K2SO4 В. Реакция осаждения аммония сульфидом. Образуется черный осадок. Осадок растворим в разведенных минеральных кислотах. Методика: К раствору соли закисного железа (около 0,02 г иона железа) прибавляют раствор сульфида аммония Fe SO4 + (NH4)2 S → FeS↓+ (NH4)2SO4 |

| ||||||||
| Калий K+ | По ГФ X
А. Реакция осаждения винной кислотой в присутствии натрия ацетата и спирта; постепенно образуется белый кристаллический осадок калия гидротартрата, растворимый в разведенных минеральных кислотах и растворах щелочей.
Методика: К 2 мл раствора соли калия (0,01—0,02 г иона калия) прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл 95% спирта и встряхивают.
 В. Реакция осаждениягексанитро (III) кобальтатом натрия в уксуснокислой среде; образуется желтый кристаллический осадок гексанитро(III) кобальтата калия и натрия.
Методика: К 2 мл раствора соли калия (0,005—0,01 г иона калия), предварительно прокаленной для удаления солей аммония, прибавляют 0,5 мл разведенной уксусной кислоты и 0,5 мл раствора кобальтинитрита натрия
Na3[Co(NO2)6] + 2 K Cl→ K2Na[Co(NO2)6]↓ +2 NaCl
С. Окрашивание пламени в фиолетовый цвет.
Методика: Соль калия, внесенная в бесцветное пламя горелки на графитовой палочке, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло — в пурпурно-красный.
В. Реакция осаждениягексанитро (III) кобальтатом натрия в уксуснокислой среде; образуется желтый кристаллический осадок гексанитро(III) кобальтата калия и натрия.
Методика: К 2 мл раствора соли калия (0,005—0,01 г иона калия), предварительно прокаленной для удаления солей аммония, прибавляют 0,5 мл разведенной уксусной кислоты и 0,5 мл раствора кобальтинитрита натрия
Na3[Co(NO2)6] + 2 K Cl→ K2Na[Co(NO2)6]↓ +2 NaCl
С. Окрашивание пламени в фиолетовый цвет.
Методика: Соль калия, внесенная в бесцветное пламя горелки на графитовой палочке, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло — в пурпурно-красный.
|

| ||||||||
| Кальций Ca2+ | По ГФ X А. Реакция осаждения аммония оксалатом в среде аммиачного буферного раствора; образуется белый осадок оксалата кальция, растворимый в разведенных минеральных кислотах. Методика: К 1 мл раствора соли кальция (0,002—0,02 г иона кальция) прибавляют 1 мл раствора оксалата аммония Ca Cl2 + (NH4)2C2O4→ Ca C2O4↓ + 2 NH4Cl В. Окрашивание пламени в кирпично – красный цвет. Методика: Соль кальция, смоченная хлористоводородной кислотой и внесенная на графитовой палочке в бесцветное пламя горелки, окрашивает его в кирпично-красный цвет. |

| ||||||||
| Литий Li+ | 1. Реакция осаждения натрия гидрофосфатом. Белый желеобразный осадок 3Li+ + Na2HPO4 + NH4OH→ Li3PO4↓+2Na+ + NH4+ + H2O 2. Реакция осаждения натрия фторидомБелый осадок Li+ + NaF → LiF↓ + Na+ Окрашивание пламени в карминно – красный цвет | 3.

| ||||||||
| Магний Mg2+ | По ГФ X (1, 2); по ЕФ (1).
А. Реакция осаждения натрия гидрофосфатом в среде аммиачного буферного раствора; образуется белый кристалличекий осадок магний – аммония фосфата, растворимый в разведенных минеральных кислотах и уксусной кислоте.
Методика: К 1 мл раствора соли магния (0,002—0,005 г иона магния) прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 0,5 мл раствора натрия фосфата двухзамещенного. Аммония хлорид предотвращает выпадение осадка магния гидроксида.
NH4Cl
Mg SO4 + Na2HPO4 + NH4OH→MgNH4PO4 ↓+ Na2SO4 + H2O
В. Реакция комплексообразования.Осадок желто-зеленого цвета
 Методика: Органический реагент8-оксихинолин в аммиачной среде образует устойчивое комплексное соединение с катионами магния – оксихинолят магния (К нест = 4,7×10–7) Методика: Органический реагент8-оксихинолин в аммиачной среде образует устойчивое комплексное соединение с катионами магния – оксихинолят магния (К нест = 4,7×10–7)
|

| ||||||||
| Медь (II) Cu2+ | По ГФ Х А. Реакция осаждения с последующим комплексообразования с аммония гидроксидом, образуется синий осадок, который растворяется в избытке аммиака, появляется тёмно – синее окрашивание Методика: 0,002—0,005 г соли меди растворяют в 1—2 каплях воды, добавляют 1 каплю раствора аммиака: 2 Cu2+ + 2OH– + SO42– →Cu2(OH)2SO4↓ Cu2(OH)2SO4 + 8NH4+ + 6OH– →2[Cu(NH3)4]2+ + SO42– + 8H2O B. Окрашивание пламени в зелёный цвет |

| ||||||||
| Натрий Na+ | По ГФ Х А. Реакция осаждения цинкуранилацетатом; образуется желтый кристаллический осадок. Методика: 1 мл раствора соли натрия (0,01—0,03 г иона натрия) подкисляют разведенной уксусной кислотой, если необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинкуранилацетата Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O à NaZn[(UO2)3(CH3COO)9]•9H2O¯ + H+ В. Окрашивание пламени в желтый цвет. Методика: Соль натрия, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в желтый цвет. |

| ||||||||
| Цинк Zn2+ | По ГФ Х А. Реакция осаждения натрия сульфидом; образуется белый осадок цинка сульфида, нерастворимый в разведенной уксусной кислоте и легко растворимый в разведенной хлористоводородной кислоте. Методика: К 2 мл нейтрального раствора соли цинка (0,005—0,02 г иона цинка) прибавляют 0,5 мл раствора сульфида натрия или сероводорода Zn SO4 + Na2S →ZnS↓ + Na2SO4 В. Реакция осаждения ферроцианидом калия (гексацианоферрат (II) калия); образуется белый осадок, нерастворимый в разведенной хлористоводородной кислоте. Методика: К 2 мл раствора соли цинка (0,005—0,02 иона цинка) прибавляют 0,5 мл раствора ферроцианида калия Zn SO4 + K4[Fe(CN)6] →ZnK2[Fe(CN)6]↓ + K2SO4 |
| ||||||||
| Свинец Pb2+ | По ЕФ а) Реакция осаждения калия хроматом; образуется желтый осадок, растворяющийся при прибавлении 2 мл раствора натрия гидроксида концентрированного Р Методика: 0,1 г испытуемого образца растворяют в 1 мл кислоты уксусной Р. К полученному раствору или к 1 мл раствора, указанного в частной статье, прибавляют 2 мл раствора калия хромата Р. Pb2+ + K2CrO4 → PbCrO4↓ + 2K+ PbCrO4 + 4 NaOH → Na2[Pb(OH)4] + Na2CrO4 b) Реакция осаждения калия йодидом. Методика: 50 мг испытуемого образца растворяют в 1 мл кислоты уксусной Р. К полученному раствору или к 1 мл раствора, указанного в частной статье, прибавляют 10 мл воды Р и 0,2 мл раствора калия йодида Р, образуется желтый осадок. Смесь кипятят в течение 1-2 мин; осадок растворяется. Pb2+ + 2 KI → PbI2↓ + 2K+ Раствору дают остыть; вновь образуется осадок в виде блестящих желтых пластинок |

| ||||||||
| Серебро Ag+ | По ГФ Х (1,2); по ЕФ (2) А. Реакция окислительно – восстановительная, основана на восстановлении ионов серебра; на стенках пробирки образуется блестящий налёт или выпадает чёрный осадок металлического серебра Методика: К 1 мл раствору соли серебра (около 0,005 г иона серебра) добавляют раствор аммиака до растворения осадка, который образуется изначально, потом 2—3 капли раствора формальдегида и нагревают: 2 Ag+ + 2 OH– →Ag2O↓ + H2O Ag2O + 4 NH3 + H2O →2[Ag(NH3)2]OH 2[Ag(NH3)2]OH + HCOH →2Ag↓ + HCOONH4 + 3NH3↑ + H2O В. Реакция осаждения, хлористоводородной кислотой или хлоридами.Образуется белый творожистый осадок. Осадок нерастворим в кислотах, легко растворим в растворах аммиака и натрия тиосульфате Методика: 0,001—0,002 г иона серебра растворяют в 1—2 каплях воды, добавляют 1 каплю разведенной соляной кислоты или раствор натрия хлорида Ag+ + Cl– →AgCl↓ AgCl + 2NH3 →[Ag(NH3)2]+ + Сl– AgCl + 2S2O32– →[Ag(S2O3)2]3– + Cl– |

| ||||||||
| II. АНИОНЫ | ||||||||||
| Ацетат CH3COO– | По ГФ Х
А. Реакция образования сложного эфира (р-ция этерификации). Ощущается запах этилацетата
Методика: 2 мл раствора ацетата (0,02—0,06 г иона ацетата) нагревают с равным количеством концентрированной кислоты и 0,5 мл 95 %-ного спирта.
 В. Реакция комплексообразования с железа (III) хлоридом образуется комплекс красно – бурого цвета, исчезающего при прибавлении разведенных минеральных кислот.
Методика: К 2 мл нейтрального раствора ацетата (0,02—0,06 г иона ацетата) добавляют 0,2 мл раствора железа (III) хлорида
6 CH3COO– + 3 Fe3+ + 2H2O→ [Fe3(CH3COO)6(OH)2]+ + 2H+
В. Реакция комплексообразования с железа (III) хлоридом образуется комплекс красно – бурого цвета, исчезающего при прибавлении разведенных минеральных кислот.
Методика: К 2 мл нейтрального раствора ацетата (0,02—0,06 г иона ацетата) добавляют 0,2 мл раствора железа (III) хлорида
6 CH3COO– + 3 Fe3+ + 2H2O→ [Fe3(CH3COO)6(OH)2]+ + 2H+
|

| ||||||||
| Бензоат C6H5COO– | По ГФ Х
А. Реакция комплексообразования с железа (III) хлоридом образуется розовато – желтый осадок, растворимый в эфире.
Методика: К 2 мл нейтрального раствора бензоата (0,01—0,02 г иона бензоата) добавляют 0,2 мл раствора железа (III) хлорида. Реакцию проводят в нейтральной среде, так как в щелочной железа (III) хлорид образовывает бурый осадок гидроксида железа (III), в кислой среде комплексная соль растворяется.
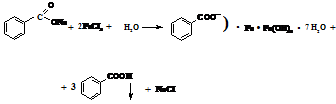 В. Реакция осаждения. С растворм меди сульфата нейтральные растворы бензоатов образуют осадок бирюзового цвета - вода – голубое окрашивание → обесвечивание хлороформ – голубое окрашивание
В. Реакция осаждения. С растворм меди сульфата нейтральные растворы бензоатов образуют осадок бирюзового цвета - вода – голубое окрашивание → обесвечивание хлороформ – голубое окрашивание
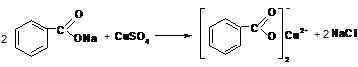
|

| ||||||||
| Бромид Br- | По ГФ Х
А. Реакция окислительно – восстановительная основана на окислении бромид – иона до свободного брома хлорамином Б в присутствии кислоты хлористоводородной. Веделившийся бром извлекают в хлороформный слой, который окрашивается в желто – бурый цвет.
Методика: К 1 мл раствора бромида (0,002-0,03 г иона бромида) прибавляют 1 мл разведенной хлористоводородной кислоты, 0,5 мл раствора хлорамина, 1 мл хлороформа и взбалтывают, хлороформный слой окрашивается в желто-бурый цвет.
 2Br- + Cl2→ Br2 + 2Cl-
В. Реакция осаждения бромид – иона серебра нитратом в азотнокислой среде, выпадает желтоватый творожистый осадок серебра бромида, нерастворимый в азотной кислоте разведенной и трудно растворимый в 10% растворе аммиака.
Методика: К 2 мл раствора бромида (0,002—0,01 г иона бромида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебраОбразуется желтоватый творожистый осадок. Осадок нерастворим в разведенной азотной кислоте и трудно растворим в растворе аммиака.
Na Br + Ag NO3→ AgBr↓ + NaNO3
AgBr + 2 NH4OH → [Ag(NH3)2]Br + 2H2O
Не фармакопейная реакция
Кристаллическая субстанция с раствором меди сульфата в присутствии концентрированной серной кислоты образует чёрный осадок
Cu2+ + 2Br-→CuBr2↓
2Br- + Cl2→ Br2 + 2Cl-
В. Реакция осаждения бромид – иона серебра нитратом в азотнокислой среде, выпадает желтоватый творожистый осадок серебра бромида, нерастворимый в азотной кислоте разведенной и трудно растворимый в 10% растворе аммиака.
Методика: К 2 мл раствора бромида (0,002—0,01 г иона бромида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебраОбразуется желтоватый творожистый осадок. Осадок нерастворим в разведенной азотной кислоте и трудно растворим в растворе аммиака.
Na Br + Ag NO3→ AgBr↓ + NaNO3
AgBr + 2 NH4OH → [Ag(NH3)2]Br + 2H2O
Не фармакопейная реакция
Кристаллическая субстанция с раствором меди сульфата в присутствии концентрированной серной кислоты образует чёрный осадок
Cu2+ + 2Br-→CuBr2↓
|

| ||||||||
| Борат ион BO33- Тетроборат ион В4О72- | 1. Реакция образования сложного эфира. Образование борноэтилового эфира горящего с зеленой каймой пламени
 2. С куркумовой бумагой – розовый или буровато – красное окрашивание, при обработке раствором аммиака зелено – черное окрашивание
2. С куркумовой бумагой – розовый или буровато – красное окрашивание, при обработке раствором аммиака зелено – черное окрашивание
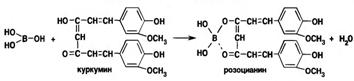 Для натрия тетрабората характерны те же реакции подлинности, что и для кислоты борной, образующейся при подкислении соли:
Na2 B4O7 + 2HCI + 5H2O ® 4B(OH)3 + 2NaCI
Для натрия тетрабората характерны те же реакции подлинности, что и для кислоты борной, образующейся при подкислении соли:
Na2 B4O7 + 2HCI + 5H2O ® 4B(OH)3 + 2NaCI
| 3. 
| ||||||||
| Йодид I- | По ГФ Х A. Реакция окислительно – восстановительная основана на окислении йодид иона до свободного йода натрия нитритом или железа (III) хлоридом в кислой среде и восстановлении азота (III) до азота (II) или железа (III) до железа (II) в присутствии хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет. Методика: К 2 мл раствора йодида (0,003—0,02 г иона йодида) прибавляют 0,2 мл разведенной серной кислоты, 0,2 мл раствора нитрита натрия или раствора хлорида окисного железа и 2 мл хлороформа. При взбалтывании хлороформный слой окрашивается в фиолетовый цвет 2 K I + 2 Na NO2 + 2 H 2SO4 →I2 + 2NO↑ + K2SO4 + Na2SO4 + 2 H2O 2K I + 2 Fe Cl3 → I2 + 2FeCl2 + 2KCl В. Реакция осаждения йодид иона серебра нитратом в азотнокислой среде; образуется желтый творожистый осадок серебра йодида, не растворимый в разведенной азотной кислоте и растворе аммиака. Методика: К 2 мл раствора йодида (0,002—0,01 г иона йодида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра Na I + Ag NO3 →AgI↓ + NaNO3 С. Реакция окислительно – восстановительная основана на окислении йодид иона до свободного йода концентрированной серной кислотой при нагревании; выделяются фиолетовые пары. Методика: При нагревании 0,1 г препарата с 1 мл концентрированной серной кислоты выделяются фиолетовые пары йода. 8 H I + H2SO4→ I2 ↑ + H2S ↑+ 4 H2O |

| ||||||||
| Карбонаты, гидрокарбонаты CO32- (НСО3-) | По ГФ Х А. Реакция вытеснения слабой угольной кислоты из соли сильной минеральной кислотой; выделяется углекислый газ, который образует белый осадок при пропускании через известковую воду. Методика: К 0,2 г карбоната (гидрокарбоната) или к 2 мл раствора карбоната (гидрокарбоната) (1:10) прибавляют 0,5 мл разведенной кислоты Na2CO3 + 2 H Cl →2 NaCl + H2O + CO2↑ NaНCO3 + H Cl → NaCl + H2O + CO2↑ Выделяется углекислый газ, который образует белый осадок при пропускании через известковую воду. Ca(OH)2 + CO2 → CaCO3 ↓ + H2O В. Реакция осаждения карбонат иона насыщенным раствором магния сульфата; гидрокарбонаты образуют белый осадок только при нагревании, т.к. при этом они переходят в карбонаты, которые дают осадок в виде комплексной соли. Методика: К 2 мл раствора карбоната (1:10) прибавляют 5 капель насыщенного раствора сульфата магния 4Na2CO3 + 4 MgSO4 + 4H2O→3MgCO3·Mg(OH)2·3H2O↓ + Na2SO4 + CO2↑ 2NaНCO3 → Na2CO3 + СО2↑ + Н2О С. Реакция среды. Методика: Раствор карбоната (1:10) при прибавлении 1 капли раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбонатов). | 
| ||||||||
| Нитрат NO3- | А. Реакция окислительно – восстановительная. Реакция окисления дифениламина нитратом в среде концентрированной серной кислоты до дифенилдифенохинондиимина гидросульфата; появляется синее окрашивание.
Методика: К препарату (около 0,001 г иона нитрата) прибавляют 2 капли раствора дифениламина
 B. Реакция окислительно – восстановительная при нагревании металлическая медь окисляется до меди (II) азотной кислотой в присутствии концентрированной серной кислоты, а нитрат ион восстанавливается до оксида азота (II), который окисляется до оксида азота (IV); выделяются бурые пары оксида азота (IV).
Методика: К препарату (0,002—0,005 г иона нитрата) прибавляют по 2—3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают
Cu + 2 NaNO3 + 2 H 2SO4 →CuSO4 + 2 NO2↑ +2 H2O + Na2SO4
C. Нитраты (около 0,002 г иона нитрата) не обесцвечивают раствор перманганата калия, подкисленный разведенной серной кислотой (отличие от нитритов).
D.К 5—6 капелям насыщенного раствора железа (II) сульфата добавляют 2-3 капли раствора нитрата и перемешивают, потом осторожно по стенке пробирки приливают 5—6 капель концентрированной серной кислоты так, чтобы жидкости не смешивались
6Fe2+ + 2NO3– + 8H+ →6Fe3+ + 2NO + 4H2O
FeSO4 + NO→ [FeNO]SO4
верхний слой приобретает темно-фиолетовую окраску
B. Реакция окислительно – восстановительная при нагревании металлическая медь окисляется до меди (II) азотной кислотой в присутствии концентрированной серной кислоты, а нитрат ион восстанавливается до оксида азота (II), который окисляется до оксида азота (IV); выделяются бурые пары оксида азота (IV).
Методика: К препарату (0,002—0,005 г иона нитрата) прибавляют по 2—3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают
Cu + 2 NaNO3 + 2 H 2SO4 →CuSO4 + 2 NO2↑ +2 H2O + Na2SO4
C. Нитраты (около 0,002 г иона нитрата) не обесцвечивают раствор перманганата калия, подкисленный разведенной серной кислотой (отличие от нитритов).
D.К 5—6 капелям насыщенного раствора железа (II) сульфата добавляют 2-3 капли раствора нитрата и перемешивают, потом осторожно по стенке пробирки приливают 5—6 капель концентрированной серной кислоты так, чтобы жидкости не смешивались
6Fe2+ + 2NO3– + 8H+ →6Fe3+ + 2NO + 4H2O
FeSO4 + NO→ [FeNO]SO4
верхний слой приобретает темно-фиолетовую окраску
|

| ||||||||
| Нитриты NO2- | А. Реакция окислительно – восстановительная. Реакция окисления дифениламина нитритом в среде концентрированной серной кислоты до дифенилдифенохинондиимина гидросульфата; появляется синее окрашивание.
Методика: К препарату (около 0,001 г иона нитрита) прибавляют 2 капли раствора дифениламина
 Б. Реакция разложения нитритов в кислой среде; выделяются желто – бурые пары (отличие от нитратов)
Методика: К препарату (около 0,03 г иона нитрита) прибавляют 1 мл разведенной серной кислоты
2 Na NO2 + H2SO4 → NO2 ↑ + NO↑ + H2O + Na2SO4
B. Реакция нитрозирования антипирина в кислой среде. Реакция электрофильного замещения водорода в 4 – ом положении антипирина на нитрозогруппу; появляется изумрудно – зеленое окрашивание (отличие от нитратов).
Методика: Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях разведенной хлористоводородной кислоты, прибавляют 2 капли раствора нитрита (около 0,001 г иона нитрита)
Б. Реакция разложения нитритов в кислой среде; выделяются желто – бурые пары (отличие от нитратов)
Методика: К препарату (около 0,03 г иона нитрита) прибавляют 1 мл разведенной серной кислоты
2 Na NO2 + H2SO4 → NO2 ↑ + NO↑ + H2O + Na2SO4
B. Реакция нитрозирования антипирина в кислой среде. Реакция электрофильного замещения водорода в 4 – ом положении антипирина на нитрозогруппу; появляется изумрудно – зеленое окрашивание (отличие от нитратов).
Методика: Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 каплях разведенной хлористоводородной кислоты, прибавляют 2 капли раствора нитрита (около 0,001 г иона нитрита)
|  
| ||||||||
Салицилат

| По ЕФ
а) Реакция комплексообразования на фенольный и карбоксильную группу с железа (III) хлоридом; появляется сине – фиолетовое или красно – фиолетовое окрашивание, которое сохраняется при прибавлении небольшого количества разведенной уксусной кислоты, но исчезает при прибавлении разведенной хлористоводородной кислоты. При этом образуется белый кристаллический осадок салициловой кислоты.
Методика: К 1 мл раствора, указанного в частной статье, прибавляют 0,5 мл раствора железа (III) хлорида Р1; которое не исчезает после прибавления 0,1 мл кислоты уксусной Р.
 b) 0,5 г испытуемого образца растворяют в 10 мл воды Р. К полученному раствору или к 10 мл раствора, указанного в частной статье, прибавляют 0,5 мл кислоты хлористоводородной Р. Полученный осадок после перекристаллизации из горячей воды Р и высушивания под вакуумом имеет температуру плавления от 156°С до 161°С.
C6H4(OH)COO Na + H Cl → C6H4(OH)COOH↓ + NaCl
b) 0,5 г испытуемого образца растворяют в 10 мл воды Р. К полученному раствору или к 10 мл раствора, указанного в частной статье, прибавляют 0,5 мл кислоты хлористоводородной Р. Полученный осадок после перекристаллизации из горячей воды Р и высушивания под вакуумом имеет температуру плавления от 156°С до 161°С.
C6H4(OH)COO Na + H Cl → C6H4(OH)COOH↓ + NaCl
|

| ||||||||
| сульфат SO42- | По ГФ Х Реакция осаждения бария хлоридом; образуется белый осадок бария сульфата, нерастворимый в разведенных минеральных кислотах. Методика: К 2 мл раствора сульфата (0,005-0,05 г иона сульфата) прибавляют 0,5 мл раствора хлорида бария Ba2+ + SO42- → BaSO4↓ | 
| ||||||||
| сульфит SO32- | По ГФ Х А. Реакция вытеснения кислоты сернистой из соли сильной минеральной кислоты; сернистая кислота разлагается с постепенным выделением сернистого газа, обнаруживаемый по характерному резкому запаху. Методика: К 2 мл раствора сульфита (0,01-0,03 г иона сульфита) прибавляют 2 мл разведенной хлористоводородной кислоты и встряхивают Na2 SO3 + 2 H Cl→ 2 NaCl + H2O +SO2↑ В. Реакция осаждения бария хлоридом; образуется белый осадок. Осадок растворим в разведенной хлористоводородной кислоте (отличие от сульфатов). Методика: К 2 мл раствора сульфита (0,002—0,02 г иона сульфита) прибавляют 0,5 мл раствора хлорида бария Ba Cl2 + Na2 SO3 → BaSO3↓ +2NaCl BaSO3 + 2HCl→ BaCl2 + H2O + SO2 ↑ С. Реакция окислительно – восстановительная. При добавлении к раствору сульфита нескольких капель раствора йода (0,1 моль/л) реактив обесцвечивается Na2 SO3 + I2 + H2O →2HI + Na2SO4 |

| ||||||||
| Тиосульфат S2O32- | 1. Реакция осаждения серебра нитратом; белый осадок, переходящий в жёлтый цвет и затем в черный S2O32- + Ag NO3 → Ag2S2O3↓ + 2NO3- - белыйосадок Ag2S2O3 → Ag2SO3↓ + S↓ - желтыйосадок Ag2SO3 + S + H2O → Ag2S↓ + H2SO4 – чёрныйосадок 2. Реакция разложения хлороводородной кислотой Na2S2O3 + 2HCl → 2NaCl + SO2 ↑ + S↓ + H2O Через время появляется помутнение желтого цвета (S) и появляется запах (SO2) | 3. 
| ||||||||
| Фтор F- | 1. Реакция комплексообразования с ионами циркония
 2. Реакция комплексообразования с ионами железа (III)
2. Реакция комплексообразования с ионами железа (III)
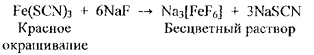 Реакция осаждения кальция хлоридом Белый осадок:
Ca2+ + 2Na F → CaF2↓+ 2Na+
Реакция осаждения кальция хлоридом Белый осадок:
Ca2+ + 2Na F → CaF2↓+ 2Na+
| 3.

| ||||||||
| фосфат PO43- | А. Реакция осаждения серебра нитратом в нейтральной среде (рН=7) образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака Методика: К 1 мл раствора фосфата (0,01—0,03 г иона фосфата), нейтрализованного до рН около 7,0, прибавляют несколько капель раствора нитрата серебра Na3 PO4 + 3 Ag NO3 →Ag3PO4↓ + 3 NaNO3 В. Реакция осаждения магния сульфатом в среде аммиачного буферного раствора; образуется белый кристаллический осадок, растворимый в разведенных минеральных кислотах Методика: К 1 мл раствора фосфата (0,01—0,03 г иона фосфата) прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 0,5 мл раствора сульфата магния Mg SO4 + Na2 HPO4 + NH4 OH→MgNH4PO4↓+ Na2SO4 + H2O С. Реакция осаждения молибдатом аммония в разведенной азотной кислоте при нагревании; образуется желтый кристаллический осадок, растворимый в растворе аммиака. Методика: К 1 мл раствора фосфата (0,01—0,03 г иона фосфата) в разведенной азотной кислоте прибавляют 2 мл раствора молибдата аммония и нагревают H3 PO4 +21HNO3 +12(NH4)2MoO4→(NH4)3PO4·12MoO3↓+ 21NH4NO3 +12H2O |  
| ||||||||
| Хлорид Cl- | По ГФ Х Реакция осаждения серебра нитратом в азотнокислой среде; образуется белый творожистый осадок. Осадок нерастворим в разведенной азотной кислоте и растворим в растворе аммиака. Методика: К 2 мл раствора хлорида (0,002—0,01 г иона хлорида) прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра Na Cl + AgNO3 → Ag Cl ↓+ NaNO3 AgCl + 2 NH4OH→ [Ag(NH3)2]Cl + 2 H2O Для солей органических оснований испытание растворимости образовавшегося осадка хлорида серебра проводят после отфильтровывания и промывания водой | 
|
ВЫВОДЫ:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ПРАКТИЧЕСКАЯ РАБОТА №2.
Ход работы
КАЧЕСТВЕННЫЙ АНАЛИЗ (С НИТРАТОМ СЕРЕБРА)
1. Поместите в пробирку 5 капель раствора хлористоводородной кислоты.
2. Добавьте 1-2 капли нитрата серебра. Образуется белый творожный осадок.
3. Добавьте к осадку раствор аммиака. Наблюдайте растворение осадка.
Меры безопасности
Не выливайте раствор соляной кислоты и нитрата серебра в раковину. Сливайте их только в специальные сливы.
РЕЗУЛЬТАТЫ:


Анализ натрия бромида
Предварительные сведения
Бромиды натрия и калия применяют в качестве успокаивающего средства. Успокаивающее действие препаратов брома основано на их способности усиливать процессы торможения в коре головного мозга. Поэтому натрия бромид применяют при неврастении, повышенной раздражительности и бессоннице. Применяют внутрь в растворах (микстурах) и таблетках.
При развитии осложнений (насморк, кашель, конъюнктивит, общая слабость, ослабление памяти, кожная сыпь), возникающих в результате длительного применения бромидов, вводят хлорид натрия в сочетании с большим количеством воды. В глазной практике при лечении желтой ртутной мазью не рекомендуется одновременно принимать бромид натрия.
Натрия бромид следует хранить в условиях, предупреждающих его окисление, в хорошо закупоренных банках из оранжевого стекла, в сухом месте.
Назначают по 0,5-1 г 3-4 раза в день.
Оборудование и реактивы: пробирки (1 шт.), пипетки на 1 мл (4 шт.), штатив для пробирок (1 шт.), раствор натрия бромида (3 шт.), раствор соляной кислоты (2 М), раствор хлорамина (1:1), хлороформ, микстура натрия бромида.
Ход работы
1. Прилейте в пробирку 1 мл анализируемого раствора.
2. Добавьте 1 мл раствора соляной кислоты.
3. Прилейте 0,5 мл раствора хлорамина.
4. Добавьте 1 мл хлороформа и взболтайте. Хлороформный слой окрашивается в желто-бурый цвет.
Меры безопасности
1. Не выливайте раствор соляной кислоты в раковину. Сливайте его только в специальный слив.
2. Работу следует проводить под тягой.
РЕЗУЛЬТАТЫ:

Анализ раствора йода
Предварительные сведения
Вмедицине йод используется в виде простого вещества, йодида калия и натрия, «Антиструмина» и других препаратов. Будучи окислителями, галогены используются в медицине главным образом как дезинфицирующие вещества. Однако фтор и бром очень токсичны. Хлор применяется в качестве антисептика для обеззараживания воды. Йод наименее ядовит из всех галогенов. Йод единственный из всех галогенов является лекарственным средством.
Йод широко распространен в природе. Его источниками являются морская вода, земная кора, растительные и животные организмы. Источниками для промышленного получения йода служат морские водоросли, отходы производства чилийской селитры, нефтяные буровые воды.
Йод выпускают в виде кристаллов и спиртового раствора. Йод представляет собой серовато-черные с металлическим блеском кристаллы со своеобразным запахом. Йод летуч даже при обычной температуре.
В организме человека йод сосредоточен главным образом в щитовидной железе и участвует в образовании ее гормонов. Если гормонов в организме недостаточно, то обмен веществ задерживается и человек отстает в развитии и росте. Если пища или вода не содержит достаточного количества йода, то у населения возникает заболевание — зобная болезнь. Для предотвращения заболевания употребляют йодированную поваренную соль. Чаще употребляют йодид калия и йодид натрия.
Йод применяют наружно как антисептическое, раздражающее и средство при воспалительных и других заболеваниях кожи и слизистых оболочек. Йод плохо растворим в воде, но зато он прекрасно растворяется в этаноле. Этим пользуются для приготовления 5—10% раствора йода в этаноле, называемого йодной настойкой. Спиртовые растворы йода оказывают антимикробное действие, поэтому применяются в медицине как наружное средство для местных прижиганий.
Йод употребляют также внутрь в виде капель для профилактик атеросклероза, хронических воспалительных процессов и хроническом отравлении ртутью и свинцом. Йод хранят в склянках с притертыми пробками в прохладном, защищенном от света месте.
Оборудование и реактивы: пробирки (1 шт.), пипетки (медицинские) (3 шт.), штатив для пробирок (1 шт.), раствор йода (спиртовой 5%), вода дистиллированная, раствор крахмала (крахмальный клейстер).
Ход работы
1. Поместите в пробирку 1-2 капли раствора йода.
2. Добавьте 1-2 мл воды.
3. Прибавьте 2-3 капли раствора крахмала. Наблюдайте синее окрашивание.
РЕЗУЛЬТАТЫ:

Анализ пероксида водорода
Предварительные сведения
Из элементов шестой группы периодической системы элементов интерес для медицины представляют кислород и сера, которые как в чистом виде, так и в виде различных соединений используются в фармацевтической практике. Наиболее распространенными фармацевтическими препаратами кислорода являются пероксид водорода, вода дистиллированная, кислород.
Препарат пероксида водорода, применяемый в медицине, содержит примерно 3% пероксида водорода. Он представляет собой бесцветную прозрачную жидкость со слабокислой реакцией.
В медицинской практике пероксид водорода применяется как наружное средство в качестве антисептика. Антисептическое действие обуславливается окислительными свойствами пероксида водорода, который выделяет кислород в присутствии ферментов — каталазы крови. Каталаза быстро разлагает пероксид водорода, при этом бурно выделяется кислород, что создает видимость пены. Пероксид водорода применяется как кровоостанавливающее средство при порезах. Може
|
|
|

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!