Обратимые процессы – это процессы, в которых система самопроизвольно возвращается в исходное состояние, проходя через одни и те же промежуточные состояния, как в прямом, так и в обратном направлении, не производя изменений в окружающих телах. Такие процессы возможны только с идеальным газом, и они могут состоять из совокупности изотермических, изобарных, изохорных и адиабатных процессов.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, теплопроводность, вязкое течение и др.
Тепловые процессы могут протекать только в одном направлении. Такие процессы называются необратимыми. Например, при тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой. Следовательно, процесс теплообмена при конечной разности температур является необратимым.
Примером необратимости механических процессов могут служить колебания маятника. Колебания маятника, выведенного из положения равновесия, затухают. Можно вновь увеличить их размах, подтолкнув маятник рукой. Но это увеличение возникает не само собой, а становится возможным в результате более сложного процесса, включающего движение руки.
Процессы намагничивания могут быть обратимыми или необратимыми.
При необратимых процессах намагничивания большая часть энергии рассеивается в виде тепла. Поэтому для восстановления исходного магнитного состояния необходимо затрачивать дополнительную энергию.
Тепловая энергия — форма энергии, связанная с движением атомов, молекул или других частиц, из которых состоит тело. Тепловая энергия может выделяться благодаря химическим реакциям (горение), ядерным реакциям (деление ядра, ядерный синтез), механическим взаимодействиям (трение). Теплота может передаваться между телами с помощью теплопроводности, конвекции или излучения.
Термодинамическая энтропия S, часто просто именуемая энтропия, является функцией состояниятермодинамической системы.
Изменение энтропии термодинамической системы при обратимом процессе это отношение общего количества тепла  к величине абсолютной температуры
к величине абсолютной температуры 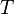 (то есть тепло, переданное системе, при постоянной температуре):
(то есть тепло, переданное системе, при постоянной температуре):
 .
.
Для кругового обратимого процесса изменение энтропии равно нулю.
Существуют несколько формулировок второго начала термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Порядок, как отображение структуры пространства, определяет закономерность пространственного размещения частей в целом материального микро- и макромира. Порядок, как выражение структурно-энергетического состояния системы, характеризуется минимальной энтропией. Второй закон термодинамики гласит, что в любой замкнутой системе беспорядок (энтропия) всегда возрастает со временем. Иначе говоря, число степеней свободы молекулярного (динамического) хаоса растет со временем – по существу вытекает из того, что состояний беспорядка всегда гораздо больше, чем состояний порядка (упорядоченных состояний). Энтропия представляет собой функцию состояния термодинамической системы, изменение которой ΔS в равномерном процессе равно отношению количества теплоты ΔQ, сообщенного системе или отведенного от нее, к термодинамической температуре системы T. Второй закон термодинамики утверждает, что энтропия неизбежна. Мир непременно стремится к беспорядку. На самом деле в природе самопроизвольно возникают состояния самоорганизации. Тем не менее, Второе Начало термодинамики соблюдается. Он справедлив не только для равновесных систем. Отсутствие порядка в системе, предмете, объекте представляет собой хаос, характеризующийся – максимальным значением энтропии. Чем больше хаос, тем больше энтропия, тем меньше внутренняя энергия объекта, системы. Рост энтропии является следствием перехода отдельных видов движения материи в тепло. В случае, когда создается более упорядоченное состояние в какой-либо подсистеме за счет влияния извне, это вносит дополнительный беспорядок в систему. Наглядно можно увидеть это на примере работы холодильника, в котором работающий мотор выделяет дополнительное тепло в атмосферу, еще больше нагревая ее, и увеличивая «хаос» движения молекул.



 к величине абсолютной температуры
к величине абсолютной температуры 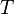 (то есть тепло, переданное системе, при постоянной температуре):
(то есть тепло, переданное системе, при постоянной температуре): .
.


