

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
Задания с комментариями и решениями
Пример 44. Установите соответствие между изменением степени окисления азота и схемой реакции, в которой это изменение происходит.
ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ

| СХЕМА РЕАКЦИИ
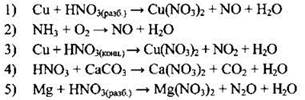
|
Ответ:
| A | Б | В | Г |
Для поиска ответа следует определить степень окисления азота во всех соединениях, приведённых в правом столбце:

Теперь ответ очевиден:
Ответ:
| A | Б | В | Г |
Ответ: 3512
Пример 45. Установите соответствие между уравнением реакции и изменением степени окисления окислителя в данной реакции.
УРАВНЕНИЕ РЕАКЦИИ

| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ

|
Ответ:
| А | Б | В | Г |
Окислитель - элемент, атомы которого принимают электроны (или вещество, содержащее такой элемент). В первой реакции окислителем является аммиак за счёт водорода(+I):

Во второй реакции окислителем является сероводород также за счёт водорода(I). В третьей реакции окислителем является оксид азота(II) за счёт N+2:

В последней реакции окислителем является молекулярный кислород:

Теперь ответ очевиден:
| А | Б | В | Г |
Ответ: 4436
Пример 46. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
Выполнение задания следует начать с определения того, какие элементы изменяют степень окисления. В данном примере изменяет степень окисления элемент марганец:

Атомы марганца, входящие в состав КМnO4 понижают свою степень окисления до +4, т.е. принимают по три электрона, а атомы марганца в степени окисления +2 повышают ее до +4, следовательно, отдают по 2 электрона. Процесс отдачи электронов называется окислением, а элемент, отдающий электроны, является восстановителем. Значит MnSO4 за счет марганца в степени окисления +2 является восстановителем.
Процесс принятия электронов называется восстановлением, а элемент, который принимает электроны, является окислителем. Значит, КМnO4 за счет марганца в степени окисления +7 является окислителем.
Далее необходимо составить уравнение реакции, а для этого нужно прежде всего определить, какие продукты образуются в результате реакции. Здесь важно обратить внимание нахреду, в которой происходит взаимодействие указанных веществ. В зависимости от среды восстановление и окисление ионов происходит по-разному. Например, ион МnO4 в кислотной среде превращается в ион Мn2+, в щелочной - в ион МnО42-, а в нейтральной среде - в оксид марганца(IV) МnO2.
Приходим к выводу, что в левой части уравнения пропущенным веществом является вода, а в правой - серная кислота.

Коэффициенты, полученные при составлении электронного баланса, поставим в левую часть схемы реакции:

Суммируем число атомов марганца и ставим полученную сумму (5) перед оксидом марганца(IV). Число атомов калия в левой и правой части равны 2. Остается определить оставшиеся коэффициенты перед водой и серной кислотой. Получаем уравнение реакции:

Пример 47. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
Задание выполняется по тому же плану, как и предыдущее:
1) Составляем электронный баланс

2) Определяем, что N+3 является восстановителем, вследствие отдачи электронов, Мn+7 - окислителем, вследствие принятия электронов.
3) Составляем уравнение реакции с учетом того, что в нейтральной среде МnO2 образуется перманганат-иона МnO4.

Задания для самостоятельной работы
139. Окислительные свойства оксид серы(IV) проявляет в реакции:

Ответ: 
140. В реакции оксида вольфрама(VI) с водородом окислителем является
1) W+6
2) Н2O
3) O-2
4) W0
Ответ: 
141. В реакции оксида марганца(II) с углеродом окислителем является
1) С0
2) О-2
3) Мn+2
4) Мn0
Ответ: 
142. Хлор является и окислителем, и восстановителем в реакции, уравнение которой

Ответ: 
143. Азот проявляет свойства восстановителя в реакции, схема которой

Ответ: 
144. При взаимодействии с каким веществом оксид углерода(II) проявляет свойства восстановителя?
1) N2
2) H2S
3) Н2
4) Fe2O3
Ответ: 
145. Бром проявляет свойства восстановителя в реакции, схема которой

Ответ: 
146. Окислительно-восстановительной не является реакция

Ответ: 
147. Углерод является окислителем в реакции с
1) водой
2) алюминием
3) оксидом меди(II)
4) серной кислотой
Ответ: 
148. При взаимодействии с каким веществом оксид серы(IV) проявляет свойства окислителя?
1) оксидом натрия
2) гидроксидом бария
3) водой
4) сероводородом
Ответ: 
149. В реакции магния с концентрированной азотной кислотой окислителем является
1) Mg2+
2) Н+
3) Mg0
4) NO3
Ответ: 
150. К окислительно-восстановительным относится реакция
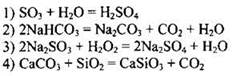
Ответ: 
151. В реакции цинка с разбавленной серной кислотой восстановителем является
1) Zn0
2) SO42-
3) Н+
4) Zn2+
Ответ: 
152. Сера является и окислителем, и восстановителем в реакции с
1) хлором
2) железом
3) гироксидом натрия
4) азотной кислотой
Ответ: 
153. Установите соответствие между схемой окислительно-восстановительной реакции и формулой вещества-восстановителя в ней.
СХЕМА РЕАКЦИИ

| ВОССТАНОВИТЕЛЬ

|
Ответ:
| А | Б | В | Г |
154. Установите соответствие между уравнением окислительно-восстановительной реакции и веществом-окислителем в ней.
УРАВНЕНИЕ РЕАКЦИИ
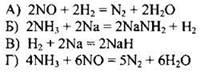
| ОКИСЛИТЕЛЬ

|
Ответ:
| А | Б | В | Г |
155. Установите соответствие между схемой окислительно-восстановительной реакции и веществом- восстановителем в ней.
СХЕМА РЕАКЦИИ

| ВОССТАНОВИТЕЛЬ

|
Ответ:
| А | Б | В | Г |
156. Установите соответствие между схемой окислительно-восстановительной реакции и изменением степени окисления окислителя в ней.
СХЕМА РЕАКЦИИ

| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ

|
Ответ:
| А | Б | В | Г |
157. Установите соответствие между схемой реакции и веществом-восстановителем в ней.
СХЕМА РЕАКЦИИ

| ВОССТАНОВИТЕЛЬ

|
Ответ:
| А | Б | В | Г |
158. Установите соответствие между уравнением окислительно-восстановительной реакции и изменением степени окисления серы в ней.
УРАВНЕНИЕ РЕАКЦИИ

| ИЗМЕНЕНИЕ СТЕПЕНИ ОКИСЛЕНИЯ СЕРЫ 1) от -2 до +4 2) от -2 до 0 3) от 0 до -2 4) от +6 до +4 5) от +4 до +6 |
Ответ:
| А | Б | В | Г |
159. Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем.
УРАВНЕНИЕ РЕАКЦИИ

| ОКИСЛИТЕЛЬ

|
Ответ:
| A | Б | В | Г |
160. Установите соответствие между схемой изменения степени окисления элемента и уравнением реакции, в которой это изменение происходит.
СХЕМА ИЗМЕНЕНИЯ СТЕПЕНИ ОКИСЛЕНИЯ

| УРАВНЕНИЕ РЕАКЦИИ

|
Ответ:
| А | Б | В | Г |
161. Установите соответствие между уравнением окислительно-восстановительной реакции и свойством азота, которое он проявляет в этой реакции.
УРАВНЕНИЕ РЕАКЦИИ

| СВОЙСТВО АЗОТА 1) является окислителем 2) является восстановителем 3) является и окислителем, и восстановителем 4) не проявляет окислительно-восстановительных свойств |
Ответ:
| А | Б | В | Г |
162. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
163. Используя метод электронного баланса, составьте уравнение реакции

Определите окислитель и восстановитель.
164. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
165. Используя метод электронного баланса, составьте уравнение реакции

Определите окислитель и восстановитель.
166. Используя метод электронного баланса, составьте уравнение реакции
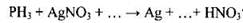
Определите окислитель и восстановитель.
167. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
168. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
169. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
170. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
171. Используя метод электронного баланса, составьте уравнение реакции:

Определите окислитель и восстановитель.
1.1.13.Электролиз расплавов и растворов (солей, щелочей, кислот)
Задания с комментариями и решениями
Пример 48. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ 1) водород 2) алюминий 3) ртуть 4) медь 5) кислород 6) натрий |
При выполнении задания необходимо вспомнить основные правила, в соответствии с которыми можно определить продукты, образующиеся на катоде при электролизе веществ в растворах.
На катоде всегда происходит процесс восстановления.
Если металл в ряду напряжений стоит левее марганца, то выделяется водород. Воспользовавшись этим правилом, находим, что в случае электролиза солей Al(NO3)3и NaNO3 на катоде выделяется водород.
Если металл в ряду напряжений расположен правее водорода, то на катоде выделяется сам металл. Следовательно, в случае электролиза солей Hg(NO3)2и CU(NO3)2выделяется, соответственно, ртуть и медь.
| А | Б | В | Г |
Ответ: 1341
Пример 49. Установите соответствие между формулой соли и продуктом, который образуется на инертном аноде при электролизе её водного раствора.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ 1) водород 2) кислород 3) металл 4) хлор 5) сера 6) азот |
Как и при выполнении предыдущего задания, вспомним основные правила разрядки ионов на аноде при электролизе.
На аноде происходят процессы окисления. Если анион бескислородный (за исключением фторид-аниона), то на аноде окисляется сам анион. Таким образом, при электролизе соли K2Sобразуется сера, а ВаСl2 - хлор.
Если анион кислородсодержащий, то на аноде окисляются молекулы воды и выделяется кислород:

Следовательно, в случае электролиза солей CuSO4 и Pb(NO3)2на аноде выделяется кислород.
| А | Б | В | Г |
Ответ: 2542
Пример 50. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
ФОРМУЛА ВЕЩЕСТВА

| ПРОДУКТ НА КАТОДЕ 1) кислород 2) только металл 3) только водород 4) металл и водород 5) азот 6) хлор |
Вспомните, что на катоде могут выделяться: только металл, только водород, и металл и водород. От чего это зависит? В первую очередь, от положения металла в ряду напряжений. Если металл расположен в ряду напряжений правее водорода, то на катоде выделяется, как правило, сам металл. Если металл расположен в ряду напряжений левее марганца, то вместо металла выделяется водород из воды. В промежуточных случаях возможно образование как металла, так и водорода. Используя это правило и ряд напряжений металлов (выдаётся на экзамене), можно определить, что в первом случае на катоде выделится водород, во втором случае — серебро, в третьем случае возможно образование и цинка и водорода, в последнем случае выделится только водород.
Ответ: 3243
Задания для самостоятельной работы
172. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли.
ФОРМУЛА ВЕЩЕСТВА

| ПРОДУКТ НА КАТОДЕ

|
Ответ:
| А | Б | В | Г |
173. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе водного раствора этой соли.
ФОРМУЛА ВЕЩЕСТВА

| ПРОДУКТ НА АНОДЕ

|
Ответ:
| А | Б | В | Г |
174. Установите соответствие между металлом и способом его электролитического получения.
| МЕТАЛЛ A) натрий Б) алюминий B) серебро Г) медь | ЭЛЕКТРОЛИЗ 1) водного раствора солей 2) водного раствора гидроксида 3) расплава поваренной соли 4) расплавленного оксида 5) раствора оксида в расплавленном криолите 6) расплавленного нитрата |
Ответ:
| А | Б | В | Г |
175. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ 1) водород 2) кислород 3) металл 4) галоген 5) сера 6) азот |
Ответ:
| А | Б | В | Г |
176. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ 1) водород 2) кислород 3) серебро 4) калий 5) кальций 6) медь |
Ответ:
| А | Б | В | Г |
177. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ 1) фтор 2) оксид азота(IV) 3) кислород 4) водород 5) бром 6) этан и углекислый газ |
Ответ:
| А | Б | В | Г |
178. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ

|
Ответ:
| А | Б | В | Г |
179. Установите соответствие между формулой соли и продуктом(-ами), образующимся на катоде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ

|
Ответ:
| А | Б | В | Г |
180. Установите соответствие между формулой соли и продуктами электролиза её водного раствора, которые выделились на инертных электродах.
ФОРМУЛА СОЛИ

| ПРОДУКТЫ ЭЛЕКТРОЛИЗА 1) металл, кислород 2) металл, водород 3) металл, хлор 4) водород, хлор 5) водород, кислород 6) водород, азот |
Ответ:
| А | Б | В | Г |
181. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА АНОДЕ

|
Ответ:
| A | Б | В | Г |
182. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе водного раствора этой соли.
ФОРМУЛА СОЛИ

| ПРОДУКТ НА КАТОДЕ
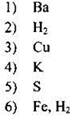
|
Ответ:
| A | Б | В | Г |
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Элементы содержания данного блока, усвоение которых проверяются заданиями, включёнными в этот блок, указаны в таблице 2.
Таблица 2
| Проверяемые элементы содержания | Уровень сложности задания, проверяющего усвоение элемента содержания |
| Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная). | Б |
| Характерные химические свойства простых веществ - металлов: щелочных, щелочноземельных, алюминия, переходных металлов - меди, цинка, хрома, железа. Характерные химические свойства простых веществ - неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния | Б |
| Характерные химические свойства оксидов: основных, амфотерных, кислотных | Б |
| Характерные химические свойства оснований и амфотерных гидроксидов. Характерные химические свойства кислот | Б |
| Характерные химические свойства солей: средних, кислых, основных; комплексных (на примере соединений алюминия и цинка) | Б |
| Характерные химические свойства неорганических веществ: простых веществ (металлов и неметаллов); оксидов; оснований и амфотерных гидроксидов; кислот; солей | П |
| Взаимосвязь различных классов неорганических веществ | Б, В |

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!