

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
|
Во многих случаях удобно использовать молярную теплоемкость C:
|
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).
В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует
|
|
|
Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры.
Для процесса при постоянном давлении первый закон термодинамики дает:
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:
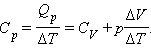
|
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
| pV = RT, |
где R – универсальная газовая постоянная. При p = const
 или или 
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| Cp = CV + R. |
53 Адиабатный и политропный процессы
Адиабатный и политропные процессы.
Политропический процесс, это такой процесс, при котором давление и объём идеального газа связаны соотношением 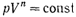 .
.
Адиабатический процесс — термодинамический процесс в макроскопической системе, при котором система не получает и не отдаёт тепловой энергии  .
.
54.обротимые и необраимые процессы. Квазистатические процессы. 2ое начало термодинамики
Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
|
|
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия, теплопроводность, вязкое течение и другое
Квазистатический процесс в термодинамике — идеализированный процесс, состоящий из непрерывно следующих друг за другом состояний равновесия.
Основное значение квазистатических процессов состоит в том, что данная модель значительно упрощает исследования в области термодинамики. Такая легкость объясняется тем, что при мгновенном описании состояния системы, совершающей квазистатический процесс, требуется одинаковое количество параметров, как и для макроскопического описания равновесного состояния. Квазистатические процессы не реализуются в природе, но являются хорошей моделью для приближения процессов, протекающих достаточно медленно (для квазистатического процесса скорость изменения макроскопического параметра 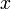 должна удовлетворять условию
должна удовлетворять условию  , где
, где  — время релаксации,
— время релаксации, 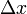 — характерный масштаб изменения величины
— характерный масштаб изменения величины 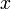 ).
).
Существуют несколько эквивалентных формулировок второго начала термодинамики:
· Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» [1] (такой процесс называется процессом Клаузиуса).
· Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Для любой квазиравновесной термодинамической системы существует однозначная функция термодинамического состояния S = S (T, x, N), называемая энтропией, такая, что ее полный дифференциал dS = δ Q / T.
55. энтропия и законы ее возрастания. Тепловые машины. Цикл Карно. Максимальный КПД тепловой машины.
Тепловые двигатели и их КПД. Цикл Карно и его КПД.
Тепловой двигатель — устройство, совершающее работу за счет использования внутренней энергии топлива, тепловая машина, превращающая тепло в механическую энергию использует зависимость теплового расширения вещества от температуры. Действие теплового двигателя подчиняется законам термодинамики.
(КПД) теплового двигателя рассчитывается как отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:

часть теплоты при передаче неизбежно теряется, поэтому КПД двигателя менее 1. Максимально возможным КПД обладает двигатель Карно. КПД двигателя Карно зависит только от абсолютных температур нагревателя(TH) и холодильника(TX):

|
|
Максимальный КПД тепловой машины.
Максимально возможным КПД обладает двигатель Карно. КПД двигателя Карно зависит только от абсолютных температур нагревателя(TH) и холодильника(TX):
 .
.
Видно, что 100%-ный КПД можно получить только в том случае, если температура холодильника есть абсолютный нуль, что недостижимо. Можно показать, что КПД тепловой машины Карно максимален в том смысле, что никакая тепловая машина с теми же температурами нагревателя и холодильника не может обладать большим КПД.
56. Фазы и фазовые превращения. Фазовые диограммы. Условие равновесия фаз. Тройная точка. Уравнение клайперона-клазиуса
Фа́зовыйперехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий.
Наиболее распространённые примеры фазовых переходов первого рода:
· плавление и кристаллизация
· испарение и конденсация
· сублимация и десублимация
Фа́зоваядиагра́мма (диаграмма состоя́ния) — графическое отображение равновесного состояния бесконечной физико-химической системы при условиях, отвечающих координатам рассматриваемой точки на диаграмме (носит название фигуративной точки)
Условие равновесия
Рассмотрим химически однородную систему (состоящую из частиц одного типа). Пусть в этой системе имеется граница раздела между фазами 1 и 2. Как было указано выше, для равновесия фаз требуется равенство температур и давлений на границе раздела фаз. Известно (см. статью Термодинамические потенциалы), что состояние термодинамического равновесия в системе с постоянными температурой и давлением соответствует точке минимума потенциала Гиббса.
Потенциал Гиббса такой системы будет равен
|
|
·  ,
,
где μ1 и μ2 — химические потенциалы, а N 1 и N 2 — числа частиц в первой и второй фазах соответственно.
При этом сумма N = N 1 + N 2 (полное число частиц в системе) меняться не может, поэтому можно записать
·  .
.
Предположим, что  , для определенности,
, для определенности,  . Тогда, очевидно, минимум потенциала Гиббса достигается при
. Тогда, очевидно, минимум потенциала Гиббса достигается при  (все вещество перешло в первую фазу).
(все вещество перешло в первую фазу).
Таким образом, равновесие фаз возможно только в том случае, когда химические потенциалы этих фаз по разные стороны границы раздела равны:
·  .
.
Уравнение

57. Характеристика жидкого состояния. Поверхносное натяжение.
Пове́рхностноенатяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объем системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Добавочное давление в точке поверхности зависит от средней кривизны в этой точке и даётся формулой Лапласа:

Например, для сферы центры кривизны в любой точке поверхности совпадают с центром сферы, поэтому
R 1 = R 2 = R
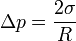
Для случая поверхности кругового цилиндра радиуса R имеем


58. Явления на границе жидкости и твердого тела. Капиллярные явления
КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ - совокупность явлений, обусловленных действием межфазного поверхностного натяжения на границе раздела несмешивающихся сред; к К. я. обычно относят явления в жидкостях, вызванные искривлением их поверхности, граничащей с др. жидкостью, газом или собств. паром. К. я.- частный случай поверхностных явлений. В отсутствие силы тяжести поверхность жидкости искривлена всегда. Под воздействием поверхностного натяжения ограниченный объём жидкости стремится принять форму шара, т. е. занять объём с мин. поверхностью.
|
|
|

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!