Под скоростью элементарной химической реакции подразумевается число элементарных актов, совершающихся в единицу времени в единице реакционного объема или на единице реакционной поверхности (для гомогенных реакций изменение молярных концентраций реагирующих веществ).
Закон действующих масс- скорость элементарной химической реакции пропорциональная произведению концентраций реагирующих веществ в степенях равных стехиометрическим коэффициентам в уравнении реакции. (Гульдберг и Вааге)
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции 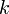 от температуры
от температуры  .
.

Константа скорости элементарной реакции. Энергия активации.
Энергия активации- минимальная пороговая энергия, которой должны обладать встретившиеся частицы, для того чтобы произошла химическая реакция
Константа скорости- коэффициент пропорциональности в кинетическом уравнении химической реакции, выражающем зависимость скорости реакции от концентрации какого-либо из компонентов реакционной смеси.
Сложные реакции. Кинетический порядок реакции. Зависимость скорости реакции от температуры.
Сложные реакции- реакции, протекающие через ряд последовательных стадий, каждая из которых представляет собой моно-, би- или тримолекулярную элементарную реакцию.
КПР-сумма показателей степеней кинетического уравнения реакции (V=k*Cax*Cyb)
Из уравнения Аррениуса. (+ Вант-Гофф установил, что при увеличении температуры на 10 скорость химической реакции возрастает примерно в 2-4 раза)
Формальная кинетика. Кинетические уравнения химической реакции.
Изменение концентрации реагирующих веществ во времени. Кинетика первого и второго порядка.
Цепной механизм химической реакции.
Исходные вещества превращаются в продукты реакции в результате протекания ряда регулярно повторяющихся элементарных реакций с участием свободных радикалов (атомы, имеющие неспаренные электроны) и атомов. При протекании элементарного акта свободные радикалы взаимодействуют с молекулами реагентов с образованием продуктов реакции и новых радикалов.
Зарождение цепи: в цепи появляется активная частица-радикал. Развитие цепи: происходит большое количество элементарных повторяющихся актов (разветвленная (более чем одна активная частица)и неразветвленная). Обрыв цепи: исчезновение активных частиц.
Фотохимические реакции.
Фотохимические реакции — химические реакции, которые инициируются воздействием электромагнитных волн, в частности — светом. Примерами фотохимических реакций являются фотосинтез в растениях, распад бромида серебра в светочувствительном слое фотопластинки, превращение молекул кислорода в озон в верхних слоях атмосферы. Основными требованиями для фотохимических реакций являются:
- энергия источника излучения должна соответствовать энергии электронного перехода между орбиталями;
- излучение должно быть способным достичь целевых функциональных групп и не быть заблокированным реактором и другими функциональными группами.
Гетерогенные реакции.
В гетерогенных химических реакциях процесс взаимодействия реагентов протекает на границе раздела фа з (твердое тело газ, твердое тело-жидкость) и включает в себя три стадии:
· Подвод реагирующих веществ к реакционной поверхности;
· Химическая реакция (простая или сложная);
· Отвод продуктов химической реакции от реакционной поверхности.
Горение и взрыв.
Быстропротекающие экзотермические реакции химического превращения веществ могут осуществляться в режимах горения или взрыва. При их протекании отдельные части системы имеют различную температуру и различный химический состав. Реакции, возникающие в какой-либо части системы, самоускоряются, достигают максимально возможной скорости и распространяются на всю систему.
При протекании взрывчатых превращений в системе можно выделить три области: область исходных веществ, область химической реакции, область продуктов реакции.
Горение- физико-химический процесс, при котором превращение вещества сопровождается интенсивным выделением энергии и тепло- и массообменном с окружающей средой (без взрывной волны)
Взрыв- выделение большого количества энергии в ограниченном объеме вещества за короткий промежуток времени с образованием взрывной волны.



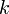 от температуры
от температуры  .
.


