

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
Топ:
Теоретическая значимость работы: Описание теоретической значимости (ценности) результатов исследования должно присутствовать во введении...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Из основного уравнения молекулярно-кинетической теории (см. формулу (14)) следует закон Авогадро: в равных объемах разнородных газов при одинаковых условиях (одинаковой температуре и одинаковом давлении) содержится одинаковое число молекул:
 (для одного газа),
(для одного газа),
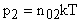 (для другого газа).
(для другого газа).
Если V1 = V2; Т1 = Т2; 1 = 2, то n01 = n02.
Напомним, что единицей количества вещества в системе СИ является моль (грамммолекула) масса одного моля вещества называется молярной массой этого вещества. Число молекул, содержащихся в одном моле разных веществ одинаково и называется число Авогадро (NA = 6,021023 1/моль).
Запишем уравнение состояния идеального газа для одного моля:
 , где V - объем одного моля газа;
, где V - объем одного моля газа;  (универсальная газовая постоянная).
(универсальная газовая постоянная).
Окончательно имеем:  (26).
(26).
Уравнение (26) называется уравнением Клапейрона (для одного моля газа). При нормальных условиях (р = 1,013105 Па и Т = 273,150К) молярный объем любого газа Vm = 22,410-3  . Из формулы (26) определим
. Из формулы (26) определим  ;
;  . От уравнения (26) для моля газа можно перейти к уравнению Менделеева-Клапейрона для любой массы газа m. Отношение
. От уравнения (26) для моля газа можно перейти к уравнению Менделеева-Клапейрона для любой массы газа m. Отношение  дает число молей газа. Левую и правую части неравенства (26) умножим на
дает число молей газа. Левую и правую части неравенства (26) умножим на  . Имеем
. Имеем  , где
, где  (объем газа). Окончательно запишем:
(объем газа). Окончательно запишем:  (27). Уравнение (27) - уравнение Менделеева-Клапейрона. В это уравнение можно внести плотность газа
(27). Уравнение (27) - уравнение Менделеева-Клапейрона. В это уравнение можно внести плотность газа 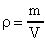 и
и  . В формуле (27) заменим V и получим
. В формуле (27) заменим V и получим  или
или  (28).
(28).
9.Опытные газовые законы. Давление смеси идеальных газов (закон Дальтона)
Опытным путем, задолго до появления молекулярно-кинетической теории, был открыт целый ряд законов, описывающих равновесные изопроцессы в идеальном газе. Изопроцесс - это равновесный процесс, при котором один из параметров состояния не изменяется (постоянен). Различают изотермический (T = const), изобарический (p = const), изохорический (V = const) изопроцессы.
|
|
Изотермический процесс описывается законом Бойля-Мариотта: "если в ходе процесса масса и температура идеального газа не изменяются, то произведение давления газа на его объем есть величина постоянная  (29). Графическое изображение уравнения состояния называют диаграммой состояния. В случае изопроцессов диаграммы состояния изображаются двумерными (плоскими) кривыми и называются соответственно изотермами, изобарами и изохорами.
(29). Графическое изображение уравнения состояния называют диаграммой состояния. В случае изопроцессов диаграммы состояния изображаются двумерными (плоскими) кривыми и называются соответственно изотермами, изобарами и изохорами.
Изотермы, соответствующие двум разным температурам, приведены на рис. 6.
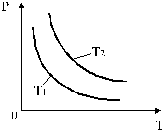
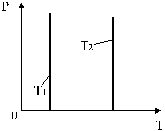

Рис. 6
Изобарический процесс описывается законом Гей-Люссака: "если в ходе процесса давление и масса идеального газа не изменяются, то отношение объема газа к его абсолютной температуре есть величина постоянная:
 (30).
(30).
Изобары, соответствующие двум разным давлениям, приведены на рис.7.



Рис. 7
Уравнение изобарического процесса можно записать иначе:
 (31), где V0 - объем газа при 00С; Vt - объем газа при t0C; t - температура газа в градусах Цельсия; - коэффициент объемного расширения. Из формулы (31) следует, что
(31), где V0 - объем газа при 00С; Vt - объем газа при t0C; t - температура газа в градусах Цельсия; - коэффициент объемного расширения. Из формулы (31) следует, что  . Опыты французского физика Гей-Люссака (1802 г) показали, что коэффициенты объемного расширения всех видов газов одинаковы и
. Опыты французского физика Гей-Люссака (1802 г) показали, что коэффициенты объемного расширения всех видов газов одинаковы и  , т.е. при нагревании на 10С газ увеличивает свой объем на
, т.е. при нагревании на 10С газ увеличивает свой объем на  часть того объема, который он занимал при 00С. На рис. 8 изображен график зависимости объема газа Vt от температуры t0C.
часть того объема, который он занимал при 00С. На рис. 8 изображен график зависимости объема газа Vt от температуры t0C.

Рис. 8
Изохорический процесс описывается законом Шарля: "если в ходе процесса объем и масса идеального газа не изменяются, то отношение давления газа к его абсолютной температуре есть величина постоянная:
 (32)
(32)
Изохоры, соответствующие двум разным объемам, приведены на рис. 9.

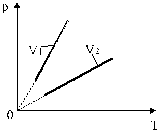

Рис. 9
Уравнение изохорического процесса можно записать иначе:
 (33),
(33),
где  - давление газа при
- давление газа при  С;
С;  - давление газа при t; t - температура газа в градусах Цельсия;
- давление газа при t; t - температура газа в градусах Цельсия;  - температурный коэффициент давления. Из формулы (33) следует, что
- температурный коэффициент давления. Из формулы (33) следует, что  . Для всех газов
. Для всех газов  и
и  . Если газ нагреть на
. Если газ нагреть на  С (при V=const), то давление газа возрастет на
С (при V=const), то давление газа возрастет на  часть того давления, которое он имел при
часть того давления, которое он имел при  С.
С.
|
|
На рис.10 изображен график зависимости давления газа от температуры t.

Рис. 10
Если продолжить прямую AB до пересечения ее с осью x (точка  ), то значение абциссы этой определиться из формулы (33), если
), то значение абциссы этой определиться из формулы (33), если  приравнять нулю.
приравнять нулю.
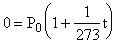
 ;
;  .
.
Следовательно, при температуре  давление газа должно было бы обратиться в нуль, однако, при подобном охлаждении газ не сохранит своего газообразного состояния, а обратиться в жидкость и даже в твердое тело. Температура
давление газа должно было бы обратиться в нуль, однако, при подобном охлаждении газ не сохранит своего газообразного состояния, а обратиться в жидкость и даже в твердое тело. Температура  носит название абсолютного нуля.
носит название абсолютного нуля.
В случае механической смеси газов, не вступающих в химические реакции, давление смеси также определяется формулой  , где
, где  (концентрация смеси
(концентрация смеси  равно сумме концентраций компонентов смеси всего n - компонент).
равно сумме концентраций компонентов смеси всего n - компонент).
Закон Дальтона гласит: Давление смеси  равно сумме парциальных давлений газов, образующих смесь.
равно сумме парциальных давлений газов, образующих смесь.  . Давления
. Давления  называется парциальными. Парциальное давление - это давление которое создавал бы данный газ, если бы он один занимал тот сосуд, в котором находится смесь (в том же количестве, в котором он содержится в смеси).
называется парциальными. Парциальное давление - это давление которое создавал бы данный газ, если бы он один занимал тот сосуд, в котором находится смесь (в том же количестве, в котором он содержится в смеси).
Примеры решения задач.
Пример 1. Баллон содержит  г кислорода и
г кислорода и  г аргона. Давление смеси
г аргона. Давление смеси  МПа, температура
МПа, температура  К. Принимая данные газы за идеальные, определить V баллона.
К. Принимая данные газы за идеальные, определить V баллона.
Решение. По закону Дальтона давление смеси Р равно равно сумме парциальных давлений кислорода и аргона, входящих в состав смеси.  . По уравнению Менделеева-Клапейрона, парциальные давления кислорода
. По уравнению Менделеева-Клапейрона, парциальные давления кислорода  и аргона
и аргона  выражаются формулами:
выражаются формулами:  и
и  ; где
; где
V - объем баллона,
 - масса кислорода,
- масса кислорода,
 - масса аргона,
- масса аргона,
 - молярная масса кислорода,
- молярная масса кислорода,
 - молярная масса аргона,
- молярная масса аргона,
Т - температура смеси,
R - универсальная газовая постоянная.
Давление смеси газов  если
если
 . Откуда объем баллона
. Откуда объем баллона  .
.
Расчет в СИ:  кг;
кг;  ;
;  кг;
кг; 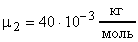 ;
; 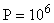 Па;
Па;  ;
;  .
.
 или V=26.2 л.
или V=26.2 л.
Пример 2. Во сколько раз изменится давление гелия, если его объем уменьшим в три раза, а средняя кинетическая энергия движения молекул увеличится в два раза.
Решение. Пусть объем гелия в первом состоянии  ; во втором состоянии -
; во втором состоянии - 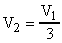 . Средняя кинетическая энергия поступательного движения в первом состоянии -
. Средняя кинетическая энергия поступательного движения в первом состоянии - 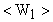 ; а во втором состоянии -
; а во втором состоянии -  . Согласно основному уравнению молекулярно-кинетической теории
. Согласно основному уравнению молекулярно-кинетической теории  ,
,  ; n - общее число молекул, которое остается постоянным; V- объем газа. Запишем уравнение для двух состояний газа
; n - общее число молекул, которое остается постоянным; V- объем газа. Запишем уравнение для двух состояний газа  или, заменяя
или, заменяя 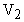 и
и  систему уравнений запишем в виде:
систему уравнений запишем в виде:
|
|
 (А),
(А),
 (В),
(В),
Разделим формулу (В) на формулу (А):  .
.
Давление гелия увеличилось в 6 раз.
Пример 3. Найти плотность воздуха при нормальных условиях.
Решение. Используем формулу (28)  . Откуда
. Откуда  .
.
Расчет в СИ:Нормальные условия:
 Па,
Па,  К. Для воздуха
К. Для воздуха  ;
;

 .
.
Пример 4. В сосуде под давлением 1 МПа и при температуре  С находиться 11 г углекислого газа и 14 г азота. Найти молекулярную массу смеси и объем сосуда.
С находиться 11 г углекислого газа и 14 г азота. Найти молекулярную массу смеси и объем сосуда.
Решение. Молекулярную массу смеси  определяем из формулы:
определяем из формулы:
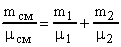 . Откуда
. Откуда 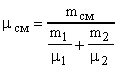 . Так как
. Так как  ,
,
то  .
.
Расчет в СИ:

 .
.
Объем сосуда найдем из уравнения Менделеева-Клапейрона
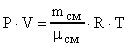 , где
, где 
 ;
;  ;
;


Пример 5. Компрессор засасывает из атмосферы каждую секунду 3 л воздуха, которые подаются в баллон емкостью 45 л. Через какое время давление в баллоне будет превышать атмосферное в 9 раз?
Дано: Решение:
V0= 3 л = 3*10-3 м3
V2= 45 л = 45*10-3 м3 Рассмотрим два состояния газа.
Р2=9*Р1 Первое состояние - газ находится в атмосфере в
свободном состоянии, занимая объем
t -? V1= V0* t, где t - время накачивания,
Р1 - атмосферное давление.
Второе состояние - газ заключили в сосуд объемом V2 и давление при этом равно Р2. По закону Бойля-Мариотта (при Т=const) имеем:
Р1*V1 = Р2*V2 или, заменяя V1 и Р2, запишем:
Р1*V0*t = 9*Р1V2. Откуда 19.06.97 t = 9V2/V0.
Расчет: t = 9*45*10-3/3*10-3 = 135 c.
Пример 6. Сколько молекул воздуха находится в 1 см3 при 100С, если воздух в сосуде откачан до давления 1.33 мкПа?
Дано: Решение:
V = 1 см3 = 10-6 м3 Число молекул воздуха можно найти
Т = 283 К n = (m/)NA, где NA - число Авагадро.
Р = 1.33 мкПа = 1.33*10-6 Па Число молей в 1 см3 можно определить из
уравнения Менделеева-Клаперона:
n =? P*V = (m/) R*T. Откуда m/ =
Окончательно имеем: n = NA (P*V)/(R*T)
Расчет в СИ: n = 6/02*1023(1.33*10-6*10-6)/(8/31*283)=3/4*108
Пример 7. В озере на глубине 100 м при температуре 80С находится в равновесии шар массой 40 г, наполненный воздухом. Найти массу воздуха внутри шара, если атмосферное давление 99.7 кПа. Шар считать тонкостенным, изготовленным из резины.
Дано: Решение:
h = 100 м F На шар, погруженный в воду,
Т = 281 К действует сила тяжести Р = mg;
m = 40 г = 4*10-2 кг выталкивающая сила воды
Рат = 103 кг/м3 P = mg F=*g*V, где -плотность воды,
m1 -?
а V= m/ (объем шара). Массу воздуха внутри шара найдем из уравнения Менделеева-Клаперона:
|
|
m1 = (*Р*V)/R*T, где Р = Рат+ Ргидр.
Ргидр= *g*h (гидравлическое давление на глубине h). Окончательно получаем:
m1 = [*(Рат+ *g*h)*m]/(R*T*)/
Расчет: m1 = [29*10-3(99/7*103+103*9/8*102)*4*10-2]/8.31*281*1035.36*10-4 кг
Пример 8. Определить плотность смеси, состоящей из 4 г водорода и 32 г кислорода, при температуре 70С и давлении 93 кПа.
Дано: Решение:
m1 = 4 u = 4*10-3 кг По закону Дальтона давление смеси Р = Р1 + Р2,
1 = 2*10-3 кг/моль где Р1 и Р2 - порциальные давления водорода и
2 = 32*10-3 кг/моль кислорода при данных условиях. Для каждого
Р = 93 кПа = 93*103 Па из газов запишем уравнение Менделеева -
Т = 280 К Клапейрона: Р1*V1 = (m1/1)R*Т1 и
R = 8.31 Дж/моль 0К Р2*V2 = (m2/2)R*Т2 по условию
задачи V1 = V2 = V и Т1 = Т2 = Т.
-? Тогда для водорода Р1*V = (m1/1)R*Т. Откуда
1 = (m1*R*T)/(1*V).
Аналогично для кислорода получим 2 = (m2*R*T)/(2*V).
Окончательно имеем: = (m1*R*T)/(1*V) + (m2*R*T)/(2*V) =
(R*T/V)(m1/1+ m2/2). Откуда
V = (R*T/) (m1/1+ m2/2)
Плотность смеси газов = m/V = (m1+m2)/V. Заменив объем, найдем
= (m1+m2)*P/[R*T*(m1/1+ m2/2)]
=(4*10-3+32*10-3)*93*103/[8/31*280(4*10-3/2*10-3 + 32*10-3/32*10-3)]0.48 кг/м3.
Пример 9. Посередине запаянного с обеих сторон капилляра, расположенного горизонтально, находится столбик ртути длиной 10 см. Если капилляр поставить вертикально, то столбик ртути сместится на 15 см. Длина капилляра 1 м. До какого давления был откачан капилляр?
Решение:
В обоих концах капилляра (верхней части и нижней части, первоначально воздух занимал объем V0 = (L - h)S/2, где S - площадь поперечного сечения капилляра: Р0 - давление воздуха (в верхней и нижней частях капилляра).
Когда трубку поставили вертикально, то (см. рис) объем воздуха в верхней части капилляра стал V1 = [(L - h)/2 + l) S = (L - h + 2 l)S/2, а давление Р1. В нижней части капилляра объем стал V2 = [(L - h)/2 - l) S = (L - h - 2 l) S/2, а давление Р2.
Для верхней части капилляра запишем закон Бойля-Мариотта:
P0V0 = P1V1 или P0(L - h)S/2 = P1(L - h + 2 l)S/2
P0(L - h) = P1(L - h + 2 l) (A)
Для нижней части капилляра запишем закон Бойля-Мариотта P0V0 = P2V2 или P0(L - h)S/2 = P2(L - h - 2 l)S/2.
P0(L - h) = P2(L - h - 2 l) (B)
Известно, что столбик ртути находится в равновесии, если давление воздуха в нижней части капилляра Р2 равно сумме давлений воздуха в верхней части капилляра Р1 и гидростатического давления столбика ртути Ргидр = gh, ( - плотность ртути), т.е. Р2 = Р1 + Ргидр = Р1 + gh.
Сравнивая формулы (А) и (В), имеем:
P1 (L - h + 2 l) = P2(L - h - 2 l) (C)
В формуле (С) заменим P2.
P1(L - h + 2 l) = (P1 + gh) (L - h - 2 l). Выразим P1.
P1(L - h + 2 l) = P1 (L - h - 2 l) + gh (L - h - 2 l),
P1[(L - h + 2 l - (L - h - 2 l)] = gh (L - h - 2 l),
P1 4 l = gh (L - h - 2 l),
P1 = gh (L - h - 2 l)/(4 l).
Найденное значение Р1 подставим в формулу (А),
 . Откуда найдем Р0
. Откуда найдем Р0
 или
или 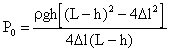 .
.
Расчет в СИ: h = 10 см = 0.1 м, = 13.6*103 кг/м3, g = 9.8 м/с2, L = 1 м, l = 15 см = 15*10-2 м.
 .
.
Пример 10. Водолазный колокол высотой h = 3 м с постоянным поперечным сечением опускается в море на глубину H = 80 м. Определить, до какой высоты h0 поднимется вода в колоколе, когда он достигнет глубины H, если температура у поверхности воды t1 = 20o C, а на глубине Н температура t2 = 7o C. Определить, до какого давления Р0 надо довести воздух, нагнетаемый в колокол, чтобы плотностью удалить из колокола воду. Плотность морской воды = 1030 кг/м3.
|
|
Решение:
Так как масса воздуха в колоколе при погружении не изменяется, то для этого процесса (для двух положений колокола: у поверхности воды и на глубине Н) запишем уравнение Менделеева-Клапейрона дважды:
Откуда  (А), сечение S колокола постоянно по высоте, поэтому V1 = hS, V2 = (h - h0)S. С учетом этого уравнения (А) запишем в виде
(А), сечение S колокола постоянно по высоте, поэтому V1 = hS, V2 = (h - h0)S. С учетом этого уравнения (А) запишем в виде
 (В)
(В)
Знаем, что P1 = Pатм и Р2 = Ратм + gН.
Величина (gh) - гидростатическое давление воды на глубине Н; Ратм - атмосферное давление. После замены Р1 и Р2 в формуле (В) получим выражение
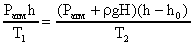 , откуда
, откуда
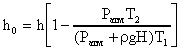 .
.
Расчет в СИ: Pатм = 1.013*105 Па; T1 = 293 K; T2 = 280 K; = 1030 кг/м3; g = 9.8 м/с2; Н = 80 м; h = 3 м.
 .
.
Давление Р0 воздуха для полного вытеснения воды из колокола, найдем по закону Бойля-Мариотта, учитывая, что температура воздуха в колоколе в процессе вытеснения воды не изменяется, т.к. глубина погружения колокола в этом процессе остается постоянной.
 или (после замены P2, V1, V2)
или (после замены P2, V1, V2)
(Ратм + gh)(h - h0)S = P0hS
(Ратм + gh)(h - h0) = P0h. Откуда
 .
.
Полагая h0 = 0, получим:
Р0 = (Ратм + gH) = (1.013*105 + 1030*9.8*80) Па
P0 9.1*105 Па 9 атм.
11.Задачи для самостоятельного решения
1. Определить количество молекул воздуха в комнате 8х5х4 м3 при температуре 100С и давлении 78 см.рт.ст. Ответ: 40,81026.
2. Резиновый шар содержит 2 л воздуха при температуре 200С и атмосферном давлении 780 мм.рт.ст. Какой объем займет воздух, если шар опустить в воду, имеющую температуру 40С, на глубину 10м? До какого давления надо довести воздух, чтобы его объем остался неизменным? Ответ: 0,97 л; 1606 мм.рт.ст.
3. Газ сжат изотермически от V1 = 8л до V2 = 6л. Давление при этом возросло на p = 4кПа. Каково было первоначальное давление? Ответ: 12 кПа.
4. Газ нагрет от 270С до 390С. На сколько процентов увеличится объем, если давление газа постоянно? Ответ: на 0,4 %.
5. Открытую с обеих сторон стеклянную трубку длиной 60 см опускают на 1/3 длины в сосуд с ртутью. Затем, закрыв верхний конец, трубку вынимают из ртути. Какой длины столбик ртути останется в трубке? Атмосферное давление 105Па. Ответ: 18 см.
6. Воздушный шар объемом 1000 м3 наполнен водородом при температуре 2930К. При неизменном давлении температура поднялась до 3130К, благодаря чему вышел излишек газа. Найти объем этого излишка. Ответ: 70 м3.
7. Летчик, находясь на земле, при каждом дыхании при нормальных условиях вдыхает 1 г кислорода. Какое количество кислорода вдыхает летчик, поднявшись на высоту, где давление воздуха 400 мм.рт.ст? Изменением температуры воздуха пренебречь. Ответ: 0,53 г.
8. Определить плотность смеси, состоящей из 4 г водорода и 32 г кислорода при температуре 70С и давлении 93 кПа. Ответ: 0,48 кг/м3.
9. Сколько молекул воздуха находится в 1 см3 сосуда при 100С, если воздух в сосуде откачан до давления 1,33 мкПа? Ответ: 3,4108.
1. Теплопередача
Теплопередача (теплообмен) - это процесс обмена энергией между системой и окружающими ее телами; при этом нет изменения внешних параметров состояния системы (P, V, T). Теплопередача осуществляется либо путем непосредственного взаимодействия частиц системы с частицами среды при их случайных столкновениях (теплопроводность, конвекция), либо путем обмена электромагнитным излучением (лучеиспускание). Например, при столкновении "холодного" и "горячего" газов молекулы нагретого газа передают энергию (при случайных столкновениях) молекулам холодного газа. Вода в море в дневное время прогревается (получает энергию) за счет излучения, посылаемого Солнцем. Энергия, полученная или отданная системой в процессе теплопередачи, называется количеством тепла. Количество тепла Q измеряется в Джоулях (Дж) и является величиной скалярной. Q > 0 (положительная величина), если система получает тепло; Q < 0 (отрицательная величина), если система отдает тепло.
2. Нагревание и охлаждение веществ. Удельная теплоемкость вещества
Нагревание - процесс, при котором при подводе количества тепла Q температура вещества (твердого тела, жидкости или газа) линейно повышается (рис. 1). Количество тепла, необходимое для нагревания вещества массой m, определяется по формуле
 (1)
(1)
где t1 и t2 - начальная и конечная температуры нагрева; с - удельная теплоемкость вещества.

Рис.1
Охлаждение - процесс, при котором при отводе количества тепла Q температура вещества линейно понижается (рис. 2).
В обоих случаях температура тела, либо повышается, либо понижается на  градусов.
градусов.
Из формулы (1) следует
 . (2)
. (2)

Рис. 2
Удельная теплоемкость вещества - величина, равная количеству тепла, необходимому для нагревания единицы массы вещества на один градус. Удельная теплоемкость измеряется в  . (К - градус по шкале Кельвина). Значения С для различия веществ берут из таблицы 1.
. (К - градус по шкале Кельвина). Значения С для различия веществ берут из таблицы 1.
3. Плавление и кристаллизация. Удельная теплота плавления.
Плавление - процесс превращения твердого тела в жидкость. Этот процесс для разных веществ происходит при определенной температуре плавления (см. табл. 1). Пока твердое тело не расплавится температура плавления tпл остается постоянной (рис. 3).
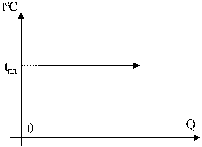
Рис. 3
Обратный процесс, при котором жидкость переходит в твердую фазу, называется кристаллизацией. Количество тепла Q, которое нужно для плавления вещества массой m, можно рассчитать как
 , (3)
, (3)
где - удельная теплота плавления. Удельная теплота плавления равна количеству тепла, необходимому для расплавления единицы массы вещества. Измеряется величина в Джоулях на килограмм  . Значения удельной теплоемкости для некоторых веществ даны в табл. 1.
. Значения удельной теплоемкости для некоторых веществ даны в табл. 1.
Таблица 1
| Вещество | Удельная теплоемкость С, кДж/кгК | Удельная теплота плавления , кДж/кг | Температура плавления tпл, С |
| Вода | 4,19 | ||
| Лед | 2,10 | ||
| Алюминий | 0,88 | ||
| Свинец | 0,13 | ||
| Сталь | 0,50 | ||
| Медь | 0,38 | ||
| Железо | 0,46 |
4. Парообразование и конденсация. Удельная теплота парообразования
Парообразование (кипение) - процесс превращения жидкости в пар. Этот процесс для разных жидкостей происходит при конкретной температуре кипения (см. табл. 2). Пока жидкость кипит, температура кипения tкип остается неизменной (рис. 4).

Рис. 4
Обратный процесс, при котором пар переходит в жидкость, называют конденсацией.
Количество тепла, необходимое для превращения жидкости массой m в пар:
 , (4)
, (4)
где r - удельная теплота парообразования
 . (5)
. (5)
Удельная теплота парообразования равна количеству тепла, которое нужно для превращения единицы массы жидкости в пар. Величина r измеряется в Джоулях на килограмм  . Значения удельной теплоты парообразования некоторых жидкостей приведены в табл. 2.
. Значения удельной теплоты парообразования некоторых жидкостей приведены в табл. 2.
5. Горение топлива. Удельная теплота сгорания
Количество тепла, выделяющееся при сгорании топлива массой m рассчитывается по формуле:
 (6),
(6),
где q - удельная теплота сгорания топлива.
 (7).
(7).
Удельная теплота сгорания топлива q численно равна количеству тепла, выделенному при сгорании единицы массы топлива. Величина q измеряется в Джоулях на килограмм  . Значения q для некоторых видов топлива представлены в табл. 2.
. Значения q для некоторых видов топлива представлены в табл. 2.
Таблица 2.
| Вещество | температура кипения tкип, С | Удельная теплота парообразования r, МДж/кг | Удельная теплота сгорания топлива q, МДж/кг |
| Вода | 2,26 | ||
| Спирт | 0,86 | ||
| Ртуть | 0,29 | ||
| Керосин | 0,21 | ||
| Бензин | |||
| Каменный уголь | |||
| Дерево |
6. Коэффициент полезного действия (КПД) нагревательных приборов
КПД нагревательных приборов определяется выражением
 (8),
(8),
где Qпол - полезное тепло, идущее на нагревание тел, их плавление и парообразование; Qзатр - тепло, выделяющееся при сгорании топлива. Если нагревательный прибор включается в электрическую сеть, то под Qзатр понимают работу электрического тока.
7. Уравнение теплового баланса
Если между двумя или несколькими телами, входящими в изолированную систему, происходит теплообмен, то количество тепла, отданного всеми остывающими телами, равно количеству тепла, полученного всеми нагревающимися телами.
Это положение называют уравнением теплового баланса.
Пример. В сосуде, изолированном в тепловом отношении от окружающей среды, смешали m1 кг горячей воды при температуре t1C c m2 кг холодной воды при температуре t2C. Найти окончательную температуру смеси ( - буква греческого алфавита, читается: тэта).
Количество тепла, отданное остывающим телом (горячей водой):
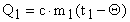 .
.
Количество тепла, полученного нагревающимся телом (холодной водой):

Уравнение теплового баланса
Q1 = Q2 или cm1(t1 - ) = cm2( - t2),
откуда  .
.
Эта формула впервые получена Г.Рихманом, членом Петербургской Академии Наук, другом и сотрудником М.В.Ломоносова.
8. Примеры решения задач
Пример 1. В калориметр, теплоемкость которого  , содержащий
, содержащий
270 г воды при 12 С, опустили кусок алюминия массой 200 г, нагретый до 100С. Общая температура установилась 23С. Определить удельную теплоемкость алюминия.
Дано:
 ; = 23С; t1 = 12С; c2 = 4190
; = 23С; t1 = 12С; c2 = 4190  ; t2 = 12С;
; t2 = 12С;
m2 = 0,27 кг; m3 = 0,2 кг; t3 = 100С.
Найти: с3.
Решение:
Теплоемкость калориметра - это произведение удельной теплоемкости калориметра c1 на его массу m1.
В теплообмене участвуют три тела: калориметр и вода в нем. Они получают тепло и нагреваются:
 ;
;
 .
.
Алюминий, отдавая тепло, охлаждается:
 .
.
Составим уравнение теплового баланса
 или
или  ,
,
откуда
 или
или  .
.
Пример 2. В сосуде теплоемкостью 600  находится 0,5 кг воды и 0,2 кг льда при 0С. Какую массу водяного пара при 100С нужно впустить в воду, чтобы лед растаял и полученная вода нагревалась до 40С?
находится 0,5 кг воды и 0,2 кг льда при 0С. Какую массу водяного пара при 100С нужно впустить в воду, чтобы лед растаял и полученная вода нагревалась до 40С?
Дано:
c1m1 = 600  ; m2 = 0,5 кг; m3 = 0,2 кг; t1 = 0С; t2 = 100С; = 40С;
; m2 = 0,5 кг; m3 = 0,2 кг; t1 = 0С; t2 = 100С; = 40С;
r = 2,26106 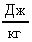 ; = 3,35105
; = 3,35105 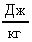 ; c2 = 4190
; c2 = 4190  .
.
Найти:
m4 -?
Решение:
В теплообмене участвуют сосуд, вода, лед и пар. Построим схему (рис. 5).

Рис. 5
На участке ОА лед плавится при 0С; Количество тепла, которое идет на плавление льда:  .
.
На участке АВ вода, полученная при плавлении льда, сосуд и вода в нем массой 0,5 кг нагреваются. Количество тепла, которое идет на их нагревание:
 .
.
На участке CD пар конденсируется, отдавая количество тепла: 
На участке DB вода, полученная при конденсировании пара, охлаждается и отдает количества тепла  .
.
Запишем уравнение теплового баланса:
 или
или 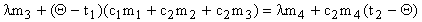 .
.
Откуда:
 ;
;
 ;
;
 .
.
Пример 3. На сколько градусов повысится температура 10 кг воды, взятой при 12С, если в нее влить 5 кг расплавленного свинца при температуре плавления?
Дано:
m1 = 10 кг; с1 = 4190  ; t1 = 12С; m2 = 5 кг; = 2,3104
; t1 = 12С; m2 = 5 кг; = 2,3104 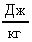 ; c2 = 130
; c2 = 130  ; tпл = 327С.
; tпл = 327С.
Найти:
t -?
Решение:
Построим схему происходящих тепловых процессов (рис. 6)

Рис. 6
Когда свинец в расплавленном состоянии вливают в холодную воду, то он сначала будет затвердевать (участок АВ).
При этом выделится количество тепла  , где - удельная теплота плавления свинца. Затем свинец будет остывать до общей температуры ; при этом выделится количество тепла
, где - удельная теплота плавления свинца. Затем свинец будет остывать до общей температуры ; при этом выделится количество тепла  (участок ВС).
(участок ВС).
Холодная вода будет нагреваться от t1 до и получит количество тепла  (участок DC).
(участок DC).
Запишем уравнение теплового баланса:
 или
или
 .
.
Откуда найдем .
 ;
;
 ;
;
 ;
;
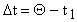 или
или
 .
.
Подставим числовые значения
 .
.
Пример 4. В латунный колориметр массой 128 г, содержащий 240 г воды при 8,4С, опущено металлическое тело массой 192 г, нагретое до 100С. Окончательная температура, установившаяся в калориметре, 21,5С. Определить удельную теплоемкость испытуемого тела.
Дано:
c2 = 4190  ; m1 = 128 г = 0,128 кг; m2 = 240 г = 0,24 кг; t1 = t2 = 8,4С; m3 = 192 г = 0,192 кг; t3 = 100С; = 21,5С; с1 = 380
; m1 = 128 г = 0,128 кг; m2 = 240 г = 0,24 кг; t1 = t2 = 8,4С; m3 = 192 г = 0,192 кг; t3 = 100С; = 21,5С; с1 = 380  .
.
Найти:
с3 -?
Решение:
В теплообмене участвуют три тела: калориметр, вода и металл. Вода и калориметр получают количество тепла:  .
.
Металлическое тело отдает тепло:
 .
.
Запишем уравнение теплового баланса:
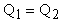 или
или  .
.
Откуда
 ;
; 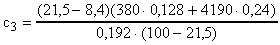 ;
;  .
.
Пример 5. В один килограмм воды при 20С бросают кусок железа массой 100 г, нагретый до 500С. Вода нагрелась при этом до 24С и часть ее обратилась в пар. Найти массу пара.
Дано:
m1 = 1 кг; c1 = 4190  ; t1 = 20С; = 24С; m2 = 100 г = 0,1 кг;
; t1 = 20С; = 24С; m2 = 100 г = 0,1 кг;
c2 = 460  ; r = 2,26106
; r = 2,26106 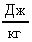 ; t3 = 500С; t2 = 100С.
; t3 = 500С; t2 = 100С.
Найти:
mx -?
Решение:
Построим схему происходящих
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!