Газ называют идеальным, если:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа со стенками сосуда абсолютно упругие.
Реальные газы (например, кислород и гелий) в условиях, близких к нормальным, а также при низких давлениях и высоких температурах близки к идеальным газам. Частицы идеального газа в промежутках между столкновениями движутся равномерно и прямолинейно. Давление газа на стенки сосуда можно рассматривать как ряд быстро следующих ударов газовых молекул о стенку. Рассмотрим, как вычислить давление, вызванное отдельными ударами. Представим себе, что по некоторой поверхности происходит ряд отдельных и частых ударов. Найдем такую среднюю постоянную силу <F>, которая, действуя в течение времени t, за которое происходили отдельные удары, произведет такое же действие, как и все эти удары в своей совокупности. В таком случае импульс этой средней силы за время t должен равняться сумме импульсов всех тех ударов, которые получила поверхность за это время, т.е.
 , где t1, t2, t3... tn - время взаимодействия первой, второй,..., n-й молекул со стенкой (т.е. длительность удара); f1, f2, f3... fn - силы удара молекул о стенку. Из этой формулы следует, что
, где t1, t2, t3... tn - время взаимодействия первой, второй,..., n-й молекул со стенкой (т.е. длительность удара); f1, f2, f3... fn - силы удара молекул о стенку. Из этой формулы следует, что
 , (7)
, (7)
Средняя сила давления, вызванная рядом отдельных ударов о некоторую поверхность, численно равна сумме импульсов всех ударов, полученных этой поверхностью за единицу времени.
Найдем среднюю силу давления <F>, возникающую вследствие ударов газовых молекул о стенки сосуда. Имеем сосуд в форме куба (рис. 4) с длиной ребра l, в котором движется n молекул, причем масса каждой молекулы равна m0. В результате хаотического движения молекул можно утверждать, что результат их ударов о стенки будет такой же, как будто 1/3 все молекул движется вдоль оси X, ударяя в правую и левую грани, 1/3 - движется вдоль оси Y, ударяя в переднюю и заднюю грани, а 1/3 - вдоль оси Z, ударяя в верхнюю и нижнюю грани.

Рис. 4
Найдем импульс силы, от удара одной (первой) молекулы по правой грани куба. Пусть молекула движется со скоростью  вдоль оси X. При упругом ударе о грань она отталкивается с такой же по модулю скоростью, но с обратным знаком. Импульс молекулы до удара
вдоль оси X. При упругом ударе о грань она отталкивается с такой же по модулю скоростью, но с обратным знаком. Импульс молекулы до удара  , а после удара равен
, а после удара равен 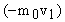 . Изменение импульса молекулы за один удар о грань равно
. Изменение импульса молекулы за один удар о грань равно  . Подсчитаем число ударов, сделанных молекулой о грань за единицу времени (t = 1 с). От удара до следующего удара об одну и ту же грань молекула пролетает вдоль оси Х расстояние, равное удвоенной длине ребра куба 2 l, т.к. ей надо пролететь до противоположной грани и вернуться обратно. За одну секунду молекула произведет
. Подсчитаем число ударов, сделанных молекулой о грань за единицу времени (t = 1 с). От удара до следующего удара об одну и ту же грань молекула пролетает вдоль оси Х расстояние, равное удвоенной длине ребра куба 2 l, т.к. ей надо пролететь до противоположной грани и вернуться обратно. За одну секунду молекула произведет  ударов. Изменение импульса молекулы за все удары (за 1 сек) можно найти как
ударов. Изменение импульса молекулы за все удары (за 1 сек) можно найти как 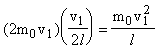 . Импульс силы f1t1, полученный молекулой от грани за все удары в течение секунды, равен изменению ее импульса, т.е.
. Импульс силы f1t1, полученный молекулой от грани за все удары в течение секунды, равен изменению ее импульса, т.е.  . Такой же импульс получила грань от ударов молекулы. Обозначим число молекул, движущихся вдоль оси Х, через
. Такой же импульс получила грань от ударов молекулы. Обозначим число молекул, движущихся вдоль оси Х, через  .
.
Аналогично, различные молекулы, двигаясь с другими скоростями  сообщают грани импульсы
сообщают грани импульсы  ,
, 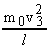 ,...
,...  . Согласно формуле (7) сумма импульсов ударов всех молекул за единицу времени равна средней силе давления:
. Согласно формуле (7) сумма импульсов ударов всех молекул за единицу времени равна средней силе давления:
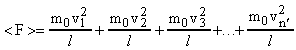 или
или
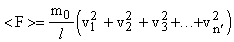 . (8)
. (8)
Умножим и разделим правую часть равенства (8) на n '. Тогда получим:
 . (9)
. (9)
Сумма квадратов скоростей движущихся молекул деленная на их число равна квадрату средней квадратичной скорости <c>2 движения молекул, т.е.:
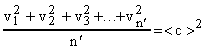 . (10)
. (10)
Используя выражение (10), формулу (9) запишем в виде:
 или, учитывая, что (11)
или, учитывая, что (11)
Давление газа р определяется силой, действующей на единицу площади (площадь грани куба с ребром l равна l 2).
 или, используя формулу (11) запишем:
или, используя формулу (11) запишем:  . Объем куба V = l 3. Такой же объем занимает газ. Поэтому:
. Объем куба V = l 3. Такой же объем занимает газ. Поэтому:
 (12)
(12)
Формула (12) есть основное уравнение молекулярно-кинетической теории идеального газа для давления. Сделанный вывод для сосуда в форме куба оказывается справедливым для сосуда любой формы.
Уравнение (12) можно записать иначе. Отношение  (число молекул в единице объема или концентрация молекул). Умножим и разделим правую часть равенства (12) на 2. Тогда получим:
(число молекул в единице объема или концентрация молекул). Умножим и разделим правую часть равенства (12) на 2. Тогда получим:
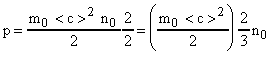 .
.
Величина  - есть средняя кинетическая энергия поступательного движения одной газовой молекулы. Окончательно имеем:
- есть средняя кинетическая энергия поступательного движения одной газовой молекулы. Окончательно имеем:
 . (13)
. (13)
Учитывая, что  , получим:
, получим:
 или
или 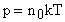 . (14)
. (14)
Таким образом, формулы (12), (13), (14) выражают основное уравнение молекулярно-кинетической теории идеального газа для давления.
Скорости газовых молекул
Формулу (12) можно записать в виде:
 , (15)
, (15)
где  (масса газа).
(масса газа).
Из выражения (15) вычислим среднюю квадратичную скорость движения молекул газа:
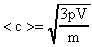 . (16)
. (16)
Зная, что 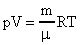 (R-универсальная газовая постоянная;R=8,31
(R-универсальная газовая постоянная;R=8,31 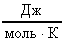 ), получим новые выражения для определения <c>.
), получим новые выражения для определения <c>.
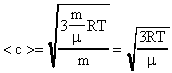 . (17)
. (17)
Опытное определение скоростей движения молекул паров серебра впервые был проведен в 1920 г Штерном.
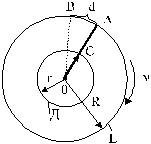
Рис. 5
Из стеклянного цилиндра Е выкачивался воздух (рис. 5). Внутри этого цилиндра помещался второй цилиндр Д, имеющий с ним общую ось О. Вдоль образующей цилиндра Д имелся прорез в виде узкой щели С. По оси протягивалась посеребренная платиновая проволока, по которой можно было пропускать ток. При этом проволока раскалялась и серебро с ее поверхности обращалось в пар. Молекулы паров серебра разлетались в различные стороны, часть их проходила через щель С цилиндра Д и на внутренней поверхности цилиндра Е получался налет серебра в виде узкой полоски. На рис. 5 положение полоски серебра отмечено буквой А.
Когда вся система приводилась в очень быстрое движение таким образом, что проволока являлась осью вращения, то полоска А на цилиндре Е получилась смещенной в сторону, т.е. например, не в точке А, а в точке В. Это происходило потому, что пока молекулы серебра пролетали путь СА, точка А цилиндра Е успевала повернуться на расстояние АВ и молекулы серебра попадали не в точку А, а в точку В.
Обозначим величину смещения серебряной полоски АВ = d; радиус цилиндра Е через R, радиус цилиндра Д через r, а число оборотов всей системы в секунду через 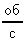 .
.
За один оборот системы точка А на поверхности цилиндра Е пройдет путь, равный длине окружности 2R, а за 1 секунду она пройдет путь  . Время t, в течение которого точка А переместилась на расстояние АВ = d, будет равно:
. Время t, в течение которого точка А переместилась на расстояние АВ = d, будет равно: 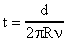 . За время t молекулы паров серебра пролетали расстояние
. За время t молекулы паров серебра пролетали расстояние  . Скорость их движения v может быть найдена, как пройденный путь, деленный на время:
. Скорость их движения v может быть найдена, как пройденный путь, деленный на время:
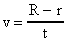 или, заменяя t, получим:
или, заменяя t, получим:
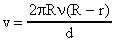 .
.
Налет серебра на стенке цилиндра Д получался размытым, что подтверждало наличие различных скоростей движения молекул Из опыта можно было определить наиболее вероятную скорость vвер которая соответствовала наибольшей толщине налета серебра.
Наиболее вероятную скорость можно рассчитать по формуле, данной Максвеллом:
 . (18)
. (18)
По вычислениям Максвелла средняя арифметическая скорость движения молекул равна:
 . (19)
. (19)



 , где t1, t2, t3... tn - время взаимодействия первой, второй,..., n-й молекул со стенкой (т.е. длительность удара); f1, f2, f3... fn - силы удара молекул о стенку. Из этой формулы следует, что
, где t1, t2, t3... tn - время взаимодействия первой, второй,..., n-й молекул со стенкой (т.е. длительность удара); f1, f2, f3... fn - силы удара молекул о стенку. Из этой формулы следует, что , (7)
, (7)
 вдоль оси X. При упругом ударе о грань она отталкивается с такой же по модулю скоростью, но с обратным знаком. Импульс молекулы до удара
вдоль оси X. При упругом ударе о грань она отталкивается с такой же по модулю скоростью, но с обратным знаком. Импульс молекулы до удара  , а после удара равен
, а после удара равен 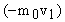 . Изменение импульса молекулы за один удар о грань равно
. Изменение импульса молекулы за один удар о грань равно  . Подсчитаем число ударов, сделанных молекулой о грань за единицу времени (t = 1 с). От удара до следующего удара об одну и ту же грань молекула пролетает вдоль оси Х расстояние, равное удвоенной длине ребра куба 2 l, т.к. ей надо пролететь до противоположной грани и вернуться обратно. За одну секунду молекула произведет
. Подсчитаем число ударов, сделанных молекулой о грань за единицу времени (t = 1 с). От удара до следующего удара об одну и ту же грань молекула пролетает вдоль оси Х расстояние, равное удвоенной длине ребра куба 2 l, т.к. ей надо пролететь до противоположной грани и вернуться обратно. За одну секунду молекула произведет  ударов. Изменение импульса молекулы за все удары (за 1 сек) можно найти как
ударов. Изменение импульса молекулы за все удары (за 1 сек) можно найти как 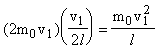 . Импульс силы f1t1, полученный молекулой от грани за все удары в течение секунды, равен изменению ее импульса, т.е.
. Импульс силы f1t1, полученный молекулой от грани за все удары в течение секунды, равен изменению ее импульса, т.е.  . Такой же импульс получила грань от ударов молекулы. Обозначим число молекул, движущихся вдоль оси Х, через
. Такой же импульс получила грань от ударов молекулы. Обозначим число молекул, движущихся вдоль оси Х, через  .
. сообщают грани импульсы
сообщают грани импульсы  ,
, 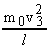 ,...
,...  . Согласно формуле (7) сумма импульсов ударов всех молекул за единицу времени равна средней силе давления:
. Согласно формуле (7) сумма импульсов ударов всех молекул за единицу времени равна средней силе давления: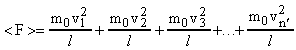 или
или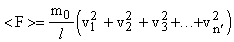 . (8)
. (8) . (9)
. (9)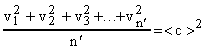 . (10)
. (10) или, учитывая, что (11)
или, учитывая, что (11) или, используя формулу (11) запишем:
или, используя формулу (11) запишем:  . Объем куба V = l 3. Такой же объем занимает газ. Поэтому:
. Объем куба V = l 3. Такой же объем занимает газ. Поэтому: (12)
(12) (число молекул в единице объема или концентрация молекул). Умножим и разделим правую часть равенства (12) на 2. Тогда получим:
(число молекул в единице объема или концентрация молекул). Умножим и разделим правую часть равенства (12) на 2. Тогда получим: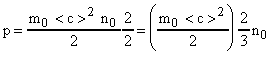 .
. - есть средняя кинетическая энергия поступательного движения одной газовой молекулы. Окончательно имеем:
- есть средняя кинетическая энергия поступательного движения одной газовой молекулы. Окончательно имеем: . (13)
. (13) , получим:
, получим: или
или 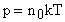 . (14)
. (14) , (15)
, (15) (масса газа).
(масса газа).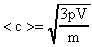 . (16)
. (16)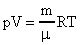 (R-универсальная газовая постоянная;R=8,31
(R-универсальная газовая постоянная;R=8,31 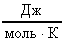 ), получим новые выражения для определения <c>.
), получим новые выражения для определения <c>.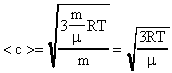 . (17)
. (17)
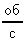 .
. . Время t, в течение которого точка А переместилась на расстояние АВ = d, будет равно:
. Время t, в течение которого точка А переместилась на расстояние АВ = d, будет равно: 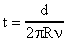 . За время t молекулы паров серебра пролетали расстояние
. За время t молекулы паров серебра пролетали расстояние  . Скорость их движения v может быть найдена, как пройденный путь, деленный на время:
. Скорость их движения v может быть найдена, как пройденный путь, деленный на время: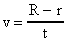 или, заменяя t, получим:
или, заменяя t, получим: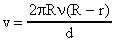 .
. . (18)
. (18) . (19)
. (19)


