Одной из основных характеристик термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (атомов, молекул, ядер, электронов и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
Внутренняя энергия — определенная функция термодинамического состояния системы, т. е. в любом состоянии система обладает вполне определенной внутренней энергией (она не зависит от того, каким образом система пришла в данное состояние). Это значит, что при переходе системы из одного состояния в другое изменение внутренней энергии задается только разностью значений внутренней энергии данных состояний и не зависит от пути и способа перехода.
В механике введилось понятие числа степеней свободы: это число независимых переменных (координат), которые полностью определяют положение системы в пространстве. В некоторых задачах молекулу одноатомного газа (рис. 1, а) рассматривают как материальную точку, которой задают три степени свободы поступательного движения. При этом не учитывается энергия вращательного движения.
В механике молекула двухатомного газа в первом приближении считается совокупностью двух материальных точек, которые жестко связанны недеформируемой связью (рис. 1, б). Данная система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси, проходящей через оба атома, лишено смысла. Значит, у двухатомного газа пять степеней свободы (i = 5). У трехатомной (рис. 1, в) и многоатомной нелинейной молекулы шесть степеней свободы: три поступательных и три вращательных. Естественно считать, что жесткой связи между атомами не существует. Поэтому необходимо учитывать для реальных молекул также степени свободы колебательного движения.

Рис.1
При любом числе степеней свободы данной молекулы три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы не имеет преимущества перед другими, значит на каждую из них приходится в среднем одинаковая энергия, равная 1/3 значения <ε0> (энергия поступательного движения молекул):

В статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы
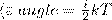
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = i пост+ i вращ+2 i колеб
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия взаимодействия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия для одного моля газа, будет равна сумме кинетических энергий NA молекул:
 (1)
(1)
Внутренняя энергия для произвольной массы m газа.

где М — молярная масса, ν — количество вещества.
21) Распределение молекул идеального газа по скоростям (распределение Максвела)
При выводе основного уравнения молекулярно-кинетической теории полагалось, что молекулы имеют различные скорости. После многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Но из-за хаотического движения молекул все направления движения равновероятны, т. е. в любом направлении в среднем движется равное число молекул.
Согласно молекулярно-кинетической теории, как бы ни изменялись при столкновениях скорости молекул, средняя квадратичная скорость молекул массой m0 в газе, который находится в состоянии равновесия при Т= const, остается неизменно и равной
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем статистическое распределение молекул по скоростям, подчиняющаяся вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.
При выводе закона распределения молекул по скоростям Максвелл сделал предположение, что газ состоит из огромного числа N тождественных молекул, которые находятся в состоянии беспорядочного теплового движения при одинаковой температуре. Также предполагалось, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(ν), которая называется функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, которые равны dν, то на каждый интервал скорости приходится число молекул dN(ν), имеющих скорость, которая заключена в этом интервале. Функция f(ν) задает относительное число молекул dN(ν)/N, скорости которых находятся в интервале от ν до ν +d ν, т. е.

откуда

Применяя методы теории вероятностей, Максвелл получил функцию f(ν) — закон о распределеня молекул идеального газа по скоростям:
 (1)
(1)
Из (1) видно, что конкретный вид функции зависит от вида газа (от массы молекулы) и от параметра состояния (от температуры Т).
График функции (1) приведен на рис. 1. Так как при возрастании ν множитель exp[–m0 ν 2/(2kT)] уменьшается быстрее, чем увеличивается множитель ν 2, то функция f(ν), начинаясь от нуля, достигает максимума при ν B, и затем асимптотически стремится к нулю. Кривая несимметрична относительно ν B.

Рис.1
Относительное число молекул dN(ν)/N, со скоростями, лежащими в интервале от ν до ν +d ν, рассчитывается как площадь заштрихованной полоски на рис. 1. Площадь, которая ограничена кривой распределения и осью абсцисс, равна единице. Это значит, что функция f(ν) удовлетворяет условию нормировки

Скорость, при которой максимальна функция распределения молекул идеального газа по скоростям, называется наиболее вероятной скоростью, значение которой можно найти продифференцировав выражение (1) (постоянные множители опускаем) по аргументу ν, при этом приравняв результат нулю и используя условие для максимума выражения f(ν):


Значения ν =0 и ν =∞ соответствуют минимумам выражения (1), а значение ν, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость ν B:
 (2)
(2)
Из формулы (2) мы видим, что при возрастании температуры максимум функции распределения молекул по скоростям (рис. 2) движется вправо (при этом становится больше значение наиболее вероятной скорости). Однако площадь, которая ограничена кривой, не меняется, поэтому кривая распределения молекул по скоростям при повышении температуры будет растягиваться и понижаться.

Рис.2
Средняя скорость молекулы < ν > (средняя арифметическая скорость) определяется по формуле

Подставляя сюда f(ν) и интегрируя, получаем
 (3)
(3)
Скорости, которые характеризуют состояние газа: 1) наиболее вероятная  2) средняя
2) средняя  3) средняя квадратичная
3) средняя квадратичная  (рис. 1). Исходя из распределения молекул по скоростям
(рис. 1). Исходя из распределения молекул по скоростям
 (4)
(4)
найдем распределение молекул газа по значениям кинетической энергии ε. С этой целью перейдем от переменной ν к переменной ε=m0v2/2. Подставив в (4)  и
и  , получим
, получим

где dN(ε) — число молекул, которые имели кинетическую энергию поступательного движения, заключенную в интервале от ε до ε + dε.
Значит, функция распределения молекул по энергиям теплового движения

Средняя кинетическая энергия <ε> молекулы идеального газа

т. е. получили результат, совпадающий с формулой о средней кинетической энергии движения одной молекулы идеального газа, выводимой из молекулярно-кинетической теории.





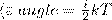
 (1)
(1)


 (1)
(1)



 (2)
(2)

 (3)
(3) 2) средняя
2) средняя  3) средняя квадратичная
3) средняя квадратичная  (рис. 1). Исходя из распределения молекул по скоростям
(рис. 1). Исходя из распределения молекул по скоростям (4)
(4) и
и  , получим
, получим





