Рассмотрим систему, состоящую из металлического электрода, погруженного в раствор, содержащий катионы того же металла (раствор соли). Если металл находится в контакте, например, с водным раствором электролита небольшой концентрации, то на границе раздела фаз «металл – электролит» протекают следующие процессы (рис.8.2).
1. В результате физико-химического взаимодействия между диполями воды и поверхностными ионами металла происходит его растворение. Особенности химической связи в металлах приводят к тому, что в раствор переходят только ионы металла, а электроны остаются в кристалле. В результате электрод приобретает избыточный отрицательный, а раствор – избыточный положительный заряды.
Рис. 8‑2 Схема возникновения обменного двойного электрического слоя на границе «металл – раствор электролита»
Самопроизвольное протекание этого процесса обусловлено как энтальпийным, так и энтропийным факторами. Переход ионов металла из кристалла в раствор приводит к уменьшению энтальпии системы(D H <0), главным образом за счет экзотермической реакции гидратации ионов металла, и увеличению энтропии(DS>0) вследствие разупорядочивания системы. Этот процесс можно записать как реакцию окисления металла:
Me0 + x H2O ® Me n +(H2O) x + nē
2. Наличие катионов металла в растворе и отрицательный заряд электрода за счет избыточных электронов обусловливает протекание обратного процесса: катионы металла переходят из раствора на поверхность электрода. При этом они теряют свою гидратную оболочку и встраиваются в кристаллическую решетку, что приводит к уменьшению величин отрицательного заряда электрода и положительного заряда раствора. Этот процесс можно записать как реакцию восстановления металла:
Me n +(H2O) x + nē ® Me0+ x H2O
В результате протекания этих процессов система придет в состояние равновесия. Скорости первого и второго процессов будут равны:
Me n +(H2O) x + nē ↔ Me0+ x H2O.
При этом потенциал электрода и концентрация катионов в растворе сохранят постоянное равновесное значение.
Необходимо отметить, что концентрация катионов металла в растворе будет различной в зависимости от расстояния до поверхности электрода (рис.7.3). Максимальным ее значение будет непосредственно у поверхности электрода (C 0). За счет процесса диффузии ионы металла будут двигаться от поверхности электрода в объем раствора, при этом их концентрация уменьшится до величины C в глубине раствора. Таким образом, в состоянии равновесия установится постоянный градиент концентрации катионов.
Примечание. С точки зрения термодинамики, в состоянии равновесия энергия (химический потенциал) поверхностных атомов металла равна энергии (химическому потенциалу) гидратированных ионов металла в растворе.
На границе «электрод – электролит» возникает обменный двойной электрический слой, образованный с одной стороны избыточными электронами в электроде, а с другой – избыточными положительными ионами металла в растворе (противоионами). Он рассматривается как единая электронейтральная система: заряд электрода равен сумме зарядов противоионов.
Поскольку существует разделение зарядов в пространстве, то между металлом и раствором возникает разность потенциалов j. Говорят, что при контакте металла с электролитом на границе раздела возникает скачок электрического потенциала – электродный потенциал.
Ионы металла, образующие двойной электрический слой, распределены в растворе следующим образом (рис.8.3).
1. Часть ионов располагается на расстоянии порядка радиуса гидратированного иона от поверхности металла, образуя плотный слой, толщина которого составляет величину dп~10–10 м. Концентрация ионов металла в нем равна C 0, падение потенциала (jп) происходит линейно.
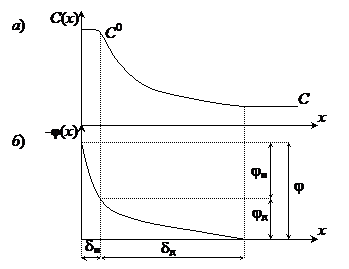
Рис. 8‑3 Распределение концентрации ионов Ме n + (а) и потенциала (б) в ионной части двойного электрического слоя: а) – изменение концентрации ионов Ме n + в электролите в зависимости от расстояния до электрода; C0 – концентрация в плотном слое; C – концентрация в объеме электролита; б) –изменение электродного потенциала в зависимости от расстояния до электрода; jп – падение потенциала в плотном слое, jд – падение потенциала в диффузном слое; dп – толщина плотного слоя; dд – толщина диффузного слоя
2. Другая часть ионов за счет диффузии перемещается в глубь раствора, образуя диффузный слой. Концентрация ионов уменьшается от C 0 до величины концентрации ионов металла в электролите C. Толщина диффузного слоя зависит от концентрации ионов металла в электролите и составляет величину порядка dд~10–9÷10–5 м. Падение потенциала в диффузном слое (jд) происходит нелинейно. С увеличением концентрации катионов в электролите диффузия уменьшается, соответственно уменьшается и толщина диффузного слоя. В растворах с концентрацией 0,1 ÷ 1,0 моль/л он практически отсутствует.
Очевидно, что величина скачка потенциала на границе раздела «металл – электролит» (j) равна сумме величин падения потенциала в плотном (jп) и диффузном (jд) слоях двойного электрического слоя.
Примечание. При большой концентрации ионов металла в растворе, малой энергии их гидратации, большой работе выхода ионов из металла, а также адсорбции на электродах поверхностно-активных ионов и молекул, которые могут содержаться в электролите, система придет в равновесие при преобладании перехода ионов металла из раствора на электрод. В этом случае двойной электрический слой и скачок потенциала соответственно образуют катионы, адсорбированные на металле и избыточные анионы в растворе.
Электродный потенциал возникает и в случае, если металл находится в контакте с неводным раствором электролита. Поскольку равновесие зависит от энергии сольватации иона металла, то величина потенциала будет зависеть от природы растворителя.
Уравнение Нернста
При определении величины электродного потенциала и его зависимости от внешних условий могут быть использованы как термодинамические, так и кинетические модели.
Определить величину электродного потенциала можно, рассмотрев термодинамические условия равновесия системы «металл – раствор электролита», содержащего катионы того же металла. В этом случае в системе протекает обратимая реакция:
Me n +(H2O) x + nē ↔ Me0 + x H2O
При ее записи обычно молекулы воды не указывают, не забывая, что они играют здесь основную роль:
Me n + + nē ↔ Me0
На границе раздела «металл – электролит» образуется двойной электрический слой и возникает скачок потенциала.
Изменение свободной энергии Гиббса в состоянии равновесия (D G=0) будет равно изменению энергии Гиббса химической реакции (D rG) плюс работа электрических сил по переносу ионов (Me n+) через двойной электрический слой:
D G = D rG + W эл = 0.
Работа, осуществляемая по переносу одного моля положительно заряженных ионов через двойной электрический слой, равна:
W эл = n × ē ×j× N A, W эл = n × F ×j,
где j – электродный потенциал [В]; N A = 6,02×1023 [моль-1] – число Авогадро; ē = 1,6×10-19 [Кл] – заряд электрона; n – заряд иона (в единичных электрических зарядах); F = ē×N A» 96500 Кл/моль – число Фарадея.
Следовательно, изменение энергии Гиббса при образовании двойного электрического слоя равно:
D rG = – n×F× j.
При изобарно-изотермическом процессе Me n+ + nē ↔Me0изменение энергии Гиббса, согласно уравнению изотермы реакции, равно:
D rG =  ; (
; ( )
)
здесь R = 8,314 Дж/моль×К – универсальная газовая постоянная; Т – температура, К; К р – константа равновесия реакции,  – концентрация ионов металла в растворе (за пределами диффузного слоя). Поэтому
– концентрация ионов металла в растворе (за пределами диффузного слоя). Поэтому
- n×F ×j =  → j =
→ j =  .
.
В стандартных условиях при Т = 298 К и  = 1 моль/л величина электродного потенциала зависит только от природы вещества, из которого изготовлен электрод: j =
= 1 моль/л величина электродного потенциала зависит только от природы вещества, из которого изготовлен электрод: j = 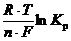 = j0. Величина j0 называется стандартным электродным потенциалом. Его значение нельзя рассчитать теоретически, поскольку неизвестно абсолютное значение К р. Его невозможно определить и экспериментально, так как не существует прямых способов измерения разности потенциалов между проводниками первого (металл) и второго рода (электролит).
= j0. Величина j0 называется стандартным электродным потенциалом. Его значение нельзя рассчитать теоретически, поскольку неизвестно абсолютное значение К р. Его невозможно определить и экспериментально, так как не существует прямых способов измерения разности потенциалов между проводниками первого (металл) и второго рода (электролит).
Зависимость электродного потенциала от температуры и концентрации катионов металла в растворе имеет вид
j = j0 +  .
.
Это уравнение получило название уравнение Нернста (Nernst) для электродного потенциала.
Примечание.
1. В общем случае для электродной реакции Ox + nē ↔Red уравнение Нернста записывается как
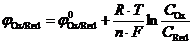 .
.
2. Для точных расчетов электродных потенциалов в уравнении Нернста вместо концентрации ионов (Ci) в растворах электролитов необходимо использовать их активность (ai). В общем случае  . Для металла в растворе электролита
. Для металла в растворе электролита 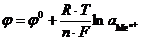 .
.
Определить величину электродного потенциала можно также из кинетической модели образования двойного электрического слоя.
При контакте металла с электролитом двойной электрический слой и соответственно электродный потенциал возникают в результате протекания двух процессов: перехода ионов металла из кристалла в раствор –Me0+ x H2O®Me n +(H2O) x + nē – реакция окисления и перехода катионов из раствора на поверхность электрода – Me n +(H2O) x + nē ®Me0+ x H2O - реакция восстановления. В состояние равновесия система придет при выравнивании скоростей этих процессов (см. кинетическое условие равновесия). В результате установившегося равновесия реакции
Me n +(H2O) x + nē ↔ Me0 + x H2O
на границе «электрод – электролит» возникнет электродный потенциал j.
Скорости реакций восстановления и окисления, согласно закону действующих масс, будут зависеть от концентрации реагирующих веществ. Для прямой реакции (восстановление ионов металла) скорость пропорциональна их концентрации в растворе: 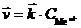 , для обратной реакции (окисление атомов металла) пропорциональна концентрации молекул воды:
, для обратной реакции (окисление атомов металла) пропорциональна концентрации молекул воды:  , где
, где 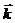 и
и  – константы скоростей реакций. Их величины, согласно уравнению Аррениуса, определяются энергиями активации и температурой:
– константы скоростей реакций. Их величины, согласно уравнению Аррениуса, определяются энергиями активации и температурой:  , где Еа – энергия активации, k 0 – предэкспоненциальный множитель.
, где Еа – энергия активации, k 0 – предэкспоненциальный множитель.
Величины энергий активации можно оценить, рассмотрев энергетическую диаграмму процесса Me n +(H2O) x + nē ↔ Me0 + x H2O (рис.8-4).
Представим реакцию восстановления как процесс дегидратации иона металла (образование свободного иона) и последующее встраивание его в кристаллическую решетку металла. Реакцию окисления представим как два последовательных процесса: выход иона металла (Me n +) из кристаллической решетки электрода в вакуум и его гидратация с образованием в растворе иона Me n +(H2O) x.
Рис. 8‑4 Энергетическая диаграмма процесса Men+(H2O) x + nē ↔ Me0 + x H2O
Пусть E 0 – энергия свободного иона металла в вакууме; E M – энергия поверхностного атома металла; Eaq – энергия гидратированного иона металла в растворе. В состоянии равновесия, в результате возникновения скачка потенциала на границе «электрод – электролит», энергия поверхностного иона металла изменяется на величину D E = n·F· j. На рис.7-4 показано изменение энергии поверхностных ионов при концентрации катионов в электролите меньше равновесной.
Из энергетической диаграммы видно, что для перехода в раствор ион металла должен обладать энергией, равной 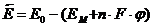 , а для перехода из раствора в кристаллическую решетку –
, а для перехода из раствора в кристаллическую решетку –  . Обе они являются, по сути, энергиями активации реакций окисления (Me0+ x H2O®Me n +(H2O) x + nē) и восстановления (Me n +(H2O) x + nē ®Me0+ x H2O).
. Обе они являются, по сути, энергиями активации реакций окисления (Me0+ x H2O®Me n +(H2O) x + nē) и восстановления (Me n +(H2O) x + nē ®Me0+ x H2O).
В состоянии равновесия скорости прямой и обратной реакций будут равны: 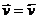 , следовательно,
, следовательно,
 .
.
Если предположить, что предэкспоненциальные множители для прямой и обратной реакций имеют величину одного порядка  , и учесть, что
, и учесть, что 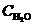 - величина постоянная, то, прологарифмировав это выражение, получаем уравнение Нернста:
- величина постоянная, то, прологарифмировав это выражение, получаем уравнение Нернста:
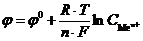 ,
,
где 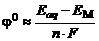 - стандартный электродный потенциал.
- стандартный электродный потенциал.
Из кинетической модели следует, что стандартный электродный потенциал главным образом определяется соотношением энергии гидратированного иона металла в растворе и энергии поверхностного атома металла электрода.
Электроды
Из уравнения Нернста следует, что потенциал электрода при данной температуре определяется стандартным электродным потенциалом (j0) и концентрацией (активностью) ионов, участвующих в реакции. В зависимости от особенностей электродных реакций различают несколько типов электродов.
Электроды первого рода. К электродам первого рода относятся металлические электроды, находящиеся в контакте с раствором, содержащим катионы этого же металла. Схематически электрод первого рода можно представить как Me n +|Me0. Электродная реакция, протекающая на нем:
Me n + + nē ↔ Me0
Потенциал электрода первого рода зависит от концентрации ионов металла, которые являются потенциалопределяющими:
 .
.
Пример. 1. Медный электрод погружен в раствор сульфата меди Cu2+|Cu0:
электродная реакция Cu2+ + 2 ē Û Cu0;
электродный потенциал 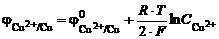 .
.
2. Серебряный электрод погружен в раствор нитрата серебра Ag+|Ag0: электродная реакция Ag++ ē ↔ Ag0,
электродный потенциал 
Электроды первого рода являются обратимыми: изменение направления тока в цепи изменяет лишь направление реакцииMe n + + nē ↔ Me0, не изменяя саму реакцию:
(Me n + + nē ® Me0 – процесс восстановления;
Me0 ® Me n + + nē – процесс окисления).
Примечание. Существуют электроды первого рода, обратимые относительно аниона, например,Se2-|Se0:
электродная реакция Se0+2 ē ↔ Se2-
электродный потенциал  .
.
Электроды второго рода. К электродам второго рода относятся металлические электроды, покрытые слоем труднорастворимого соединения этого же металла (MeAn), находящиеся в контакте с электролитом, содержащим такие же анионы (Ann-).
Схематически электрод можно представить как
An n -|MeAn,Me0.
Электродная реакция, протекающая на нем:
MeAn+ nē ↔ Me0 + An n -
Потенциал электрода второго рода определяется равновесием двух процессов:
1. Равновесие «труднорастворимое соединение – раствор электролита», которое определяет концентрацию иона металла:
MeAn↔ Me n + + An n -; 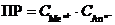 ®
® 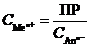
где ПР – произведение растворимости труднорастворимого соединения MeAn.
2. Равновесие «металл - катион металла» Me n + + nē ↔ Me0, которое определяет возникновение электродного потенциала:
 .
.
Потенциал электрода будет определяться суммарным уравнением MeAn+ nē ↔ Me0 + An n -:
 =
= 
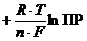
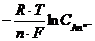
Таким образом, потенциал электрода второго рода зависит от концентрации аниона (потенциалопределяющий ионAn n -):
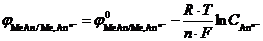 ,
,
где 
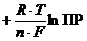 .
.
Пример. Хлорсеребряный электрод AgCl,Ag0| Cl-.
Металлический серебряный электрод, на поверхность которого нанесен тонкий слой труднорастворимой соли хлорида серебра (ПРAgCl=1,8×10-10), контактирует с раствором сильного электролита хлорида калия (КCl ® К++ Cl-) (рис. 8.5).
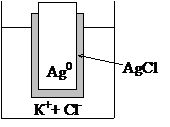
Рис. 8‑5 Схема хлорсеребряного электрода
Электродная реакция:
AgCl + ē ↔ Ag0 + Cl-
 .
.
Газовые электроды. Газовый электрод представляет собой металлический проводник, на поверхности которого адсорбированы молекулы газа, который находится в контакте с электролитом, содержащим ионы этого же газа. В системе устанавливается равновесие между молекулами газа, находящимися на поверхности металлического электрода, и ионами этого газа в электролите. Металлический проводник служит только для передачи электронов между внешней цепью и раствором (создает электропроводящий контакт между газом и раствором). При этом материал электрода не должен участвовать в электрохимическом равновесии. Как правило, такими материалами являются металлы платиновой группы, в частности сама платина. Они не принимают непосредственного участия в реакциях с раствором и в то же время, являясь гетерогенными катализаторами, ускоряют установление электродного равновесия.
Наиболее важными с практической точки зрения являются водородный и кислородный электроды.
1. Водородный электрод (2H+|H20,Pt) представляет собой платиновый электрод, помещенный в раствор, содержащий ионы водорода (раствор серной кислоты), через который пропускают газообразный водород (рис. 8.6).
На границе раздела "платина – раствор серной кислоты" устанавливается равновесие 2H+ + 2ē ↔ H2, и возникает электродный потенциал, величина которого зависит от относительного парциального давления газа и концентрации ионов водорода:
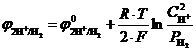
Рис. 8‑6 Схема водородного электрода
При стандартном давлении газообразного водорода (р 0=1,013×105 Па) электродный потенциал водородного электрода зависит только от концентрации ионов водорода:  . При постоянной температуре ее можно выразить как зависимость потенциала от pH раствора (
. При постоянной температуре ее можно выразить как зависимость потенциала от pH раствора ( ):
):
 ,
,
где 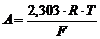 – константа. Для стандартной температуры (Т 0 = 298 К) А»0,059.
– константа. Для стандартной температуры (Т 0 = 298 К) А»0,059.
Потенциал водородного электрода в стандартных условиях (стандартный водородный электрод) условно принимается равным нулю: 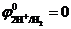 В. Для данной системы стандартными условиями будут парциальное давление водорода р 0=1,013×105 Па; активность ионов водорода в электролите а = 1 моль/л; Т 0 = 298 К. Стандартный водородный электрод используется в качестве электрода сравнения при измерении потенциалов других электродов.
В. Для данной системы стандартными условиями будут парциальное давление водорода р 0=1,013×105 Па; активность ионов водорода в электролите а = 1 моль/л; Т 0 = 298 К. Стандартный водородный электрод используется в качестве электрода сравнения при измерении потенциалов других электродов.
В случае нейтрального и щелочного электролита (pH ³7) уравнение реакции электродного процесса водородного электрода записывается как
2H2O + 2 ē ↔ H2 + 2OH-
2. Кислородный электрод (OH-|O2,Pt). Если в устройстве, схема которого приведена на рис.7.6, вместо водорода пропускать газообразный кислород (О2), а в качестве электролита использовать не кислоту, а раствор щелочи, то на границе раздела «платина – электролит» устанавливается равновесие: О2 + 2H2O + 4 ē ↔ 4OH-. Величина электродного потенциала в данном случае зависит от относительного парциального давления кислорода и концентрации гидроксо-ионов:
 .
.
При стандартных условиях потенциал кислородного электрода зависит только от концентрации ионов OH-. Эту зависимость представляют обычно как зависимость потенциала от pH раствора (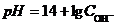 ):
):
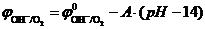 , где А» 0,059.
, где А» 0,059.
В случае электролита с pH <7 (раствор кислоты) уравнение реакции электродного процесса кислородного электрода записывается как
О2 + 4H+ + 4 ē ↔ 2H2O
Примечание. Необходимо отметить, что при электролизе и электрохимической коррозии металлов могут образовываться воородный и кислородный газовые электроды.
Окислительно-восстановительные электроды (редокс-электроды). В рассмотренных до сих пор типах электродов одной из форм веществ, между которыми за счет реакции Ox + nē ↔ Red возникает потенциал, является материал электрода или вещество, адсорбированное поверхностью электрода. Металлический электрод, контактирующий с электролитом, содержащим одновременно как окисленную (Ox), так и восстановленную (Red) форму вещества, называется окислительно-восстановительным или редокс-электродом.
Материалы, используемые в редокс-электродах, должны удовлетворять требованиям, рассмотренным для газовых электродов. Таким материалом является, например, платина.
Схематически такой электрод можно представить как Ox,Red|Pt. Электродная реакция, протекающая на поверхности платины, Ox + nē ↔ Red.
В состоянии равновесия потенциал электрода определяется соотношением концентраций окисленной и восстановленной формы вещества в электролите:
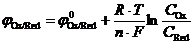 .
.
Этот потенциал называется равновесным редокс-потенциалом окислительно-восстановительной системы.
Пример 1. Простые окислительно-восстановительные системы.
В растворе, контактирующем с платиновым электродом, одновременно находятся катионы олова Sn2+ и Sn4+ (например, раствор хлоридов олова SnCl2 и SnCl4) − Sn4+,Sn2+|Pt. В результате реакции Sn4+ + 2 ē ↔ Sn2+ устанавливается равновесие. Редокс-потенциал будет равен:
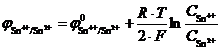 .
.
Пример 2. Сложные окислительно-восстановительные системы. В электродной реакции принимают участие молекулы воды, ионы H+ или OH-. Например, для системы Cr2O72-,Cr3+,H+|Pt реакция, за счет которой возникает электродный потенциал, может быть представлена в виде
Cr2O72- + 14H+ + 6 ē ↔ 2Cr3+ + 7H2O,
где Cr2O72- – окисленная, а Cr3+ – восстановленная формы вещества.
Редокс-потенциал будет равен:
 .
.
Из уравнения видно, что редокс-потенциал сложной окислительно-восстановительной системы зависит не только от соотношения концентраций окисленной и восстановленной форм вещества, но и от концентрации ионов водорода (рН раствора).
 Ионселективные электроды. Ионселективный (ионообменный) электрод состоит из электрода второго рода, контактирующего с внутренним раствором, и тонкой мембраны, отделяющей внутренний раствор электрода от внешнего раствора.
Ионселективные электроды. Ионселективный (ионообменный) электрод состоит из электрода второго рода, контактирующего с внутренним раствором, и тонкой мембраны, отделяющей внутренний раствор электрода от внешнего раствора.
Рис. 8‑7 Схема стеклянного электрода
Материал мембраны обменивается своими ионами с ионами внутреннего и внешнего растворов электролитов. В результате этого процесса поверхность мембраны и раствор приобретают электрические заряды противоположного знака – возникает скачок потенциала. Как правило, преимущественно происходит обмен ионами одного вида, поэтому эти электроды называют ионоселективными.
В состоянии равновесия величина электродного потенциала линейно зависит от концентрации ионов во внешнем растворе. Это позволяет использовать данные электроды для определения концентрации ионов в анализируемом растворе. В настоящее время созданы ионселективные электроды для нескольких десятков катионов и анионов. Важнейшим из них является стеклянный электрод (рис. 8.7). Его потенциал зависит от концентрации ионов водорода: j =j0 + А × рН, где А – const, поэтому он используется для определения рН растворов.
Определение концентрации ионов водорода (рН анализируемого раствора) сводится к измерению разности потенциалов между стеклянным электродом и электродом сравнения, погруженными в анализируемый раствор. В качестве электрода сравнения используют электроды, потенциал которых не зависит от концентрации ионов водорода, например хлорсеребряный электрод. В этом случае величина измеряемой разности потенциалов пропорциональна рН анализируемого раствора.
Способов экспериментального определения и расчета абсолютных величин электродных потенциалов не существует. С достаточной степенью точности можно измерить разность потенциалов Dj между двумя электродами в электрохимической системе. Если равновесие в такой системе достигнуто в стандартных условиях: активность (концентрация) потенциалопределяющих ионов 1 моль/л; температура Т 0=298 К; давление газов р 0=1,013×105 Па; ток во внешней цепи I =0 А, то измеряемая Dj равна разности между стандартными электродными потенциалами: Dj= j01-j02.
Если один из электродов принять в качестве электрода сравнения, стандартный потенциал которого условно считать равным нулю, то измеренная разность потенциалов будет являться потенциалом второго электрода относительно первого. В качестве электрода сравнения часто используют стандартный водородный электрод.
В рассматриваемой паре электродов потенциал стандартного водородного электрода может быть как больше, так и меньше стандартного потенциала измеряемого. Например, для электродов первого рода электрохимические могут быть записаны как
(–)Me0|Me n +||2H+|H20,Pt(+) или (–)H20,Pt |2H+||Me n +|Me0(+).
Таким образом, потенциал измеряемого электрода относительно водородного может быть отрицательным: 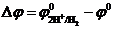 или положительным
или положительным  . За стандартный электродный потенциал принимается измеренная разность потенциалов соответственно j0 = ± Dj.
. За стандартный электродный потенциал принимается измеренная разность потенциалов соответственно j0 = ± Dj.
Измеренные относительно водородного электрода величины стандартных электродных потенциалов сведены в таблицу в порядке их возрастания (см. пример). Такую последовательность называют рядом стандартных электродных потенциалов окислительно-восстановительных систем. Из общего ряда выделяют последовательность для электродов первого рода – металлы, находящиеся в контакте с раствором, содержащим катион этого же металла (Me n +|Me0). Она называется электрохимическим рядом напряжений металлов.
Пример. Стандартные электродные потенциалы (j0, В) и их электродные реакции. Жирным шрифтом выделены электроды первого рода.
| Электрод
| Электродная реакция
| j0, В
|
| Li+|Li0
| Li+ + ē ↔ Li0
| -3,02
|
| K+|K0
| K+ + ē ↔ K0
| -2,92
|
| Ca2+|Ca0
| Ca2+ + 2ē ↔ Ca0
| -2,87
|
| Na+|Na0
| Na+ + ē ↔ Na 0
| -2,71
|
| Mg2+|Mg0
| Mg2+ + 2ē ↔ Mg0
| -2,34
|
| Al3+|Al0
| Al3+ + 3ē ↔ Al0
| -1,67
|
| Zn2+|Zn0
| Zn2+ + 2ē ↔ Zn0
| -0,76
|
| Cr3+|Cr0
| Cr3+ + 3ē ↔ Cr0
| -0,74
|
| Cr3+,Cr2+|Pt
| Cr3++ ē ↔ Cr2+ pH £ 7
| -0,41
|
| Fe2+|Fe0
| Fe2+ + 2ē ↔ Fe0
| -0,44
|
| Cd2+|Cd0
| Cd2+ + 2ē ↔ Cd0
| -0,40
|
| Ni2+|Ni0
| Ni2+ + 2ē ↔ Ni0
| -0,25
|
| Sn2+|Sn0
| Sn2+ + 2ē ↔ Sn0
| -0,14
|
| Pb2+|Pb0
| Pb2+ + 2ē ↔ Pb0
| -0,13
|
| Fe3+|Fe0
| Fe3+ + 3ē ↔ Fe0
| -0,04
|
| 2H+|H20,Pt
| 2H+ + 2ē↔H2
| 0,00
|
| Sn4+,Sn2+|Pt
| Sn4+ + 2ē ↔ Sn2+ pH £ 7
| +0,15
|
| Cl-|AgCl,Ag0
| AgCl + ē ↔ Ag0 + Cl- pH ~7
| +0,22
|
| Cu2+|Cu0
| Cu2+ + 2ē ↔ Cu0
| +0,34
|
| OH-|O2,Pt
| О2 + 2H2O + 4ē ↔ 4OH- pH ³ 7
| +0,40
|
| Fe3+,Fe2+|Pt
| Fe3+ + ē ↔ Fe2+ pH £ 7
| +0,77
|
| NO3-,NO2,H+|Pt
| NO3- + 2H+ + ē ↔ NO2 + H2O
| +0,80
|
| Ag+|Ag0
| Ag++ ē ↔ Ag0
| +0,80
|
| Hg2+|Hg0(ж)
| Hg2+ + 2ē ↔ Hg0
| +0,85
|
| NO3-,NH4+,H+|Pt
| NO3- + 10H+ + 8ē ↔ NH4+ + 3H2O
| +0,87
|
| Cr2O72-,Cr3+,H+|Pt
| Cr2O72+ + 14H+ + 6ē ↔ 2Cr3+ + 7H2O pH < 7
| +1,33
|
| 2Cl-| Cl20,Pt
| 2 Cl - + 2ē ↔ Cl 2
| +1,36
|
| Au3+|Au0
| Au3+ + 3ē ↔ Au0
| +1,50
|
| Au+|Au0
| Au+ + ē ↔ Au0
| +1,69
|
| PbO2,H+,SO42-,PbSO4|Pt
| PbO2+4H++SO42-+2ē↔PbSO4 + 2H2O pH < 7
| +1,69
|
| Co3+,Co2+|Pt
| Co3+ + ē ↔ Co2+ pH £ 7
| +1,81
|
| S2O82-,SO42-|Pt
| S2O82- + 2ē ↔ 2SO42- pH ~7
| +2,01
|
| 2F-|F20,Pt
| 2 F- + 2ē ↔ F2 pH ³ 7
| +2,87
|
Величина стандартного электродного потенциала j0 электрода первого рода является мерой восстановительной способности атома металла и окислительной способности его иона. Чем она меньше, тем легче атом отдает электроны, соответственно металл обладает более высокой восстановительной способностью. Чем она больше, тем легче ион принимает электроны, являясь более сильным окислителем.
Эти же закономерности относятся к редокс-электродам. Чем отрицательнее потенциал, тем более сильным восстановителем является восстановленная (Red) форма вещества. И, наоборот, с увеличением потенциала возрастает окислительная способность окисленной формы (Ox).



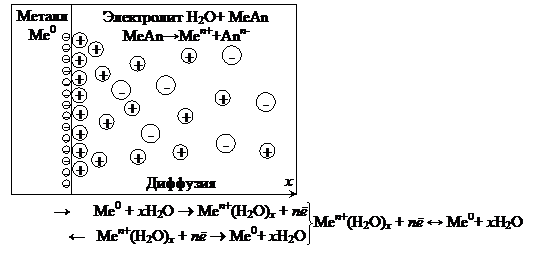
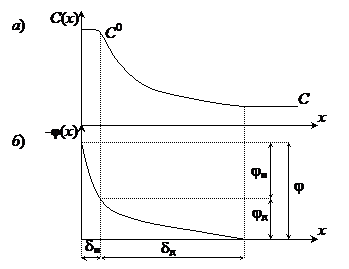
 ; (
; ( )
) – концентрация ионов металла в растворе (за пределами диффузного слоя). Поэтому
– концентрация ионов металла в растворе (за пределами диффузного слоя). Поэтому .
. = 1 моль/л величина электродного потенциала зависит только от природы вещества, из которого изготовлен электрод: j =
= 1 моль/л величина электродного потенциала зависит только от природы вещества, из которого изготовлен электрод: j = 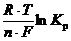 = j0. Величина j0 называется стандартным электродным потенциалом. Его значение нельзя рассчитать теоретически, поскольку неизвестно абсолютное значение К р. Его невозможно определить и экспериментально, так как не существует прямых способов измерения разности потенциалов между проводниками первого (металл) и второго рода (электролит).
= j0. Величина j0 называется стандартным электродным потенциалом. Его значение нельзя рассчитать теоретически, поскольку неизвестно абсолютное значение К р. Его невозможно определить и экспериментально, так как не существует прямых способов измерения разности потенциалов между проводниками первого (металл) и второго рода (электролит). .
.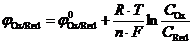 .
. . Для металла в растворе электролита
. Для металла в растворе электролита 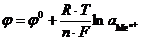 .
.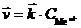 , для обратной реакции (окисление атомов металла) пропорциональна концентрации молекул воды:
, для обратной реакции (окисление атомов металла) пропорциональна концентрации молекул воды:  , где
, где 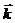 и
и  – константы скоростей реакций. Их величины, согласно уравнению Аррениуса, определяются энергиями активации и температурой:
– константы скоростей реакций. Их величины, согласно уравнению Аррениуса, определяются энергиями активации и температурой:  , где Еа – энергия активации, k 0 – предэкспоненциальный множитель.
, где Еа – энергия активации, k 0 – предэкспоненциальный множитель.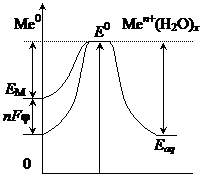
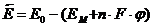 , а для перехода из раствора в кристаллическую решетку –
, а для перехода из раствора в кристаллическую решетку –  . Обе они являются, по сути, энергиями активации реакций окисления (Me0+ x H2O®Me n +(H2O) x + nē) и восстановления (Me n +(H2O) x + nē ®Me0+ x H2O).
. Обе они являются, по сути, энергиями активации реакций окисления (Me0+ x H2O®Me n +(H2O) x + nē) и восстановления (Me n +(H2O) x + nē ®Me0+ x H2O).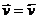 , следовательно,
, следовательно, .
. , и учесть, что
, и учесть, что 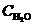 - величина постоянная, то, прологарифмировав это выражение, получаем уравнение Нернста:
- величина постоянная, то, прологарифмировав это выражение, получаем уравнение Нернста: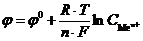 ,
,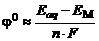 - стандартный электродный потенциал.
- стандартный электродный потенциал. .
.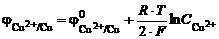 .
.
 .
.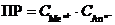 ®
® 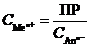
 .
. =
= 
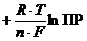
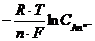
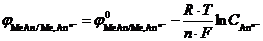 ,
,

 .
.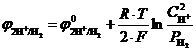

 . При постоянной температуре ее можно выразить как зависимость потенциала от pH раствора (
. При постоянной температуре ее можно выразить как зависимость потенциала от pH раствора ( ):
): ,
,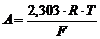 – константа. Для стандартной температуры (Т 0 = 298 К) А»0,059.
– константа. Для стандартной температуры (Т 0 = 298 К) А»0,059.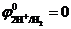 В. Для данной системы стандартными условиями будут парциальное давление водорода р 0=1,013×105 Па; активность ионов водорода в электролите а = 1 моль/л; Т 0 = 298 К. Стандартный водородный электрод используется в качестве электрода сравнения при измерении потенциалов других электродов.
В. Для данной системы стандартными условиями будут парциальное давление водорода р 0=1,013×105 Па; активность ионов водорода в электролите а = 1 моль/л; Т 0 = 298 К. Стандартный водородный электрод используется в качестве электрода сравнения при измерении потенциалов других электродов. .
.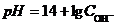 ):
):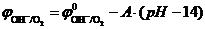 , где А» 0,059.
, где А» 0,059.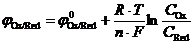 .
.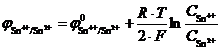 .
. .
. Ионселективные электроды. Ионселективный (ионообменный) электрод состоит из электрода второго рода, контактирующего с внутренним раствором, и тонкой мембраны, отделяющей внутренний раствор электрода от внешнего раствора.
Ионселективные электроды. Ионселективный (ионообменный) электрод состоит из электрода второго рода, контактирующего с внутренним раствором, и тонкой мембраны, отделяющей внутренний раствор электрода от внешнего раствора.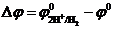 или положительным
или положительным  . За стандартный электродный потенциал принимается измеренная разность потенциалов соответственно j0 = ± Dj.
. За стандартный электродный потенциал принимается измеренная разность потенциалов соответственно j0 = ± Dj.

