Соединения, содержащие в молекуле различные функциональные группы, называются гетерофункциональными или соединениями со смешанными функциями. К ним относятся галогенозамещенные кислоты, гидроксикислоты, аминокислоты, углеводы и др.
 19.1 Галогенозамещенные кислоты. Эти кислоты содержат одновременно атом галогена и карбоксильную группу. Общую формулу этих кислот можно представить в виде:
19.1 Галогенозамещенные кислоты. Эти кислоты содержат одновременно атом галогена и карбоксильную группу. Общую формулу этих кислот можно представить в виде:

 Называются:
Называются:
Способы получения:
 Галогенирование карбоновых кислот, при этом атом галогена вступает в a-положение к карбоксильной группе:
Галогенирование карбоновых кислот, при этом атом галогена вступает в a-положение к карбоксильной группе:
 Присоединение галогенов или галогеноводородов к непредельным кислотам:
Присоединение галогенов или галогеноводородов к непредельным кислотам:
Присоединение галогеноводородов протекает против правила Марковникова с образованием b-галогенозамещенных кислот.
Химические свойства.
Для галогенозамещенных кислот характерны реакции по галогену (нуклеофильного замещения). Например:

 Реакции по карбоксильной группе:
Реакции по карбоксильной группе:
19.2 Гидроксикислоты. Гидроксикислотами называют органические вещества, молекулы которых содержат две функциональные группы – гидроксильную и карбоксильную.
Классификация.
В зависимости от количества карбоксильных групп они делятся на одноосновные, двухосновные и т.д.
В зависимости от числа гидроксильных групп (учитывается и группа ОН карбоксильной группы) они делятся на двухатомные, трехатомные и т.д.
 Простейшей кислотой является гликолевая одноосновная двухатомная кислота:
Простейшей кислотой является гликолевая одноосновная двухатомная кислота:
Номенклатура. По рациональной номенклатуре положение гидроксильной группы указывают буквами греческого алфавита
(a, b, g и т.д.). называют кислоту травилаьным названием с прибавлением приставки гидрокси:
По систематической номенклатуре к названию карбоновой кислоты прибавляют приставку гидрокси с цифрой, 
 указывающей ее положение:
указывающей ее положение:
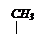
Способы получения:
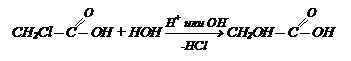 Гидролиз галогенозамещенных кислот:
Гидролиз галогенозамещенных кислот:
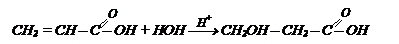 Гидратация непредельных кислот (реакция протекает против правила Марковникова):
Гидратация непредельных кислот (реакция протекает против правила Марковникова):
 Гидролиз циангидринов, получаемых из альдегидов и кетонов:
Гидролиз циангидринов, получаемых из альдегидов и кетонов:
По этой реакции получаются a-гидроксикислоты.
Окисление кислот, содержащих третичный атом углерода:
 При действии Н2О2 (пероксида водорода) получаются
При действии Н2О2 (пероксида водорода) получаются
b-гидроксикислоты:
Окисление гликолей:
Физические и химические свойства. Гидроксикислоты – высококипящие жидкости или кристаллические вещества, хорошо растворимые в воде, плохо в органических растворителях. Они обладают более выраженными кислотными свойствами, чем соответствующие карбоновые кислоты. Гидроксикислоты проявляют свойства карбоновых кислот, спиртов, специфические свойства.
 Реакции по карбоксильной группе. Они образуют соли, сложные эфиры, амиды и т.д. Например:
Реакции по карбоксильной группе. Они образуют соли, сложные эфиры, амиды и т.д. Например:
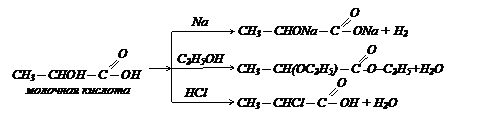 Реакции по спиртовой группе.
Реакции по спиртовой группе.
 Специфические свойства. В реакциях, когда одновременно участвуют карбоксильная и спиртовая группа, гидроксикислоты проявляют свойства отличные от кислот и спиртов. При нагревании a-гидроксикислот образуется циклический продукт – лактид. Молекула воды отщепляется от двух молекул кислоты.
Специфические свойства. В реакциях, когда одновременно участвуют карбоксильная и спиртовая группа, гидроксикислоты проявляют свойства отличные от кислот и спиртов. При нагревании a-гидроксикислот образуется циклический продукт – лактид. Молекула воды отщепляется от двух молекул кислоты.
 При нагревании b-гидроксикислот образуются непредельные кислоты
При нагревании b-гидроксикислот образуются непредельные кислоты
 При нагревании g-гидроксикислот образуются внутренние сложные эфиры – лактоны.
При нагревании g-гидроксикислот образуются внутренние сложные эфиры – лактоны.
 Оптическая изомерия. Многие гидроксикислоты содержат ассиметрический атом углерода. Этот атом углерода связан с четырьмя разными заместителями. Например:
Оптическая изомерия. Многие гидроксикислоты содержат ассиметрический атом углерода. Этот атом углерода связан с четырьмя разными заместителями. Например:
Вещества с ассиметрическим атомом углерода существуют в виде двух пространственных изомеров. Такие изомеры называют зеркальными или оптическими. У этих изомеров различное отношение к поляризованному свету: один из изомеров вращает плоскость поляризации влево, другой на такой же угол - вправо. Поэтому пару зеркальных изомеров называют оптическими антиподами, а способность веществ вращать плоскость поляризации света – оптической активностью. При помощи проекционных формул Фишера строение оптических антиподов молочной кислоты изображается следующим образом:

В проекционной формуле Фишера L обозначает вращение плоскости поляризованного света влево (группа ОН расположена слева), а D – вправо (группа ОН расположена справа). Одно из простейших оптически активных веществ – молочная кислота существует в трех формах: правовращающая (+), левовращающая (-) и оптически неактивная (±).
(+) Молочная кислота – кристаллическое вещество, tпл = 25-26 0С. Содержится в мышечном соке и ее назвали мясомолочной кислотой, [a] = +3,820.
(-) Левовращающая молочная кислота – отличается от правовращающей лишь знаком вращения, [a] = -3,820.
(±) Оптически неактивная молочная кислота – кристаллическое вещество, tпл = 18 0С, обычно существует в виде густого сиропа, хорошо растворима в воде. Отсутствие оптического вращения (±) объясняется тем, что она представляет смесь одинаковых количеств L и D молочных кислот.
Отдельные представители.
 Молочная кислота СН3 – СНОН – СООН. Впервые была обнаружена в прокисшем молоке. Она получается при брожении сахаров:
Молочная кислота СН3 – СНОН – СООН. Впервые была обнаружена в прокисшем молоке. Она получается при брожении сахаров:
 В промышленности получают из уксусного альдегида:
В промышленности получают из уксусного альдегида:
Молочная кислота используется при консервировании, обработке кож, в текстильной промышленности и в различных синтезах.
 Яблочная кислота НООС – СН2 – СНОН – СООН - содержится в ягодах, фруктах. В природе широко распространен L(-) стереоизомер.
Яблочная кислота НООС – СН2 – СНОН – СООН - содержится в ягодах, фруктах. В природе широко распространен L(-) стереоизомер.
Лимонная кислота
– кристаллическое вещество, tпл = 153 0С, хорошо растворима в воде. Содержится в лимонах, апельсинах, винограде, крыжовнике, малине, свекле. Она применяется при крашении, в медицине, пищевой промышленности.
Салициловая кислота (о-гидроксибензойная кислота) – бесцветное кристаллическое вещество, tпл = 159 0С плохо растворима в воде, хорошо в спирте. В промышленности получают:
- действием СО2 на фенолят натрия:

- нагреванием основной медной соли бензойной кислоты:
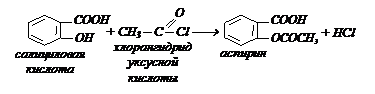 Салициловая кислота применяется в медицине, при консервировании, в аналитической химии. Широко используют эфиры этой кислоты – лекарственные препараты: аспирин (жаро-болеутоляющие средство), салол (при желудочно-кишечных заболеваниях). Их получают:
Салициловая кислота применяется в медицине, при консервировании, в аналитической химии. Широко используют эфиры этой кислоты – лекарственные препараты: аспирин (жаро-болеутоляющие средство), салол (при желудочно-кишечных заболеваниях). Их получают:
- 3 Аминокислоты.
Аминокислотами называют соединения, содержащие в молекуле одновременно карбоксильную группу и аминогруппу. В зависимости от числа функциональных групп различают:
- моноаминомонокарбоновые кислоты:

- моноаминодикарбоновые кислоты:
- диаминомонокарбоновые кислоты:

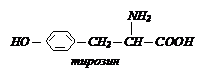 - гидроксиаминокислоты:
- гидроксиаминокислоты:
 - серосодержащие аминокислоты:
- серосодержащие аминокислоты:
Номенклатура. Название аминокислот по систематической номенклатуре строят из названия кислоты с добавлением приставки амино, положение которой в углеродной цепи указывается цифрой. Широко используются травиальные названия и названия по рациональной номенклатуре. Например:

Способы получения:
 Действие аммиака на галогенозамещенные карбоновые кислоты:
Действие аммиака на галогенозамещенные карбоновые кислоты:
Из полученной аммонийной соли выделяют аминокислоту действием минеральной кислоты.

 Действие аммиака на непредельные кислоты. Присоединение идет против правила Марковникова, при этом образуются b-аминокислоты:
Действие аммиака на непредельные кислоты. Присоединение идет против правила Марковникова, при этом образуются b-аминокислоты:
| |
| | | СН2 = СН – С – ОН + Н – NН2 ¾® СН2(NН2) – СН2 – С – ОН
| |
 Действие на альдегиды и кетоны NН4СN (цианида аммония):
Действие на альдегиды и кетоны NН4СN (цианида аммония):
Гидролиз белковых веществ под влиянием различных ферментов, кислот, щелочей.
Физико-химические свойства. Присутствие в молекуле аминокислоты аминогруппы (носитель основных свойств) и карбоксильной (носитель кислотных свойств) приводит к внутримолекулярной нейтрализации, взаимодействию между собой:
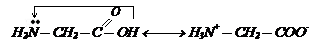
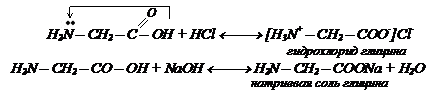 Поэтому их можно представить в виде внутренних солей, что сказывается на физических свойствах аминокислот. Подобно обычным неорганическим солям, они кристаллические вещества, растворимы в воде, мало в органических реагентах, плавятся при высоких темпиратурах. Аминокислоты – амфотерные соединения и образуют соли как с кислотами, так и основаниями.
Поэтому их можно представить в виде внутренних солей, что сказывается на физических свойствах аминокислот. Подобно обычным неорганическим солям, они кристаллические вещества, растворимы в воде, мало в органических реагентах, плавятся при высоких темпиратурах. Аминокислоты – амфотерные соединения и образуют соли как с кислотами, так и основаниями.
В молекулах аминокислот существует взаимное влияние функциональных групп. Аминогруппа являлась электронодонорной группой повышает полярность связи
О Н в карбоксильной группе, и, следовательно, усиливает кислотные свойства. Карбоксильная группа, являясь электроноакцепторной, понижает электронную плотность на атоме азота, затрудняя присоединение протона, и, следовательно, ослабляет основные свойства. С удалением функциональных групп друг от друга взаимное влияние ослабляется.
Реакции, протекающие с участием карбоксильной группы.
 Взаимодействие со спиртами:
Взаимодействие со спиртами:
 Взаимодействие с NН3.
Взаимодействие с NН3.
 Нагревание.
Нагревание.
Реакции, протекающие с участием аминогруппы.
 Взаимодействие с галогенопроизводными:
Взаимодействие с галогенопроизводными:
 Взаимодействие с хлорангидридами кислот:
Взаимодействие с хлорангидридами кислот:
 Взаимодействие с азотистой кислотой НNО2:
Взаимодействие с азотистой кислотой НNО2:
Нагревание. a, b, g - аминокислоты по разному ведут себя по отношению к нагреванию.
 a - аминокислоты образуют циклические амиды – дикетопиперазины:
a - аминокислоты образуют циклические амиды – дикетопиперазины:
 b - аминокислоты образуют непредельные кислоты:
b - аминокислоты образуют непредельные кислоты:
 g - аминокислоты образуют циклические амиды – лактамы:
g - аминокислоты образуют циклические амиды – лактамы:
Реакции конденсации. При конденсации небольшого числа молекул a - аминокислот, получаются вещества, называемые пептидами, а из множества – полипептидами; Вещества состоящие из более 100 аминокислот – белками. Образование пептидов можно показать на примере образования дипептидов, трипептидов и т.д.

Отдельные представители. Важнейшими из аминокислот являются a - аминокислоты, так как являются главной составной частью белковых веществ.
Глицин большую роль играет в процессе обмена веществ, в обезвреживании ядовитых веществ.
a - Аланин – им богат фиброин шелка, входит в состав всех белков. Аминокислоты, содержащие функциональные группы в бензольном ядре, используются при синтезах красителей, лекарственных препаратов.
19.4 Вопросы для самопроверки.
1. Какие соединения называются гетерофункциональными, галогенозамещенными кислотами, гидроксикислотами, аминокислотами?
 2. Способы получения галогенозамещенных кислот.
2. Способы получения галогенозамещенных кислот.
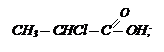 3. Назовите кислоты:
3. Назовите кислоты:
4. Химические свойства галогенозамещенных кислот:
- реакции по карбоксильной группе;
- реакции по галогену.
5. Классификация гидроксикислот.
 6. Назовите кислоты:
6. Назовите кислоты:
7. Способы получения гидроксикислот.
8. Физико-химические свойства:
- реакции по карбоксильной группе;
- реакции по спиртовой группе;
- специфические свойства.
9. Оптическая изомерия, дайте определение.
10. Молочная кислота, способы получения, применение.
11. Салициловая кислота, способы получения, применение.
12. Классификация аминокислот.
 13. Назовите кислоты:
13. Назовите кислоты:
14. Способы получения аминокислот.
15. Физические свойства. Аминокислоты – внутренние соли.
16. Химические свойства, амфотерный характер аминокислот:
- реакции по карбоксильной группе;
- реакции с участием аминогруппы;
- реакции при нагревании a, b, g - аминокислот;
- реакции конденсации.
17. Почему водный раствор аминокислот нейтрален?
18. Какой атом углерода называется ассиметрическим?
19. Почему гидроксикислоты более сильные кислоты, чем соответствующие карбоновые кислоты?
20. Напишите уравнения реакций получения дипептида глицилаланина, трипептида аланилвалилглицина.
21. Какие вещества называют оптически активными?
22. У какой a-аминокислоты или b-аминопропионовой кислоты кислотные свойства выражены сильнее. Ответ мотивируйте.
23. У какой из кислот в п. 22 выражены ярче основные свойства. Ответ мотивируйте.
19.5 Обучающее задание №1.
Назовите и охарактеризуйте следующие соединения:

Решение:
а) 4метил-2-хлорпентановая кислота;
a-хлоризокапроновая кислота.
Это соединение является галогенозамещенной кислотой, проявляет свойства кислот и галогенопроизводных.
б) 2-гидрокси-2-метилпропановая кислота;
a-гидроксиизомасляная кислота.
Относится к гидроксикислотам, проявляет свойства кислот и спиртов.
в) 2-амино-3-фенилпропановая кислота;
a-амино-b-фенилпропионовая кислота;
фенилаланин.
Это соединение моноаминомонокарбоновая кислота, проявляет амфотерные свойства.
Обучающее задание №2.

Осуществите следующие превращения:

Решение:
Обучающее задание №3.
Исходя из ацетона получите a-гидроксиизомасляную кислоту.
 Решение:
Решение:

Обучающее задание №4.
Имея в наличии уксусную кислоту и другие неорганические соединения получите дипептид глицилаланина.
 Решение:
Решение:
Обучающее задание №5.
Смешали равные количества этанола и молочной кислоты. С этой смесью может вступить в реакцию максимально 5 г карбоната кальция. Определите массу натрия, которая может вступить с такой же массой исходной смеси.

 Решение: с карбонатом кальция будет реагировать только молочная кислота.
Решение: с карбонатом кальция будет реагировать только молочная кислота.
 Напишем уравнение реакции и подставим над СаСО3 0,05 моль:
Напишем уравнение реакции и подставим над СаСО3 0,05 моль:
n(C3Н6О3) = 2nСаСО3 = 0,1 моль.
Следовательно в исходной смеси количество молочной кислоты и этанола было по 0,1 моль, так как их смешивали равные количества.
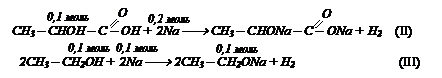 Напишем уравнения реакций взаимодействия этих веществ с Nа:
Напишем уравнения реакций взаимодействия этих веществ с Nа:
Из уравнений (II) и (III) определим:
n(Nа) = 0,2 + 0,1 = 0,3 моль
m(Nа) = n(Na)*M(Na) = 0,3*23 = 6,9 г
Ответ: 6,9 г.
19. 6 Контрольное задание №1.
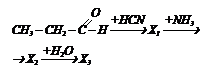 Какие вещества получаются при следующих превращениях? Какие вещества получаются при следующих превращениях?
|
 1 1
|
| а
| СН3СН2СНСlСООН; СН3СН2СНСlСОСl;
СН3СН2СН(NН2)СОNН2
|
|
|
| б
| (СН3)2СОНСN; (СН3)2СОНСООН; (СН3)2ССlСООН
|
|
| 
| в
| СН2СlСН(СН3)СООН; СН2ОНСН(СН3)СООН;
СН2(ОН)СН(СН3)СООNа
|
| СН2NН2СН(СН3)СООН ¾® Х1 ¾¾®
® Х2 ¾¾® Х3
| | 4
| 
| г
| СН3СН2СНОНСN; СН3СН2СНNН2СN; СН3СН2СНNН2СООН
|
|
|
| д
| СН2ОНСООН; СН2NН2СООН; СН2NН2СООNа
|
|
|  
| е
| СН2С(СН3)СООН; СН2СlСН(СН3)СООН; СН2(NН2)СН(СН3)СООН
|
|
| 
| ж
| СН2СНСООН; СН2(ОН)СН2СООН; СН2СlСН2СООН
|
|
| 
| з
| СН3СНСlСООН; СН2=СНСООН; СН2ОНСН2СООН
|
|
|   | CН2=С – С – ОН ¾¾® Х1 ¾¾®
® Х2 ¾¾® Х3
| |
| и
| СН2NН2СН2СООН;
СН2(NН2)СН2СООСН3; NН3Сl(СН2)2СООСН3
|
|
|
| к
| (СН3)2СОНСООН; (СН3)2ССlСООН; (СН3)2СОНСООН
|
Контрольное задание №2.

 1. Назовите кислоты:
1. Назовите кислоты:
 2. Осуществите следующие превращения, написав уравнения реакций:
2. Осуществите следующие превращения, написав уравнения реакций:


3. Исходя из метана и не используя другие углеродосодержащие соединения, получите a-гидроксипропионовую кислоту.
4. Из хлористого пропила получите a-аминомасляную кислоту.
5. Из уксусного альдегида и неорганических реагентов получите a-хлорпропионовую кислоту.
6. Имея в наличии этиловый спирт и неорганические реагенты, получите этиловый эфир глицина.
7. Исходя из этилена и неорганических соединений, получите лактат кальция.
8. Из бутана и неорганических веществ получите глицин.
9. Из ацетона получите a-хлоризомасляную кислоту.
10. Из пропаналя и других неорганических реагентов получите пропиловый эфир a-аминопропионовой кислоты.
11. Определите массу глицина, вступившего в реакцию с гидрокарбонатом натрия, если было получено 15,52 г соли с выходом 80%.
Ответ: 19,4 г.
12. Определите массу молочной кислоты, полученной из 36 кг глюкозы, если выход кислоты составил 70%.
Ответ: 12,6 кг.
13. Какой объем ацетилена потребуется для получения 21,35 г бромуксусной кислоты, если выход продуктов на каждой стадии получения кислоты составлял по 80%.
Ответ: 6,72 л.
14. Аминоуксусную кислоту получили из уксусной кислоты массой 24 г с выходом 60%. Какой объем раствора NаОН с массовой долей 15% (r = 1,16 г/мл) потребуется для нейтрализации аминоуксусной кислоты?
Ответ: 55,2 мл.
15. К 22,05 г 3-аминопентадиовой кислоты добавили 350 г 4,00%-го раствора КОН. Вычислите массовые доли веществ в получившемся растворе.
Ответ: 2,49% кислой калиевой соли;
5,99% дикалиевой соли.
16. Напишите уравнения реакций образования четырех дипептидов из глицина и аланина.
17. Установите молекулярную формулу моноаминомонокарбоновой кислоты, массовая доля азота в которой составляет 13,59%.
Ответ: С4Н9NО2.
18. Найдите массу 10%-ного раствора гидроксида калия, необходимого для нейтрализации 61,8 г g-аминомасляной кислоты.
Ответ: 336 г.
19. Какую массу дипептида глицилглицина можно получить из 15 г аминоуксусной кислоты, если выход продукта реакции составляет 60%.
Ответ: 7,92 г.
20. Через смесь аминоуксусной кислоты и этилового спирта (безводного) пропустили 0,5 л хлороводорода. При этом образовалось 1,4 г твердого вещества. Определите массовую долю веществ в исходной смеси.
Ответ: 33,3% С2Н5ОН; 66,7% аминоуксуной кислоты
Глава 20. Углеводы.
Углеводы – широко распространенная в природе группа веществ, имеющая важное значение в жизни живых организмов, растений. Название углеводы возникло с того времени, когда строение их не было известно, но установлен был их состав Сn(Н2О)m – соединение углерода с водой.
Известно, что в растениях содержится до 80% углеводов, а в живых организмах около 20% (в пересчете на сухое вещество). Они входят в состав нуклеотидов, из которых построены нуклеиновые кислоты, осуществляющие биосинтез белка и передачу наследственных свойств. Углеводы - один из основных продуктов питания.
Классификация.
Моносахариды (простые углеводы) – не подвергаются гидролизу. Они делятся на тетрозы (С4), пентозы (С5), гексозы (С6). Моносахариды, содержащие альдегидную группу называются альдозами, а кетонную – кетозами.
Сложные углеводы можно разделить на олигосахариды и полисахариды.
Олигосахариды – продукты конденсации нескольких молекул моносахаридов (от 2 до 10).
Полисахариды – высокомолекулярные вещества, продукты конденсации большого количества молекул моносахаридов.
Моносахариды.
В природе широко распространены гексозы С6Н12О6 и пентозы С5Н10О5. Из гексоз наибольшее значение имеют глюкоза и фруктоза.
Строение глюкозы. Глюкоза имеет состав С6Н12О6. на основе ее свойств установим строение.
Глюкоза, подобно альдегидам, дает реакцию «серебряного зеркала», следовательно она содержит альдегидную группу.
Глюкоза, подобно многоатомным спиртам, с Cu(ОН)2 образует синий раствор, следовательно, она содержит несколько гидроксильных групп.
При взаимодействии с уксусной кислотой образует сложный эфир пентаацетил глюкозу, следовательно, в его образовании участвовало пять групп ОН.
При действии йодводорода (НJ) образуется 2-йодгексан, следовательно, молекула глюкозы имеет неразветвленную цепь углеродных атомов.
 Учитывая, что атом углерода может прочно удерживать только одну группу ОН, молекуле можно приписать следующую форму строения
Учитывая, что атом углерода может прочно удерживать только одну группу ОН, молекуле можно приписать следующую форму строения
Эта форма строения называется альдегидной, а глюкоза называется альдозой или альдегидоспиртом. Напишем указанные выше уравнения реакций с этой формой строения.

 В молекуле глюкозы четыре ассиметрических атома углерода (обозначены *), поэтому для глюкозы возможны 24, т.е. 16 стереоизомеров
В молекуле глюкозы четыре ассиметрических атома углерода (обозначены *), поэтому для глюкозы возможны 24, т.е. 16 стереоизомеров
Однако, имея в составе альдегидную группу, глюкоза вступает не во все реакции характерные для альдегидов, она не образует гидросульфитного соединения, не дает окрашивания с фуксинсернистой кислотой. При взаимодействии с метиловым спиртом в реакцию вступает из пяти групп ОН только одна гидроксильная группа, с образованием простого эфира –
метилглюкозида. Установлено, что глюкоза может существовать в виде циклической формы строения (оксидной) или полуацетальной, находящейся в равновесии с альдегидной (таутомерные формы). Сущность таутомерного перехода заключается в том, что атом водорода гидроксильной группы при пятом атоме углерода переходит к атому кислорода карбонильной группы.
 Образуется шестичленный цикл. Вновь образующийся ассиметрический атом С1 может иметь 2 циклических изомера a и b-формы:
Образуется шестичленный цикл. Вновь образующийся ассиметрический атом С1 может иметь 2 циклических изомера a и b-формы:
Вновь возникшая гидроксильная группа у С1 называется глюкозидным гидроксилом. Эта группа отличается от всех остальных групп ОН своими свойствами, так как находится рядом с кислородом и в ней легче происходит замещение водорода, например, при действии метилового спирта.
Две формы строения глюкозы альдегидная и циклическая способны самопроизвольно переходить одна в другую в водных растворах в зависимости от условия протекания реакции и характера реагентов.
Химические свойства.
Восстановление:

Окисление.
 а) хлорной (бромной) водой:
а) хлорной (бромной) водой:
б) сильными окислителями (НNО3), при этом окисляется и первичная спиртовая группа, образуется двухосновная гидроксикислота.
Эти кислоты проявляют свойства гидроксикислот.
 Реакция с синильной кислотой (НСN):
Реакция с синильной кислотой (НСN):
 Реакция с фенилгидразином (NН2 – NH – С6Н5):
Реакция с фенилгидразином (NН2 – NH – С6Н5):
Алкилирование. При действии алкирирующих реагентов на глюкозу получают простые эфиры (неполные и полные).
При действии йодистого метила атом водорода во всех гидроксильных группах замещается на радикал метил (СН3):

В пентаметилглюкозе глюкозидный гидроксил при гидролизе легко отщепляется, образуя тетраметилглюкозу.
Тетраметилглюкоза, имея свободный глюкозидный гидроксил, может превращаться в альдегидную форму строения.
6. Брожение – разложение моносахаридов под действием различных микроорганизмов. Различают брожение:
 - спиртовое:
- спиртовое:
- молочнокислое:
- маслянокислое:
| |
| | | С6Н12О6 ¾¾¾¾¾¾¾® СН3–СН2–СН2–СООН+2СО2+2Н2
| |
 - в присутствии Na2SO3:
- в присутствии Na2SO3:
В живом организме происходит окисление глюкозы кислородом воздуха, при этом образуется углекислый газ и выделяется большое количество энергии:
С6Н12О6 + 6О2 ¾® 6СО2 + 6Н2О
Способы получения. В промышленности глюкозу получают гидролизом крахмала, клетчатки:
(С6Н10О5)n + nНОН ¾® nС6Н12О6
Гидролиз дисахаридов:
С12Н22О11 + НОН ¾® 2С6Н12О6
 В растениях углеводы образуются в процессе фотосинтеза под действием солнечной энергии:
В растениях углеводы образуются в процессе фотосинтеза под действием солнечной энергии:

Альдольная конденсация формальдегида в присутствии
Са(ОН)2:
6H-C-H ¾¾¾¾®С6Н12О6
Этот синтез был впервые осуществлен А.М. Бутлеровым (1861 г.).
Фруктоза С6Н12О6 – широко распространена в различных растениях. Ее называют плодовым сахаром.
Строение. В фруктозе, так же, как и в глюкозе, содержится пять гидроксильных групп, но в отличие от глюкозы, подобно кетонам она окисляется только сильными окислителями, с образованием двух кислот – гидроксиуксусной (CН2ОН-СООН)и тригидроксимасляной (СН2ОН – СНОН – СНОН - СООН).
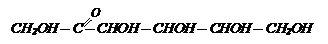 Следовательно, фруктоза имеет следующую форму строения:
Следовательно, фруктоза имеет следующую форму строения:
Эта форма строения называется кетонной, а фруктоза называется кетозой или кетоноспиртом. Для фруктозы известны и циклические формы строения в виде пятичленных циклов.

Фруктоза входит в состав дисахарида – сахарозы, полисахарида инулина.
Пятичленные циклические формы моносахаридов  называются фуранозными, так как в основе лежит пятичленное кольцо фурана:
называются фуранозными, так как в основе лежит пятичленное кольцо фурана:
В качестве представителей альдопентоз, играющих важную роль для живых организмов, приведем Д-рибозу (С5Н10О5) и
Д-дезоксирибозу (С5Н10О4):
Олигосахариды.
Строение и свойства. Важнейшими олигосахаридами являются дисахариды состава С12Н22О11, в молекулы которых могут входить остатки разных моносахаридов в циклических формах. Эти остатки соединяются связью, в образовании которой участвуют оба глюкозидных гидроксила или один глюкозидный и один спиртовой. Примером дисахаридов первого типа является сахароза. Выведем ее строение.
Сахароза не дает реакцию «серебряного зеркала», не окисляется сильными окислителями, следовательно она не содержит ни альдегидной, ни кетонной групп.
При взаимодействии с гидроксидами металлов образует например сахарат кальция С12Н22О11СаО.
Подвергается гидролизу, образуя глюкозу и фруктозу:
Следовательно, сахароза построена из остатков глюкозы и фруктозы, взятых в окисных формах.

 Как видно из структурной формулы сахарозы, в ней нет свободных глюкозидных гидроксилов и поэтому окисные формы строения не способны переходить в таутомерные альдегидные, а следовательно не проявляют свойства альдегидов (не дают реакции «серебряного зеркала», не восстанавливает фелингову жидкость). Такие дисахариды называются нево
Как видно из структурной формулы сахарозы, в ней нет свободных глюкозидных гидроксилов и поэтому окисные формы строения не способны переходить в таутомерные альдегидные, а следовательно не проявляют свойства альдегидов (не дают реакции «серебряного зеркала», не восстанавливает фелингову жидкость). Такие дисахариды называются нево



 19.1 Галогенозамещенные кислоты. Эти кислоты содержат одновременно атом галогена и карбоксильную группу. Общую формулу этих кислот можно представить в виде:
19.1 Галогенозамещенные кислоты. Эти кислоты содержат одновременно атом галогена и карбоксильную группу. Общую формулу этих кислот можно представить в виде:
 Называются:
Называются:
 Галогенирование карбоновых кислот, при этом атом галогена вступает в a-положение к карбоксильной группе:
Галогенирование карбоновых кислот, при этом атом галогена вступает в a-положение к карбоксильной группе: Присоединение галогенов или галогеноводородов к непредельным кислотам:
Присоединение галогенов или галогеноводородов к непредельным кислотам:
 Реакции по карбоксильной группе:
Реакции по карбоксильной группе: Простейшей кислотой является гликолевая одноосновная двухатомная кислота:
Простейшей кислотой является гликолевая одноосновная двухатомная кислота:

 указывающей ее положение:
указывающей ее положение: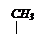
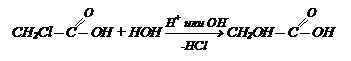 Гидролиз галогенозамещенных кислот:
Гидролиз галогенозамещенных кислот: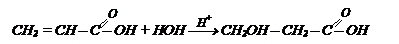 Гидратация непредельных кислот (реакция протекает против правила Марковникова):
Гидратация непредельных кислот (реакция протекает против правила Марковникова): Гидролиз циангидринов, получаемых из альдегидов и кетонов:
Гидролиз циангидринов, получаемых из альдегидов и кетонов: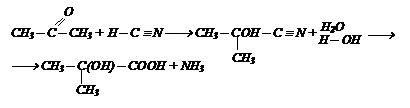
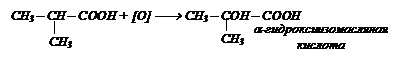
 При действии Н2О2 (пероксида водорода) получаются
При действии Н2О2 (пероксида водорода) получаются 
 Реакции по карбоксильной группе. Они образуют соли, сложные эфиры, амиды и т.д. Например:
Реакции по карбоксильной группе. Они образуют соли, сложные эфиры, амиды и т.д. Например: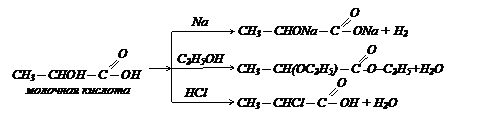 Реакции по спиртовой группе.
Реакции по спиртовой группе. Специфические свойства. В реакциях, когда одновременно участвуют карбоксильная и спиртовая группа, гидроксикислоты проявляют свойства отличные от кислот и спиртов. При нагревании a-гидроксикислот образуется циклический продукт – лактид. Молекула воды отщепляется от двух молекул кислоты.
Специфические свойства. В реакциях, когда одновременно участвуют карбоксильная и спиртовая группа, гидроксикислоты проявляют свойства отличные от кислот и спиртов. При нагревании a-гидроксикислот образуется циклический продукт – лактид. Молекула воды отщепляется от двух молекул кислоты. При нагревании b-гидроксикислот образуются непредельные кислоты
При нагревании b-гидроксикислот образуются непредельные кислоты При нагревании g-гидроксикислот образуются внутренние сложные эфиры – лактоны.
При нагревании g-гидроксикислот образуются внутренние сложные эфиры – лактоны. Оптическая изомерия. Многие гидроксикислоты содержат ассиметрический атом углерода. Этот атом углерода связан с четырьмя разными заместителями. Например:
Оптическая изомерия. Многие гидроксикислоты содержат ассиметрический атом углерода. Этот атом углерода связан с четырьмя разными заместителями. Например:
 Молочная кислота СН3 – СНОН – СООН. Впервые была обнаружена в прокисшем молоке. Она получается при брожении сахаров:
Молочная кислота СН3 – СНОН – СООН. Впервые была обнаружена в прокисшем молоке. Она получается при брожении сахаров: В промышленности получают из уксусного альдегида:
В промышленности получают из уксусного альдегида: Яблочная кислота НООС – СН2 – СНОН – СООН - содержится в ягодах, фруктах. В природе широко распространен L(-) стереоизомер.
Яблочная кислота НООС – СН2 – СНОН – СООН - содержится в ягодах, фруктах. В природе широко распространен L(-) стереоизомер.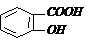


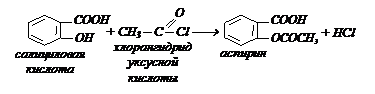 Салициловая кислота применяется в медицине, при консервировании, в аналитической химии. Широко используют эфиры этой кислоты – лекарственные препараты: аспирин (жаро-болеутоляющие средство), салол (при желудочно-кишечных заболеваниях). Их получают:
Салициловая кислота применяется в медицине, при консервировании, в аналитической химии. Широко используют эфиры этой кислоты – лекарственные препараты: аспирин (жаро-болеутоляющие средство), салол (при желудочно-кишечных заболеваниях). Их получают:



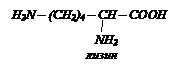

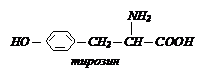 - гидроксиаминокислоты:
- гидроксиаминокислоты: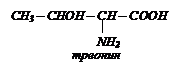
 - серосодержащие аминокислоты:
- серосодержащие аминокислоты:
 Действие аммиака на галогенозамещенные карбоновые кислоты:
Действие аммиака на галогенозамещенные карбоновые кислоты:
 Действие аммиака на непредельные кислоты. Присоединение идет против правила Марковникова, при этом образуются b-аминокислоты:
Действие аммиака на непредельные кислоты. Присоединение идет против правила Марковникова, при этом образуются b-аминокислоты: Действие на альдегиды и кетоны NН4СN (цианида аммония):
Действие на альдегиды и кетоны NН4СN (цианида аммония):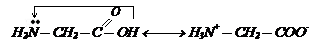
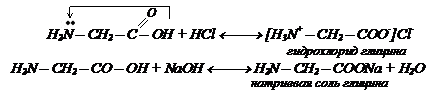 Поэтому их можно представить в виде внутренних солей, что сказывается на физических свойствах аминокислот. Подобно обычным неорганическим солям, они кристаллические вещества, растворимы в воде, мало в органических реагентах, плавятся при высоких темпиратурах. Аминокислоты – амфотерные соединения и образуют соли как с кислотами, так и основаниями.
Поэтому их можно представить в виде внутренних солей, что сказывается на физических свойствах аминокислот. Подобно обычным неорганическим солям, они кристаллические вещества, растворимы в воде, мало в органических реагентах, плавятся при высоких темпиратурах. Аминокислоты – амфотерные соединения и образуют соли как с кислотами, так и основаниями. Взаимодействие со спиртами:
Взаимодействие со спиртами: Взаимодействие с NН3.
Взаимодействие с NН3. Нагревание.
Нагревание. Взаимодействие с галогенопроизводными:
Взаимодействие с галогенопроизводными: Взаимодействие с хлорангидридами кислот:
Взаимодействие с хлорангидридами кислот: Взаимодействие с азотистой кислотой НNО2:
Взаимодействие с азотистой кислотой НNО2: a - аминокислоты образуют циклические амиды – дикетопиперазины:
a - аминокислоты образуют циклические амиды – дикетопиперазины: b - аминокислоты образуют непредельные кислоты:
b - аминокислоты образуют непредельные кислоты: g - аминокислоты образуют циклические амиды – лактамы:
g - аминокислоты образуют циклические амиды – лактамы:
 2. Способы получения галогенозамещенных кислот.
2. Способы получения галогенозамещенных кислот.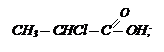 3. Назовите кислоты:
3. Назовите кислоты:
 6. Назовите кислоты:
6. Назовите кислоты: 13. Назовите кислоты:
13. Назовите кислоты:
 Осуществите следующие превращения:
Осуществите следующие превращения:



 Решение:
Решение:
 Решение:
Решение:
 Решение: с карбонатом кальция будет реагировать только молочная кислота.
Решение: с карбонатом кальция будет реагировать только молочная кислота. Напишем уравнение реакции и подставим над СаСО3 0,05 моль:
Напишем уравнение реакции и подставим над СаСО3 0,05 моль: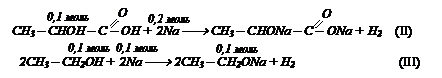 Напишем уравнения реакций взаимодействия этих веществ с Nа:
Напишем уравнения реакций взаимодействия этих веществ с Nа: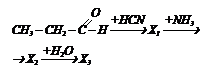 Какие вещества получаются при следующих превращениях?
Какие вещества получаются при следующих превращениях?
 1
1









 1. Назовите кислоты:
1. Назовите кислоты:

 2. Осуществите следующие превращения, написав уравнения реакций:
2. Осуществите следующие превращения, написав уравнения реакций:


 Учитывая, что атом углерода может прочно удерживать только одну группу ОН, молекуле можно приписать следующую форму строения
Учитывая, что атом углерода может прочно удерживать только одну группу ОН, молекуле можно приписать следующую форму строения


 В молекуле глюкозы четыре ассиметрических атома углерода (обозначены *), поэтому для глюкозы возможны 24, т.е. 16 стереоизомеров
В молекуле глюкозы четыре ассиметрических атома углерода (обозначены *), поэтому для глюкозы возможны 24, т.е. 16 стереоизомеров
 Образуется шестичленный цикл. Вновь образующийся ассиметрический атом С1 может иметь 2 циклических изомера a и b-формы:
Образуется шестичленный цикл. Вновь образующийся ассиметрический атом С1 может иметь 2 циклических изомера a и b-формы:


 а) хлорной (бромной) водой:
а) хлорной (бромной) водой:
 Реакция с синильной кислотой (НСN):
Реакция с синильной кислотой (НСN): Реакция с фенилгидразином (NН2 – NH – С6Н5):
Реакция с фенилгидразином (NН2 – NH – С6Н5):


 - спиртовое:
- спиртовое: - в присутствии Na2SO3:
- в присутствии Na2SO3: В растениях углеводы образуются в процессе фотосинтеза под действием солнечной энергии:
В растениях углеводы образуются в процессе фотосинтеза под действием солнечной энергии: Альдольная конденсация формальдегида в присутствии Са(ОН)2:
Альдольная конденсация формальдегида в присутствии Са(ОН)2:
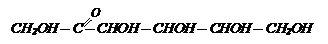 Следовательно, фруктоза имеет следующую форму строения:
Следовательно, фруктоза имеет следующую форму строения:
 называются фуранозными, так как в основе лежит пятичленное кольцо фурана:
называются фуранозными, так как в основе лежит пятичленное кольцо фурана:


 Как видно из структурной формулы сахарозы, в ней нет свободных глюкозидных гидроксилов и поэтому окисные формы строения не способны переходить в таутомерные альдегидные, а следовательно не проявляют свойства альдегидов (не дают реакции «серебряного зеркала», не восстанавливает фелингову жидкость). Такие дисахариды называются нево
Как видно из структурной формулы сахарозы, в ней нет свободных глюкозидных гидроксилов и поэтому окисные формы строения не способны переходить в таутомерные альдегидные, а следовательно не проявляют свойства альдегидов (не дают реакции «серебряного зеркала», не восстанавливает фелингову жидкость). Такие дисахариды называются нево


