Тип членистоногих объединяет самую многочисленную среди первичноротых группу животных. Подобно кольчатым червям, членистоногие имеют двусторонне-симметричное тело, разделенное на сегменты, однако сегментация у членистоногих не гомономная, а гетерономная. К числу характерных особенностей членистоногих следует отнести: наружный хитиновый скелет, отсутствие сплошного кожно-мускульного мешка, дальнейшее развитие цепочечной нервной системы, которая обусловливает высокую приспособляемость и эволюционную пластичность этих животных. Наиболее высокой организации достигает нервная система у насекомых. Ниже мы остановимся на ее структурной и функциональной характеристике.
Центральная нервная система насекомых подразделяется на головные ганглии и туловищный мозг - брюшную нервную цепочку БНЦ). Различают два отдела БНЦ: грудной и брюшной. В грудном отделе обычно находятся три ганглия: проторакальный, мезоторакальный и метаторакальный, которые либо лежат отдельно, либо сливаются в общую массу (рис. 9). Грудные ганглии наиболее развиты и выполняют важную функцию, осуществляя иннервацию конечностей и крыльев у насекомых. Брюшной отдел БНЦ представлен более мелкими и более просто организованными ганглиями, общее число которых достигает восьми. Наиболее сложен последний брюшной ганглий, который иннервирует заднюю кишку, церки и половые органы.
У насекомых широкое развитие получает концентрация БНЦ путем укорочения продольных коннективов и слияния сегментарных ганглиев. Так, например, у перепончатокрылых (медоносная пчела) второй и третий грудные ганглии сливаются в один синганглий, у прямокрылых (домовой сверчок) третий грудной ганглий образуется в результате слияния одного грудного и двух брюшных ганглиев. Однако строгой корреляции между концентрацией ганглиев и таксономическим положением насекомых не отмечается, так что иногда в пределах одного отряда можно найти виды с различным числом ганглиев. БНЦ насекомых покрыта оболочкой – перилеммой, состоящей из двух слоев: нейрилеммы и перинейриума. Нейрилемма толщиной 4-7 мкм выполняет главным образом механическую функцию за счет содержащихся в ней коллагеновых волокон. Перинейриум представляет собой клеточный слой оболочки, который принимает активное участие в обменных процессах между гемолимфой и внутренней средой ганглия. По данным электронной микроскопии, между клетками перинейриума обнаружены каналы, по которым осуществляется транспорт питательных веществ и катионов. Каналы заканчиваются образованиями, содержащими кислые мукополисахариды. Свободные анионные группы мукополисахаридов могут связывать проникающие из гемолимфы катионы. Таким образом, модифицированные глиальные клетки перинейриума выполняют барьерную функцию и поддерживают постоянную концентрацию ионов в ганглии.

Рис. 9. Строение головных и грудных ганглиев богомола Mantis religiosa (по: В.П. Тыщенко, 1977):
А - надглоточный ганглий, Б - подглоточный ганглий, В - грудные ганглии; 1 - нервы дорсальных глазков, 2 - протоцеребрум, 3 - зрительные доли, 4 – фасеточные глаза, 5 - дейтоцеребрум, 6 - двигательный и чувствительный корешок антеннального нерва, 7 - тритоцеребрум, 8 – окологлоточные коннективы, 9 – церебральный нерв, 10 - коннективы между подглоточным и проторакальным ганглиями, 11 - лабиальный нерв, 12 - максиллярный нерв, 13 - мандибулярный нерв, 14 - проторакальный ганглий, 15 - нервы первой пары ног, 16 - коннективы, 17 - мезоторакальный ганглий, 18 - метаторакальный ганглий, 19 - непарный нерв
Дальнейшая транспортировка питательных веществ и ионов к нервным клеткам происходит через клетки нейроглии. Они окружают тела нервных клеток и нейропиль компактным слоем, через который проходят трахеи, несущие функцию газообмена.
Внутренняя структура сегментарных ганглиев БНЦ насекомых достаточно дифференцирована. А. А. Заварзин на примере личинки стрекозы выделил следующие области в нейропиле сегментарного ганглия:
1) дорсальная область коннективных волокон, которая содержит аксоны, проходящие транзитом из одного ганглия в другой; часть из них оканчивается в нейропиле концевыми разветвлениями;
2) область дорсальных корешков - двигательный нейропиль; здесь локализованы дендритические разветвления мотонейронов; их аксоны выходят из нейропиля в дорсальные корешки боковых нервов;
3) область основного нейропиля - ассоциативный нейропиль, включает интернейроны, образующие связи с двигательным и чувствительным нейропилем;
4) область вентральных корешков - чувствительный нейропиль из отростков сенсорных нейронов, локализованных вне ганглия;
5) область вентральных коннективных волокон, проходящих через ганглий или дающих концевые разветвления.
Таким образом, в сегментарных ганглиях насекомых, как и в спинном мозге позвоночных, обнаруживается поверхностное расположение проводящих путей, дифференциация нейропиля на моторную, чувствительную и ассоциативную области. Эти сходные признаки служат аргументами в пользу выдвинутого А.А. Заварзиным принципа параллелизма в эволюции тканевых структур упозвоночных и беспозвоночных.
Так же как и у других представителей животного царства, у насекомых элементарной единицей ЦНС выступает нейрон. В зависимости от функции различают сенсорные, моторные и ассоциативные нейроны. Сенсорные нейроны: биполярные и с разветвленными дендритами (нейроны второго типа, по А.А. Заварзину) лежат на периферии и связаны с рецепторами. Их аксоны входят в ганглий в составе вентральных корешков боковых нервов. Моторные нейроны - униполярные (40-50 мкм), они лежат под оболочкой ганглия с центральной и латеральной сторон. От тела мотонейрона отходит мозговой отросток, который в зоне конечного утолщения делится на дендриты и длинный аксон. Клеточное тело обычно лишено каких-либо синаптических контактов. Их область отнесена от клеточного тела в зону мозгового разветвления. Триггерная зона, в которой возникает потенциал действия, локализована в начальном сегменте аксона. При микроэлектродном отведении от аксона, можно зарегистрировать потенциал действия, амплитуда которого достигает 90-110 мВ. Механизм генерации потенциала действия у насекомых имеет натриевую природу и блокируется тетродотоксином - веществом, избирательно подавляющим функцию натриевых каналов мембраны. Ассоциативные нейроны несколько мельче мотонейронов, но по форме идентичны им. Интернейроны обеспечивают связи как внутри ганглиев, так и между соседними ганглиями. В качестве примера наиболее длинных и крупных (до 45 мкм диаметром) ассоциативных волокон можно привести систему гигантских аксонов. Морфология и функция этих аксонов подробно описаны в работах К. Редера. У черного таракана они представляют собой аксоны нервных клеток, расположенных в шестом брюшном ганглии, и, по-видимому, имеют синцитиальное происхождение. Дендриты этих клеток вступают в синаптический контакт с аксонами сенсорных нейронов механорецепторов церок (придатков брюшка). Гигантские аксоны проходят без перерыва через всю БНЦ вплоть до третьего грудного ганглия и там образуют синаптический контакт с мотонейронами ножных мышц. Раздражение механорецепторов церок вызывает экстренную реакцию бегства у таракана. По представлениям К. Редера, гигантские аксоны компенсируют расчлененность БНЦ и сводят до минимума время проведения возбуждения через трехнейронную рефлекторную дугу.
Основная масса синаптических контактов в сегментарных ганглиях насекомых сосредоточена в нейропиле. По механизму транссинаптической передачи они подразделяются на синапсы химические и электрические. Последние представлены аксо-аксональными контактами. Эти контакты очень тесные с малым диаметром синаптической щели (2-5 нм), без синаптических пузырьков в пресинаптическом окончании.
Вместе с тем, согласно данным электронной микроскопии, в нейропиле сегментарного ганглия обнаружены межаксонные контакты типа «терминальной пуговки». Эти синапсы обладают выраженной полярностью, и пресинаптическая терминаль содержит синаптические везикулы. Между пре- и постсинаптической мембранами имеется щель размером 20-30 нм. Такая структурная организация позволяет рассматривать контакты типа «терминальной пуговки» как синапсы с химической природой передачи. Иногда они бывают и более сложной формы, в случае конвергентных (два и более пресинаптических волокна контактируют с одним постсинаптическим), дивергентных и серийных (или последовательных) синапсов.
Спектр медиаторных веществ, претендующих на роль транссинаптических передатчиков в ЦНС насекомых, весьма обширен. Среди них можно указать такие агенты, как Ах, ГАМК, L- глютаминовая кислота, дофамин, норадреналин, октопамин, серотонин и некоторые полипептиды. Однако далеко не все из перечисленных веществ удовлетворяют критериям идентификации медиаторов.
Наиболее детально эти требования разработаны для холинергических синапсов. К наиболее существенным критериям относится определение содержания Ах в сегментарных и головных ганглиях. Так, например, в гомогенате брюшных ганглиев таракана содержится 50 мкг/г массы Ах, тогда как в гомогенате мозга 143 мкг/г массы. Из гомогенатов нервной ткани насекомых выделен фермент ацетилтрансфераза холина (холинацетилаза), которая катализирует синтез Ах в результате ацетилирования холина. При этом оказалось, что синтез Ах проходит те же этапы, что и у позвоночных животных.
Следующий критерий идентификации медиаторов - это определение активности и локализации гидролитического фермента, с помощью которого происходит расщепление передатчика в синаптической щели. Для холинергических синапсов таким гидролитическим ферментом служит ацетилхолинэстераза (Ахэ), ее локализацию в ганглии выявляют гистохимическими методами. При определении локализации Ахэ на срезах сегментарных ганглиев таракана установлено, что активность фермента наиболее высока в нейропиле. У насекомых Ахэ сочетает в себе свойства истинной и ложной холинэстеразы позвоночных животных и в гистохимической реакции гидролизует используемые в качестве субстратов ацетилтиохолиниодид и бутирилтиохолиниодид.
Антихолинэстеразные соединения (эзерин, армии) концентрацией
10-7-10-6 моль/л вызывают облегчение постсинаптических ответов в шестом брюшном ганглии таракана. Длительное действие этих препаратов блокирует синаптическую передачу, что объясняется накоплением в синапсах Ах, ферментативный гидролиз которого нарушен торможением Ахэ. Сходный механизм лежит в основе действия на насекомых фосфорорганических соединений, используемых в качестве инсектицидов.
Ионофоретическая аппликация Ах внутрь ганглия оказывает возбуждающий эффект на нейроны насекомых. При этом под влиянием Ах происходит деполяризация клеточных мембран с последующей генерацией потенциалов действия. Степень деполяризации пропорциональна количеству инъецированного Ах. Перечисленные выше факты свидетельствуют о том, что Ах является синаптическим передатчиком в сегментарных ганглиях насекомых и выполняет медиаторную функцию в синапсах между рецепторными, вставочными и моторными нейронами.
Наиболее вероятным тормозным медиатором в нервной системе насекомых признается ГАМК. В пользу этого предложения свидетельствует значительное содержание ГАМК (до 12,8 мкг×моль/г влажной массы) в нервной ткани насекомых, а также присутствие фермента глутаматдекарбоксилазы (ГДК), катализирующего синтез ГАМК из L-глютаминовой кислоты. Основной механизм инактивации выделяющейся в синапсах насекомых ГАМК связан с обратным захватом этой аминокислоты в пресинаптическое окончание и глиальные элементы. Ионофоретическая микроаппликация ГАМК (1,5×10-13 моль/л) на нервные клетки шестого брюшного ганглия таракана вызывает гиперполяризацию клеточной мембраны и торможение импульсной: активности. Гиперполяризация обусловлена главным образом повышением проницаемости постсинаптической мембраны для ионов хлора. Тормозной эффект ГАМК снимается веществом-антагонистом пикротоксином, который, по всей вероятности, конкурирует с ГАМК за активный центр рецептора постсинаптической мембраныи снижает ее проводимость. Таким образом, данные о содержании и метаболизме ГАМК в нервной системе насекомых, а также ее способность имитировать эффект естественного тормозного медиатора убеждают нас в том, что ГАМК выступает реальным кандидатом на роль синаптического передатчика.
В целом ряде экспериментальных работ указывается на катехоламинергические синапсы в ЦНС насекомых. Гистохимическими методами установлена локализация катехоламинов в головных ганглиях насекомых. Адреналин и норадреналин обнаружены в мозге у таракана Periplaneta americana. Они локализованы преимущественно в надглоточном ганглии, в области комплекса центрального тела, в a- и b - долях грибовидных тел, а также в антеннальной доле.
В мозге осы и пчелы обнаружен серотонин. При ионофорезе, а также при перфузии брюшного ганглия таракана раствором, содержащим адреналин, норадреналин или дофамин, наблюдаются деполяризация и возбуждение клеточных мембран ганглия. Однако существует мнение о том, что инъекция дофамина в мозг муравьев обратимо блокирует импульсную активность нервных клеток. Противоречивые данные говорят о том, что вопрос о функции катехоламинергических систем у насекомых нуждается в экспериментальной доработке. В целом набор медиаторных систем в ЦНС насекомых сходен со спектром транссинаптических передатчиков у беспозвоночных животных других классов и типов.
Проблема нейрохимической организации ЦНС насекомых связана с вопросом о координирующей функции элементарных нейронных цепей в сегментарных ганглиях. Эти цепи управляют такими ритмическими двигательными актами, как полет, пение, дыхание и ходьба. Судя по результатам нейрофизиологических исследований, неотъемлемую часть каждого моторного модуля составляют нейроны-ритмоводители, носители генетически предопределенной центральной программы. Эти нейроны отличает стабильность ритмической импульсной активности, рисунок которой сохраняется даже после полной деафферентации сегментарного ганглия. В качестве примера можно привести нейрон-ритмоводитель, обнаруженный в звуковом центре певчих цикад. Этот нейрон в условиях опыта запускается раздражением механорецепторов брюшка и задает рабочий ритм двум мотонейронам, которые иннервируют правую и левую звуковые (тимбальные) мышцы. Разряды нейрона-ритмоводителя следуют в виде пачек импульсов со строго фиксированной частотой потенциалов действия (200 имп/с) в каждой пачке. Жесткая настройка всего нейронного модуля обусловливает видоспецифичность звуковых коммуникационных сигналов. Вместе с тем следует отметить, что хотя центральная программа генетически детерминирована, возможны вариации реакции в зависимости от ряда условий. Так, например, генерация звуковых коммуникационных сигналов у цикад определяется соответствующим: гормональным фоном, наличием поющих партнеров, оптимальной температурой и достаточной солнечной радиацией. Только после анализа информации, поступающей от различных афферентных входов, в нервных центрах цикады формируется команда, активизирующая систему генерации звука.
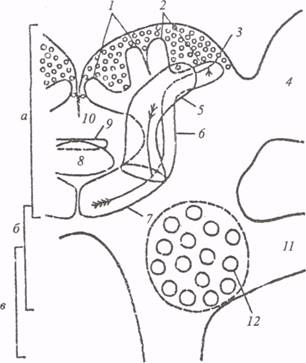
Рис. 10. Схема фронтального среза через надглоточный ганглий таракана (по: M.J.Weiss, 1974):
а – протоцеребрум, б – дейтоцеребрум, в – тритоцеребрум; 1 – медиальная и 2 – латеральная чашечки, 3 – глобулярная клетка, 4 – оптическая доля, 5 – a-доля, 6 – ножка, 7 – b-доля, 8 – центральное тело, 9 – протоцеребральный мост, 10 – pars intercerebralis, 11 – антеннальный нерв, 12 – антеннальная доля
Существенная роль в формировании нисходящих команд и в сенсомоторной интеграции принадлежит головным ганглиям насекомых. В надглоточном ганглии насекомых выделено три отдела: протоцеребрум,дейтоцеребрум и тритоцеребрум. Протоцеребрум (рис. 10) состоит главным образом из ассоциативных и чувствительных нейронов. Он включает в себя большие оптические доли. В области оптических долей имеются три синаптических переключения, через которые осуществляется приток сенсорной информации от омматидиев в нервные центры. В состав протоцеребрума входит ряд ассоциативных центров, образующих структурированный нейропиль. Среди них выделяются парные стебельчатые, или грибовидные, тела, комплекс центрального тела и протоцеребральный мост.
Каждое грибовидное тело (ГТ) состоит из одной или двух вогнутых чашечек, ножки и отходящих от нее двух долей - a и b.
Над чашечками и вдоль их края лежат многочисленные мелкие тела глобулярных клеток (клеток Кеньона). Каждая глобулярная клетка представляет собой униполярный нейрон, отросток которого ветвится, посылая коллатерали в чашечку и в дистальные части a и b - долей. Соответственно геометрии этих нейронов синаптические переключения сфокусированы в трех областях ГТ: в нейропиле чашечки и в дистальных частях обеих долей. Расположение отростков глобулярных клеток в равной мере определяет самую форму ГТ, отделенных от соседнего неструктурированного нейропиля глиальной оболочкой. В системе волокон, образующих ГТ, принято различать так называемые внутренние волокна - отростки глобулярных клеток, и внешние (проникающие в ГТ снаружи) отростки клеточных тел, расположенных в других зонах мозга. Внутренние волокна в пределах ножки и долей группируются в пучки и образуют между собой продольные синаптические контакты с толщиной синаптической щели 10-20 нм.
Специфическая структура ГТ позволяет априори говорить об их предполагаемой функции. Возможно, ГТ предназначены для обработки информации и принятия решения после сопоставления афферентации от различных сенсорных входов. В пользу этой точки зрения свидетельствуют разнообразные связи ГТ с сенсорными системами и многоканальная система внутренних волокон, где может происходить оценка поступающей информации и выработка соответствующих «команд», поступающих в конечный, общий премоторный путь.
Согласно мнению Ф. Хюбера, ГТ осуществляют контроль временной последовательности поведенческих актов. Предпосылкой этой гипотезы служит различная скорость проведения возбуждения по параллельным каналам системы ГТ. Скорость лимитируется диаметром внутренних волокон ГТ и топографией синаптических контактов между внутренними и внешними (выходными) волокнами. Эти факторы потенциально могут определить последовательность разрядов во внешних волокнах, распространяющихся от ГТ к моторным центрам в сегментарных ганглиях. Таким образом, ГТ могут контролировать временную последовательность поведения.
Наконец, согласно третьей гипотезе ГТ принимают участие в формировании краткосрочной памяти у насекомых. Одним из механизмов сохранения следов в нервной система может быть реверберация импульсов в замкнутых цепях нейронов. Морфологической основой такого механизма в ГТ может быть тракт, связывающий выход (a-долю) с входом (чашечкой). Он образует своеобразную петлю обратной связи, которая, по мнению некоторых авторов, может определять возникновение длительных разрядов в нейронах ГТ.
По всей вероятности, все три гипотезы имеют право на существование, так как подкрепляются соответствующими физиологическими данными. Так, например, у пчел временно нарушается условно-рефлекторная деятельность при локальном охлаждении a-долей и чашечки ГТ с помощью металлических микрозондов. Очевидно, этот факт обусловлен температурным блокированием электрической активности нейронов, образующих реверберационные контуры.
Другой ассоциативный центр протоцеребрума - комплекс центрального тела (КЦТ) изучен менее детально. Это упорядоченная, ориентированная в дорсовентральном направлении система с тремя перекрестами и контрлатеральным выходом волокон. На основании структуры КЦТ можно допустить, что он служит для связей между двумя сторонами мозга. Об участии КЦТ в интегративном процессе свидетельствуют его многочисленные связи с различными отделами мозга. Коагуляция КЦТ подавляет локомоцию, а электрическое раздражение этой структуры вызывает увеличение частоты импульсной активности сегментарных мотонейронов. Таким образом, КЦТ может выступать в роли модулятора возбудимости сегментарных моторных центров.
Описание структуры протоцеребрума было бы неполным, если не упомянуть расположенную между чашечками ГТ область, называемую pars intercerebralis. Здесь находятся две группы нейросекреторных клеток. Гормоны, вырабатываемые этими клетками, управляют метаболическими реакциями, регулируют протекание линек метаморфоза и диапаузы у насекомых.
Второй отдел надглоточного ганглия насекомых - дейтоцеребрум, или обонятельный мозг, содержит состоящие из сферически гломерул обонятельные доли. К обонятельным долям подходят аксоны антеннального нерва, идущие от хеморецепторов на члениках антенн. От обонятельных долей начинается ольфакто-глобулярный тракт, идущий к ГТ.
Третий отдел надглоточного ганглия — тритоцеребрум представлен двумя симметричными долями, переходящими в окологлоточные коннективы. Нервы, идущие от тритоцеребрума, иннервируют верхнюю губу и мышцы рта. В тритоцеребруме локализованы высшие вегетативные центры насекомых. Расположенные там нейроны контролируют работу вегетативной нервной системы.
Подглоточный ганглий (ПГ) имеет сложное происхождение и образуется в результате полного слияния трех ганглиев. Нервы (8 пар), отходящие от ПГ, иннервируют сенсорные органы и мышцы рта, слюнные железы, шейные рецепторы и мышцы. Через ПГ проходят восходящие и нисходящие волокна, осуществляющие его связи с надглоточным и грудными ганглиями. В ПГ содержатся нейросекреторные клетки, продукты которых воздействуют на развитие половых желез у насекомых. Такова в общих чертах анатомическая организация головных ганглиев. Даже на основе этой краткой характеристики морфофункциональной организации головных ганглиев можно заключить, что мозг насекомых по сравнению с сегментарными ганглиями представляет собой второй, более высокий уровень сенсомоторной интеграции, определяющей биологическую направленность поведения.
Насекомые наряду с жесткими видоспецифичными формами поведения отличаются поразительной склонностью к обучению. Одна из наиболее примитивных несигнальных форм индивидуально приобретенных реакций - привыкание заключается в прекращении реакции на постоянно действующий биологически индифферентный раздражитель. Другая форма обучения базируется на суммации следов возбуждения в нервных центрах, вследствие чего возрастает реактивность животного (сенсибилизация) на разнообразные раздражители. У насекомых сенсибилизация наиболее четко проявляется при «наказании» электрическим током. После электрического раздражения конечностей тараканы спасаются бегством при 1гйствии самых разных, ранее индифферентных раздражителей.
Кроме несигнальных форм приобретенных реакций у насекомых могут вырабатываться «истинные» условные рефлексы, устойчивость которых определяется уровнем биологической адекватности условных раздражителей.
В результате исследований сотрудников лаборатории генетики поведения Института физиологии им. И.П. Павлова установлено, что скорость формирования пищевых и оборонительных условных рефлексов у пчел зависит от силы условных и безусловных раздражителей, от сложности задачи (при использовании комплексных раздражителей). У пчел обнаружены все виды внутреннего (условного) торможения, с помощью которого становятся возможными тонкий анализ биологической важности сигналов и смена несоответствующего условиям набора приобретенных реакций.
Способность перестраивать сложившуюся систему временных связей обусловливает высокую пластичность поведения насекомых. Она проявляется, например, в ускорении формирования приобретенных реакций вследствие тренировки. В современной литературе это явление трактуется как формирование установки обучения. Наиболее простой вариант такого тренинга сводится к многократной переделке пищевого условного рефлекса у пчел.
Не менее интересные факты, свидетельствующие о формировании установки обучения, получены в тех опытах, где условные рефлексы образуются на обобщенные признаки раздражителей. У пчел такая удивительная способность к визуальному обобщению была обнаружена Г.А. Мазохиным-Поршняковым. Оказалось, что при обучении пчелы способны узнавать геометрические фигуры (квадрат, треугольник) независимо от изменения их цвета, способа изображения и взаимного положения. Способность пчел к визуальному обобщению и элементарному абстрагированию позволяет говорить о конвергентном сходстве сложных форм поведения у насекомых и позвоночных животных.
Краткий обзор основных типов нервной системы беспозвоночных животных позволяет сформулировать некоторые итоговые положения. Сравнительно- анатомические и нейроонтогенетические исследования свидетельствуют о множественном (полигенетическом) происхождении нервной ткани у беспозвоночных животных. Морфофункциональная эволюция нервной системы беспозвоночных осуществлялась в результате концентрации нервных элементов, погружения нервной системы в глубь тела, дифференциации внутренней структуры ганглиев, уменьшения числа полифункциональных элементов и специализации. Сходство в наборе медиаторных систем и в молекулярных механизмах электрогенеза свидетельствует о большем консерватизме в эволюционных преобразованиях на молекулярном уровне по сравнению с клеточным и органным. В организации поведения высших беспозвоночных существует своеобразная иерархия командных систем управления, с двумя уровнями интеграции в сегментарных и головных ганглиях. Взаимодействие этих уровней интеграции лежит в основе высокой пластичности поведения, включающего как врожденные, так и приобретенные реакции.
ЛИТЕРАТУРА
Беклемишев В. Н. Основы сравнительной анатомии беспозвоночных. М., 1964. 446 с.
Верещагине. М., Лапицкий В.П. Сравнительная физиология нервной системы беспозвоночных. Л., 1982. 96 с.
Давид О.Ф. Морфофизиологические основы локомоции аннелид. Л., 1990. 168 с.
Заварзин А.А. Очерки по эволюционной гистологии нервной системы. М., 1941. 379 с.
Кэпдел Э. Клеточные основы поведения. Пер. с англ. М., 1980. 586 с.
Лагутенко Ю.П. Структурная организация туловищного мозга аннелид. Л., 1981. 127 с.
Лапицкий Б.П. Головные ганглии и двигательная активность насекомых. Л., 1990. 196 с.
Лопатина Н.Г. Сигнальная деятельность в семье медоносной пчелы. Л., 1971. 154 с.
Мандельштам Ю.Е. Нейрон и мышца насекомого. Л., 1983. 168 с.
Сахаров Д.А. Генеалогия нейронов. М., 1974. 183 с.
Свидерский Б.Л. Основы нейрофизиологии насекомых. Л., 1980. 280 с.
Тушмалова Н.А. Функциональные механизмы приобретенного поведения у низших беспозвоночных. М., 1986. 109 с.
Тыщенко Б.П. Физиология насекомых. M. 1986. 303 с.
Фриш К. Из жизни пчел. Пер. с нем. М., 1980. 214 с.








