Закон Рауля не выполняется для реальных растворов. Парциальные давления (или летучести) этих растворов больше или меньше давлений (или летучестей) паров идеальных растворов. Отклонения от закона Рауля в первом случае называются положительными (общее давление пара больше аддитивной величины), а во втором случае – отрицательными (общее давление пара меньше аддитивной величины).
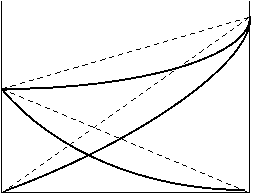
Если отклонения от закона идеальных растворов велики, то кривая общего давления пара проходит через максимум или минимум. Чем ближе между собой давления насыщенного пара чистых жидкостей, тем меньшие отклонения от закона Рауля вызывают появление экстремума на кривой общего давления.
Положительные и отрицательные отклонения реальных растворов от закона Рауля обусловлены разными факторами. Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, то это облегчает переход молекул из жидкой фазы в газовую (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения от закона Рауля. Усиление взаимного притяжения разнородных молекул в растворе (сольватация, образование водородной связи, образование химического соединения) затрудняет переход молекулы в газовую фазу и поэтому будут наблюдаться отрицательные отклонения от закона Рауля.
Процессы взаимного удаления однородных молекул при образовании раствора сопровождаются поглощением теплоты, поэтому в первом случае теплота смешения чистых компонентов будет положительной. Во втором случае, при более сильных взаимодействиях разнородных молекул, теплота смешения компонентов будет отрицательной. Таким образом, знак отклонения от закона Рауля и знак теплоты смешения совпадают.
Положительные отклонения
 рр
А В рр
А В
| Отрицательные отклонения
рр
А В
|
| Диаграммы давление пара – состав жидкости для двух жидкостей, смешивающихся во всех соотношениях, в случае положительных и отрицательных отклонений от закона Рауля
|
Факторы, вызывающие положительные и отрицательные отклонения, могут действовать в растворе одновременно, поэтому наблюдаемые отклонения часто являются результатом наложения противоположных по знаку отклонений. Одновременное действие противоположных факторов особенно наглядно проявляется в растворах, в которых знак отклонений от закона Рауля – Генри изменяется с изменением концентрации. Из сказанного вытекает, что отсутствие отклонения от закона Рауля или равенство нулю теплоты смешения при образовании раствора одного какого-либо состава не являются признаками того, что данные компоненты образуют идеальные растворы.
Химическое равновесие, общее условие химического равновесия. Закон действующих масс, константа равновесия. Уравнение изотермы химической реакции. Стандартные изобарные потенциалы реакций, их применение. Тепловой закон Нернста, расчет химических равновесий.
Направление химической реакции в ряде случаев зависит от давления газа и от концентрации раствора и при известных значениях этих величин реакция может прекратиться, не дойдя до конца. Т.о., химические реакции обратимы: наряду с химическим взаимодействием между исходными веществами (прямая реакция) протекает химическое взаимодействие между продуктами реакции (обратная реакция), в результате которого снова образуются исходные вещества. По мере протекания процесса скорость прямой реакции (количество молекул, прореагировавших за секунду) уменьшается, а скорость обратной реакции увеличивается. Когда обе скорости сравняются, наступает состояние химического равновесия - число молекул веществ, составляющих химическую систему, перестает меняться и остается постоянным во времени при неизменных внешних условиях. Химическое равновесие является динамичным и подвижным - с изменением внешних условий равновесие сдвигается в одну или в др. сторону; б/м изменение внешних условий влечет за собой б/м изменение состояния равновесия. Т.о., химические реакции могут протекать как термодинамически равновесные процессы, т.е. к ним можно применять общие условия термодинамического равновесия.
Изменение изобарного потенциала G системы, в которой протекает химическая реакция, определяется уравнением:
dG = - SdT + VdP + m1dn1 + m2dn2 +...
Однако в этом случае изменения масс компонентов dn1, dn2... не являются независимыми, а связаны стехиометрическими соотношениями:
n1А1 + n2А2 +... = n1¢А1¢ + n2¢А2¢ +...
Изменения масс компонентов, выраженные в молях, пропорциональны стехиометрическим коэффициентам уравнения реакции, взятым с соответствующим знаком («-» для исчезающих веществ, «+» - для образующихся):
 =
=  =... =
=... = 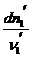 =
=  =... = dc
=... = dc
изменения масс изменения масс
исходных веществ продуктов реакции
Отношение dni /n i одинаково для всех участников химической реакции и может быть записано в форме дифференциала некоторой величины c. c - химическая переменная: показывает массу каждого компонента, вступившую к данному моменту в реакцию и измеренную в эквивалентных единицах, отвечающих уравнению реакции. Химическая переменная характеризует только одну определенную химическую реакцию. Если в системе протекает несколько реакций, то для каждой из них имеется своя химическая переменная (c1, c2...).
dG = VdP - SdT - n1m1dc - n2m2dc -... + n1¢m1¢dc + n2¢m2¢dc +... =
= VdP - SdT + å(n i m i)dc
Здесь G = G (P, T, c),  = ån i m i
= ån i m i
При P,T = const: (¶G)P,T = å(n i m i)dc
Для реакций, протекающих самопроизвольно при P,T = const, dG < 0 Þ å(n i m i) < 0, т.к. dc > 0 (по определению).
Когда реакция находится в состоянии равновесия, функция G = f (c) имеет минимальное значение:
 = ån i m i = 0 - это условие химического равновесия (в общей форме)
= ån i m i = 0 - это условие химического равновесия (в общей форме)
Аналогично можно вывести:
 = ån i m i = 0 в состоянии равновесия.
= ån i m i = 0 в состоянии равновесия.
Закон действия масс (ЗДМ)
Связь между равновесными концентрациями (или парциальными давлениями) веществ, участвующих в химической реакции, выражается законом действия масс, количественная формулировка и кинетический вывод которого были даны Гульдбергом и Вааге (1867).
n1А1 + n2А2 Û n1¢А1¢ + n2¢А2¢
v 1 = k 1  - скорость прямой реакции
- скорость прямой реакции
v 2 = k 2  - скорость обратной реакции
- скорость обратной реакции
v 1 = v 2 в состоянии равновесия
k 1  = k 2
= k 2 
КС = k 1 / k 2 =  /
/ 
(КС - константа равновесия, выраженная через концентрации)
ЗДМ можно вывести из уравнения ån i m i = 0, если химические потенциалы выразить как функции концентраций, парциальных давлений и т.д. компонентов, участвующих в реакции:
m i = Gi (T) + RT ln C i 
m i = Gi ¢(T) + RT ln P i - если компоненты - идеальные газы
m i = Gi ¢¢(T,P) + RT ln N i
m i = m i (T) + RT ln fi - если компоненты - реальные газы
m i = m i o (T) + RT ln N i - если компоненты - идеальные растворы
m i = m i o (T) + RT ln ai - если компоненты - реальные растворы
Выведем ЗДМ для газовой реакции, если компоненты - идеальные газы. Исходное уравнение m i = Gi ¢(T) + RT ln P i подставим в уравнение ån i m i = 0.
ån i Gi ¢(T) + RT ån i ln р i , равн = 0
ån i ln р i , равн = -  = f (T)
= f (T)
Опустим индекс (равн); заменим сумму логарифмов логарифмом произведения р i; а f (T) - логарифмом некоторой функции КР (Т):
ln  = -
= -  = ln KP (T)
= ln KP (T)
 =
= 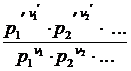 = KP (T)
= KP (T)
Величина КР, выраженная через равновесные парциальные давления в идеальной газовой смеси, есть функция только Т и не зависит от суммарного Р и парциальных давлений компонентов в исходной смеси. При T = const KP = const.
КР - константа химического равновесия, а уравнение называется законом действия масс.
Если газ - реальный, то таким же путем получим:
K f =  ; K f ® KP при Р ® 0
; K f ® KP при Р ® 0
Необходимо различать константы равновесия, выраженные разными способами, т.к. их числовые значения неодинаковы. К выражают: через р i, с i, N i.
KP =  ; KC =
; KC =  ; KN =
; KN = 
Связь между ними можно установить, используя уравнения для идеальной газовой смеси: P i = C i RT Þ KP = KC (RT)Dn
P i = N i P Þ KP = KN PDn
Dn = n1¢ + n2¢ + n3¢ +... - n1 - n2 - n3 -...
Т.к. КР не зависит от Р (для идеальных газов), то и КС от него не зависит. KN же зависит от Р и не зависит от исходных количеств компонентов.
Если Dn = 0, т.е. реакция протекает без изменения числа молекул, то КР = КС = КN.



 рр
А В
рр
А В
 =
=  =... =
=... = 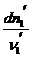 =
=  =... = dc
=... = dc = ån i m i
= ån i m i = ån i m i = 0 в состоянии равновесия.
= ån i m i = 0 в состоянии равновесия. - скорость прямой реакции
- скорость прямой реакции - скорость обратной реакции
- скорость обратной реакции
 = f (T)
= f (T) = -
= - 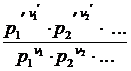 = KP (T)
= KP (T) ; K f ® KP при Р ® 0
; K f ® KP при Р ® 0 ; KC =
; KC =  ; KN =
; KN = 



