Раствор образуется из компонентов самопроизвольно. Поэтому его образование при р,Т = const связано с уменьшением изобарного потенциала G системы.
G
· GB,ж
G¢
· GB,тв
GA,ж · ·
· GN
G
N
А В
Зависимость изобарного потенциала раствора от его состава
|
На рис. кривая GAGGB показывает зависимость изобарного потенциала 1 моля раствора от состава раствора для двух жидких компонентов А и В, смешивающихся во всех отношениях. Любая т.G на этой кривой лежит ниже т.G¢, отвечающей изобарному потенциалу системы, состоящей из компонентов А и В, взятых в тех же количествах, что и в растворе, но не смешанных друг с другом.
|
Если компонент В находится в твердом состоянии, то он будет растворяться в жидкости А до тех пор, пока не образуется насыщенный раствор, в котором мольная доля компонента В равна N. Кривая GAGGN показывает изменение G раствора с изменением его состава; т.GN отвечает насыщенному раствору. При добавлении твердого компонента В к насыщенному раствору дальнейшего его растворения не происходит, и система состоит из двух фаз - насыщенного раствора и кристаллов компонента В. Зависимость G этой системы от состава изображается прямой GNGB,тв, где GB,тв - G чистого твердого компонента В.
Таким образом, величина G раствора является функцией не только р и Т, но и функцией массы каждого компонента раствора; это относится ко всем термодинамическим потенциалам и другим экстенсивным свойствам системы (то есть свойствам, пропорциональным массе).
Выражение первого закона термодинамики следует расширить:
dU = dQ - dA + m1d n 1 + m2d n 2 + …,
ni - число молей компонентов раствора,
m i – коэффициенты пропорциональности между dU и d ni.
Для равновесного процесса при наличии только работы расширения:
dU = TdS – р dV + Sm i d ni,
dH = TdS + Vd р + Sm i d ni,
dF = – р dV – SdT + Sm i d ni,
dG = Vd р – SdT + Sm i d ni.
Эти выражения есть полные дифференциалы функций F = F(V, T, ni), G = G(р, T, ni) и т.д. Þ
m i =  =
=  =
=  =
= 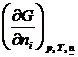
(индекс  показывает постоянство масс остальных компонентов).
показывает постоянство масс остальных компонентов).
m i – химические потенциалы – частные производные термодинамических потенциалов по массе i- го компонента при постоянстве соответствующих независимых переменных. Химический потенциал равен приросту F (G) при внесении в систему 1 моля данного компонента, если мы рассматриваем такую систему как бесконечно большое количество раствора определенного состава; при этом V, T (р, T) = const (бесконечно большое количество раствора берется потому, что только в этом случае добавление в раствор 1 моля компонента не изменит состав раствора, то есть концентраций компонентов). Химический потенциал компонента раствора данного состава имеет определенное числовое значение; абсолютное его значение определить не умеем.
Уравнения Гиббса – Дюгема
dG = Vd р – SdT + Sm i d ni.
При р, T = const dG = Sm i d ni.
Функция G = G(n 1 , n 2 , …) обладает следующим свойством: если массы всех компонентов системы возрастают в одно и то же число раз, то и G возрастает в то же число раз (величина G = U – TS + р V возрастает пропорционально массе, так как U, S, V возрастают пропорционально массе).
Таким образом, интегрируя вышеприведенное уравнение при постоянных соотношениях между массами (постоянный состав раствора), получим:
G = Sm i ni.
При указанных условиях величины m i остаются постоянными в процессе нарастания массы, то есть (при р, Т = const) они зависят только от состава раствора и являются факторами интенсивности. Þ Можно определить химический потенциал как изобарный потенциал системы, приходящийся на 1 моль компонента.
dG = n 1 dm1 + n 2 dm2 + … + ni dm i + m1 d n 1 + m2 d n 2 + … + m i d ni =
= S ni dm i + Sm i d ni.
При р, Т = const S ni dm i = 0. (1)
Для бинарного раствора: n 1 dm1 + n 2 dm2 = 0,
dm2 = –  dm1 = –
dm1 = – 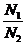 dm1. (2)
dm1. (2)
(N1, N2 – мольные доли компонентов).
Уравнения (1) – (2) – уравнения Гиббса – Дюгема.




 =
=  =
=  =
= 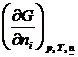
 показывает постоянство масс остальных компонентов).
показывает постоянство масс остальных компонентов). dm1 = –
dm1 = – 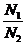 dm1. (2)
dm1. (2)
