Рецептуры ВВ составляют с таким расчетом, чтобы при реакции взрыва образовались в основном пары воды, азот и углекислый газ, т. е. газообразные продукты, наименее опасные для человеческого организма.
Степень опасности ВВ с точки зрения образования при взрыве ядовитых газов определяется кислородным балансом.
КИСЛОРОДНЫЙ БАЛАНС характеризуется отношением избытка или недостатка кислорода в составе ВВ к количеству его, необходимому для полного окисления горючих элементов ВВ. Кислородный баланс наиболее просто определяется выраженным в процентах отношением грамм-атомного веса избытка или недостатка кислорода к грамм-молекулярному весу ВВ.
Кислородный баланс считается нулевым, если в составе ВВ содержится количество кислорода, необходимое для полного окисления горючих компонентов. Если в составе ВВ кислорода не хватает для полного окисления горючих элементов, то такое ВВ имеет отрицательный кислородный баланс, а при избытке кислорода — положительный.
При взрыве ВВ с нулевым кислородным балансом образуется минимальное количество ядовитых газов и выделяется максимальное количество энергии.
При взрыве ВВ с отрицательным кислородным балансом при недостатке кислорода образуется ядовитая окись углерода, при этом выделяется тепла 27,7 ккал/(г-моль), при образовании двуокиси углерода (углекислого газа) тепла выделяются 94,5 ккал/(г-моль). При взрыве ВВ с положительным кислородным балансом избыточный кислород образует весьма ядовитые окислы с азотом. Реакция образования окислов азота эндотермична.
Для расчета состава продуктов взрыва все ВВ делят на три группы:
· ВВ с количеством кислорода, достаточным (или избыточным) для полного окисления горючих элементов. В этом случае весь углерод превращается в углекислый газ, а водород — в воду (например, при реакции разложения динитрогликоля.
· ВВ с количеством кислорода, достаточным для полного газообразования. При этом принимается, что кислород сначала окисляет весь водород в воду, углерод — в окись углерода, а затем оставшаяся часть кислорода образует с окисью углерода углекислый газ, например при реакции разложения тэна.
· ВВ с количеством кислорода, недостаточным для полного газообразования. В этом случае водород окисляется в воду, часть углерода — в окись углерода, а оставшийся углерод выделяется в свободном виде, как, например, при реакции разложения тротила.
Это правило составления реакций дает ориентировочный состав газообразных продуктов взрыва и не позволяет определить вторичные продукты реакции, которые часто, особенно у ВВ с отрицательным кислородным балансом, резко меняют состав газов взрыва.
Реакции взрывчатого превращения. Состав и объем продуктов взрыва.
Энергия взрыва ВВ высвобождается в результате химических реакций, основным типом которых является реакция окисления. Для протекания этой реакции необходимы окислитель и горючее. В смесевых ВВ окислителем является химическое соединение, которое при нагревании способно разлагаться с выделением окисляющих агентов (кислорода, окислов азота и т. п.). Наиболее распространенным в настоящее время окислителем является нитрат аммония (NH4NO3), широко известный под названием аммиачная селитра. В качестве горючего можно использовать уголь, древесную муку или органические соединения, содержащие, как правило, много углерода и водорода.
Индивидуальные ВВ, например, тротил, содержат в составе своих молекул и окисляющие группы (нитрогруппы), и горючее (углерод и водород). Под воздействием высокой температуры (например, при действии ударной волны) молекулы тротила распадаются и окислительные группы вступают в быструю реакцию с горючим. Как указывалось ранее, эта реакция протекает с выделением большого количества тепла и образованием газов.
Весьма важной характеристикой ВВ является кислородный баланс, представляющий отношение избытка или недостатка кислорода в составе ВВ к количеству его, необходимому для полного окисления горючих компонентов, выраженное в процентах. Кислородный баланс взрывчатой смеси легко рассчитать, если известен кислородный баланс каждого компонента смеси. Значения кислородного баланса обычных компонентов взрывчатых смесей приведены в таблице.
| Вещество
| Формула
| Атомная или молекулярная масса
| Кислородный баланс, %
|
| Алюминий
| Аl
|
| -89,0
|
| Аммиачная селитра
| NH4NO3
|
| +20,0
|
| Бумага (оболочка патронов)
|
|
| -116,1
|
| Гексоген
| C3H6N6O6
|
| -137,0
|
| Древесная мука
| С15Н22О10
|
| -125,0
|
| Динитронафталин
| C10H6(NO2)2
|
| -139,4
|
| Нитрат аммония
| NH4NO3
|
| +20,0
|
| Нитрат калия
| KNO3
|
| +39,6
|
| Нитрат натрия
| NaNO3
|
| +47,0
|
| Нитроглицерин
| C3H5(ONO2)3
|
| +3,5
|
| Парафин
| С24Н50
|
| -346,0
|
| Перхлорат натрия
| NaC104
| 122,5
| +52,2
|
| Тротил
| C6H2(NO2)3CH3
|
| -74,0
|
| Тэн
| C(CH2ONO2)4
|
| -10,1
|
| Хлористый аммоний
| NH4C1
| 53,5
| -44,9
|
| Целлюлоза (клетчатка)
| С0Н10О5
| 162,0
| -118,5
|
Табл.30
Элементарный состав ВВ представлен, как правило, углеродом, водородом, кислородом и азотом. Соответственно, продукты взрыва могут состоять из следующих газов: СО2, СО; Н2О; Н2; О2; СН4; NH3; NO; NO2. Кроме того, в продуктах взрыва могут находиться и твердые вещества, углерод, окислы металлов, их соли и т. п.
При определении состава продуктов взрыва расчетным путем ВВ делят на три группы. К первой группе относятся ВВ с нулевым кислородным балансом, ко второй — ВВ с положительным кислородным балансом, выделяющие при взрыве только газообразные продукты, и к третьей — ВВ с отрицательным кислородным балансом, в продуктах взрыва которых содержится углерод (сажа).
Вычисляют кислородный баланс как разность между количеством кислорода, содержащимся во ВВ, и количеством кислорода, необходимым для полного окисления горючих элементов входящих в его состав. Расчет ведут на 100 г ВВ и поэтому кислородный баланс выражают в процентах. В том случае, если во ВВ имеется избыточный кислород, кислородный баланс считается положительным. Если кислорода недостаточно для полного окисления горючих элементов, содержащихся во ВВ, то кислородный баланс вещества считается отрицательным. Если же ВВ содержит как раз столько кислорода, сколько нужно для полного окисления горючих, то кислородный баланс его равен нулю, при этом выделяется максимальное количество энергии и минимальный объем ядовитых газов.
В качестве примера рассчитаем кислородный баланс аммиачной селитры — основного компонента современных промышленных ВВ. Напишем уравнение взрывчатого превращения аммиачной селитры:

В граммолекуле аммиачной селитры (80 г) содержится 48 г кислорода. На окисление горючих элементов, входящих в состав молекулы аммиачной селитры (водород), потребуется 32 г кислорода. Следовательно, аммиачная селитра имеет положительный кислородный баланс, равный
КБ = (48-32)/80*100 = +20%.
ВВ первой группы. Составление реакций взрывчатого превращения для ВВ первой группы является довольно простой задачей. Из всех возможных в этом случае направлений химической реакции наиболее вероятным являются те, при которых выделяется максимальное количество тепла. Именно поэтому углерод окисляется до двуокиси углерода (а не до окиси), водород сгорает, образуя воду; алюминий превращается в окись алюминия, а азот выделяется в элементарном виде, так как реакции окисления азота идут с поглощением тепла. Таким образом, если ВВ имеет нулевой кислородный баланс, то в продуктах взрыва его не должно быть ни окиси углерода, ни свободного кислорода. Когда же ВВ имеет положительный кислородный баланс, продукты взрыва содержат свободный кислород. В качестве примера составим уравнение взрывчатого превращения типичного промышленного ВВ — аммонита № 6 ЖВ, состоящего из 79% аммиачной селитры и 21% тротила. Расчет будем вести на 1 кг ВВ. Коэффициенты в левой части уравнения получим делением весового содержания данного компонента в 1 кг ВВ на его молекулярный вес. Тогда левая часть уравнения (исходное ВВ) будет иметь вид:
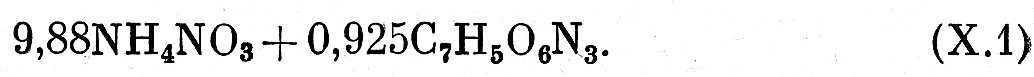
Аммонит № 6 ЖВ имеет кислородный баланс, близкий к нулю, поэтому, в соответствии с вышеизложенным, в состав продуктов взрыва его будут входить вода, двуокись углерода и азот. Записав таким образом состав продуктов взрыва и, уравняв содержание элементов в правой и левой частях, получим уравнение взрывчатого превращения аммонита № 6 ЖВ.
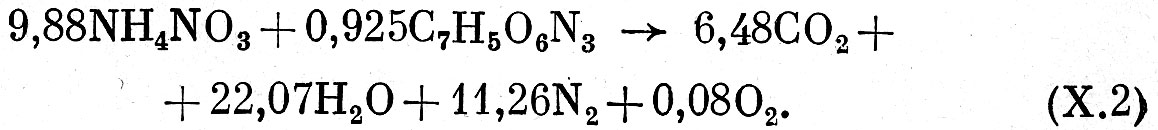
Однако в продуктах взрыва ВВ, особенно смесевых, могут содержаться и продукты неполного окисления (окись углерода и др.) и поэтому экспериментально определенный состав газов будет несколько отличаться от расчетного.
ВВ второй группы. Уравнение взрывчатого превращения для ВВ, полностью превращающихся в газы, может быть написано следующим образом:
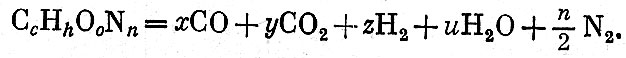
Соотношение между количеством окиси углерода х, двуокиси углерода у, водорода z и воды и определяется равновесием реакции водяного газа

Поскольку эта реакция проходит без изменения объема реагирующих газов, это равновесие не зависит от давления или от плотности ВВ. Кроме того, вследствие малого теплового эффекта реакции константа равновесия относительно медленно растет с повышением температуры.
Константы равновесия реакции водяного газа Кр в зависимости от температуры имеют следующие значения:
| Температура, К
| lg Kp
| Температура, К
| lg Kp
|
|
| -4,950
|
| +0,725
|
|
| -3,170
|
| +0,767
|
|
| -1,440
|
| +0,800
|
|
| -0,610
|
| +0,831
|
|
| -0,139
|
| +0,853
|
|
| +0,154
|
| +0,871
|
|
| +0,352
|
| +0,894
|
|
| +0,490
|
| +0,920
|
|
| +0,591
|
| +0,928
|
|
| +0,668
|
| +0,937
|
Приравнивая числа атомов отдельных элементов в правой и левой частях уравнения, получаем систему трех уравнений с четырьмя неизвестными:
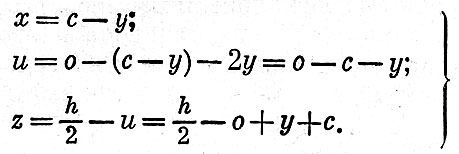
В качестве четвертого уравнения возьмем выражение для константы равновесия реакции водяного газа.
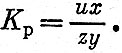
Задавшись температурой взрыва (о способе приближенной оценки температуры взрыва будет сказано ниже), находим значение константы равновесия Кр. Таким образом, для определения четырех неизвестных величин х, у, z и и имеем систему из четырех уравнений, которые могут быть приведены к квадратному уравнению относительно у. Вычислив у, легко определяем значения х, и, z.
Зная конечный состав продуктов реакции, можно рассчитать теплоту взрывчатого превращения и температуру. Если при этом мы получим ту температуру, которой задались при расчете, то расчет уравнения выполнен правильно. В противном случае расчет следует повторить, задавшись другой температурой.
В качестве примера произведем расчет уравнения взрывчатого превращения гексогена. В соответствии с вышеизложенным напишем уравнение взрывчатого превращения
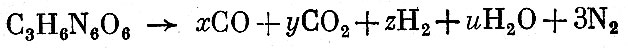
и систему трех уравнений

Предположим, что температура взрыва гексогена равна 3500 К. В этом случае имеем
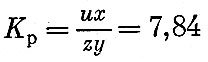
или, решая это уравнение относительно у, получим
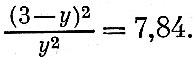
Решив это квадратное уравнение, получим:
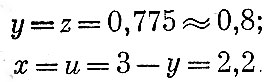
Таким образом, уравнение взрывчатого превращения гексогена будет иметь вид:

ВВ третьей группы. К ним относятся ВВ с отрицательным кислородным балансом (например, тротил), в продуктах взрыва которых находится твердый углерод.
Приближенно реакцию взрывчатого превращения взрывчатых веществ этой группы можно составить при допущении, что кислород, имеющийся в составе ВВ, окисляет сначала весь водород до воды, а затем оставшаяся часть кислорода реагирует с углеродом, образуя окись углерода. Избыток углерода выделяется в элементарном виде.
Для уточнения реакции взрывчатого превращения ВВ этой группы следует принимать во внимание равновесную реакцию, называемую реакцией доменного газа
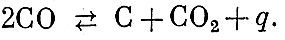
Предположим, что в продуктах взрыва свободного углерода будет содержаться а грамм-атомов. Тогда часть ВВ, превращающихся в газы, можно написать в виде формулы
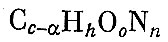
Для этой формулы производим расчет по равновесию реакции водяного газа (как для ВВ второй группы). По результатам расчета вычисляем процентное содержание СО и СО2 в составе продуктов взрыва. Подставляем эти величины в выражение для константы равновесия доменного газа

где рΣ — общее давление [%СО] и [%СО2] — объемный процент газа в составе смеси.
Температуру взрыва получаем при расчете реакции по равновесию водяного газа, а задавшись давлением взрыва рΣ, по данным, приведенным на стр. 133, можно определить константу равновесия  . Подставляя эти значения в выражение (Х.З), вычисляем правую и левую части выражения. Если левая часть уравнения будет больше правой, то задаемся большим значением а и повторяем расчет. Последовательные приближения продолжаем до тех пор пока левая часть, не станет равна правой.
. Подставляя эти значения в выражение (Х.З), вычисляем правую и левую части выражения. Если левая часть уравнения будет больше правой, то задаемся большим значением а и повторяем расчет. Последовательные приближения продолжаем до тех пор пока левая часть, не станет равна правой.
Таким образом, пользуясь этой методикой, можно определить уравнение взрывчатого превращения любого ВВ. По закону Авогадро, рассчитаем объем продуктов взрыва Vo, образующихся при взрыве 1 кг аммонита № 6ЖВ. Воду при этом рассматривают как газ; твердые продукты не учитывают, так как их объем мал по сравнению с объемом продуктов взрыва. Для расчета воспользуемся уравнением (Х.1) взрывчатого превращения аммонита №6ЖВ. В этом случае удельный объем продуктов взрыва составит
Vо = 22,4*n = 22,4(6,48 +22,07+11,26 +0,08)≈894 л/кг,
где 22,4 — объем моля газов (по закону Авогадро), л;
п — число молей газообразных продуктов, образующихся при взрыве 1кг ВВ.




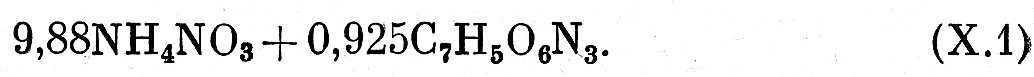
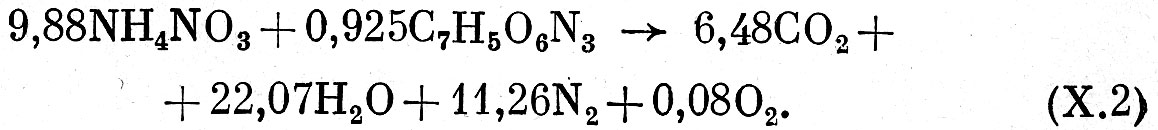
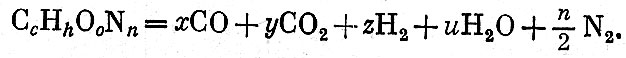

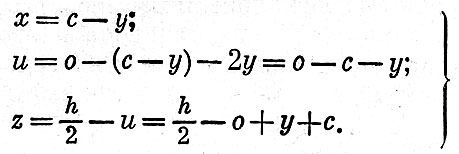
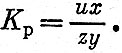
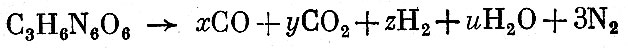

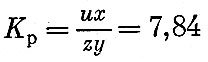
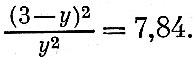
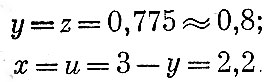

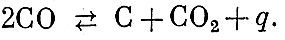
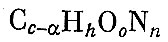

 . Подставляя эти значения в выражение (Х.З), вычисляем правую и левую части выражения. Если левая часть уравнения будет больше правой, то задаемся большим значением а и повторяем расчет. Последовательные приближения продолжаем до тех пор пока левая часть, не станет равна правой.
. Подставляя эти значения в выражение (Х.З), вычисляем правую и левую части выражения. Если левая часть уравнения будет больше правой, то задаемся большим значением а и повторяем расчет. Последовательные приближения продолжаем до тех пор пока левая часть, не станет равна правой.


