

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Водородный показателем, или рН, называется взятый с обратным знаком десятичной логарифм концентрации (или активности) ионов водорода в растворе:
рН = – lg С(Н+) или рН = – lg a (H+).
В нейтральном растворе: С (Н+)=С (ОН-) = 10-7 моль/л; рН=7
В кислом растворе: С (Н+)>С (ОН-)>10-7моль/л; рН<7.
В щелочном растворе: С (ОН-)>С (Н+)<10-7 моль/л; рН>7.
Вода является слабым электролитом и характеризуется ионным произведением воды, КW, которое равно:
КW = С (Н+)×С (ОН-)=10-14.
Ионное произведение воды – величина постоянна при данной температуре. Прологарифмирую это уравнение, получим:
рН+рОН=14.
Из этого уравнения следует, что зная рН можно легко рассчитать рОН, и наоборот.
Расчет рН сильных электролитов
Пример 1.
Определите рН 0,1 М раствора HCl.
Диссоциация HCl происходит полностью: HCl→H++Cl  , при этом
, при этом  моль/л. Соответственно
моль/л. Соответственно  , т.е. необходимо вычислить ионную силу раствора HCl и по ней в таблице выбрать коэффициент активности ионов водорода.
, т.е. необходимо вычислить ионную силу раствора HCl и по ней в таблице выбрать коэффициент активности ионов водорода.

По таблице выбираем коэффициент активности γ, равный 0,84, следовательно:
рН=-lg0,84×0,1=1,08.
Пример 2.
Определите рН 0,1 М раствора NaOH.
Так как NaOH является сильным электролитом, его диссоциация происходит полностью: NaOH→Na++OH  , при этом
, при этом  моль/л. В данном случае рН=14–рОН и первоначально находим
моль/л. В данном случае рН=14–рОН и первоначально находим  .
.
Рассчитываем ионную силу 0,1 М раствора NaOH.
 .
.
По таблице выбираем коэффициент активности γ для ионов гидроксила, равный 0,8. Рассчитываем рОН:
рОН=-lg0,8×0,1=1,097,
рН=14-1,097=12,903.
Расчет рН слабых электролитов
При расчете рН слабых электролитов, обычно используют значение концентрации ионов водорода, а не величину активности  , так как вследствие неполной диссоциации слабых электролитов, в растворе находится небольшое количество заряженных частиц, между которыми происходят незначительные взаимодействия. В этом случае
, так как вследствие неполной диссоциации слабых электролитов, в растворе находится небольшое количество заряженных частиц, между которыми происходят незначительные взаимодействия. В этом случае  .
.
|
|
Пример 1.
Рассчитайте рН 0,1 М раствора СH3CООН, константа диссоциации которого равна К Д=1,8×10  5.
5.
Уксусная кислота диссоциирует по уравнению:
СH3CООН→СH3CОО  +H+;
+H+;
 .
.
Так как диссоциация уксусной кислоты неполная, то  , где С 0 – исходная концентрация СH3CООН. Степень диссоциации a находим по уравнению Оствальда:
, где С 0 – исходная концентрация СH3CООН. Степень диссоциации a находим по уравнению Оствальда:
 ;
;  ,
,
тогда  =0,424×10
=0,424×10  2×10
2×10  1=0,424×10
1=0,424×10  3; рН=-lg0,424×10
3; рН=-lg0,424×10  3=3,38.
3=3,38.
Пример 2.
Рассчитайте рН 0,1 М раствора NH4OH, константа диссоциации которого равна К Д=1,79×10-5.
Аммиак диссоциирует по уравнению
NH4ОН→N  +ОH
+ОH  ;
;
рН=14–рОН; 
Находим степень диссоциации a:
 ;
; 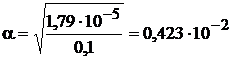 .
.
Находим концентрацию ионов ОН  и рОН раствора
и рОН раствора
 =0,423×10
=0,423×10  2×10
2×10  1=0,423×10
1=0,423×10  3; рОН=-lg0,423×10
3; рОН=-lg0,423×10  3=3,38.
3=3,38.
Находим рН раствора:
рН=14–3,38=10,62.
Контрольные задания
101 *. Вычислите рН 0,05 M HCl и 0,05 М СН3СООН.
102 *. Вычислите pH 0,01 M раствора NH4OH.
103 *. Вычислите степень диссоциации NH4OH в 0,05 M растворе при 298 К.
104 *. Вычислите рН 0,01 M NaOH и 0,01 М NH4OH.
Таблица 4. Константы диссоциации некоторых слабых электролитов
t=25 С
| Вещество | Кд | Вещество | Кд | |
| СН3СООН | 1,7510-5 | HF | 6,6110-4 | |
| NH4OH | 1,7910-5 | HCOOH | 1,7610-4 | |
| HClO | 3,010-8 |
105 *. Вычислите степень диссоциации и концентрацию ионов водорода [H+] в 0,3 М раствора HF.
106 *. При какой молярной концентрации уксусной кислоты в растворе ее степень диссоциации равна 0,01? При какой концентрации кислоты увеличится в два раза?
107. Степень диссоциации муравьиной кислоты НСООН в 0,2 н. растворе равна 0,03. Определите константу диссоциации кислоты.
108 *. Вычислите концентрацию ионов NH4+в 0,005 М растворе NH4OH при 298 К.
109 *. Вычислите активности ионов Н+ и ОН-в 0,01 M NaOH при 298 К.
110 *. Рассчитайте молярность раствора уксусной кислоты СН3СООH, рН которого равен 3.
|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!