Рассмотрим диаграмму состояния Cu-Ni с неограниченной растворимостью компонентов в твердом состоянии (рис. 12). Выберем две рабочих точки на диаграмме состояния: А и В. Точка А расположена ниже линии солидус, и состояние сплава полностью определено: сплав на 100 % состоит из одной фазы (α– твердый раствор) и имеет состав 40 % Cu – 60 % Ni (вес. %). Полностью известно состояние сплава и в любой точке выше линии ликвидус (жидкость).
Теперь рассмотрим точку В. Из диаграммы состояния видно, что сплав состоит из двух фаз: L и α. Однако концентрация Ni в каждой фазе и их весовая (массовая) доля неизвестны. Эти величины находят с помощью правила отрезков (концентрация) и правила рычага (массовая доля).
Правило отрезков. Через выбранную рабочую точку В (см. рис. 13) проводят горизонтальную прямую (изотерму) до пересечения с линиями ликвидус и солидус. Эту линию называют конодой.
Правило отрезков:
• точка а на линии ликвидус дает концентрацию Ni в жидкости: СL = 32 вес. % Ni;
• точка b на линии солидус дает концентрацию Ni в твердой фазе (в α – твердом растворе): Сα = 43 вес. % Ni.

Рис. 12. Диаграмма состояния Cu-Ni

Рис. 13. Диаграмма состояния Cu-Ni (к правилу отрезков и правилу рычага)
Правило рычага. Используем то же построение, что и для правила отрезков (рис. 13). Пусть концентрация Ni рабочей точке В равна С0. Рабочая точка В (точка опоры) делит коноду ав (рычаг) на два плеча аВ и Вb.
Применим для коноды условие равновесия рычага (рис. 14): отношение масс обратно пропорционально отношению длин плеч рычага:
 =
= 
 , (3)
, (3)
где mα и mL – массы α – твердого раствора и жидкости, соответственно.
Массовая доля α – твердого раствора будет равна
Wα = 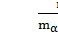 =
=  =
=  . (4)
. (4)
Массовая доля жидкости будет равна
WL =  =
=  =
= 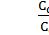 . (5)
. (5)
Правило отрезков и правило рычага справедливы для любой двухфазной области, независимо от типа диаграммы состояния.

Рис. 14. Механическая аналогия, поясняющая правило рычага
Задача 1.
Определить массовые доли обеих фаз для точки В (рис. 13).
Решение. В точке В: С0 = 35 %Ni; Cα = 43 %Ni; CL = 32 %Ni (вес. %).
Подставляя эти данные в формулы (4) и (5) получим:
Wα =  =
=  = 0,27 и WL =
= 0,27 и WL = 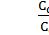 =
=  = 0,73.
= 0,73.
2.7. Диаграмма состояния сплавов, образующих ограниченные твердые растворы и эвтектику (3-го рода)
Исходные данные:
• компоненты: А, В (K = 2);
• оба компонента неограниченно растворимы в жидком состоянии, ограничено – в твердом состоянии и не образуют химических соединений;
• фазы: жидкий сплав L, ограниченные твердые растворы α = А(В) и β = В(А).
Диаграмма состояния (с эвтектикой) показана на рис. 15. Линии АЕВ и ADЕCВ – линии ликвидус и солидус, соответственно; линия DEC – эвтектическая. В сплавах данного типа существует некоторая взаимная растворимость компонентов А и В в твердом состоянии. Поэтому при кристаллизации из жидкости вместо зерен чистых компонентов А и В (см. п. 2.3, рис. 8) образуются зерна ограниченных твердых растворов на основе А и В, т. е. α = А(В) и β = В(А).

Рис. 15. Диаграмма состояния сплава с ограниченной растворимостью компонентов в твердом состоянии
Сплав I Сплав II




Рис. 16. Кривые охлаждения и схемы структур сплавов I и II
Области существования α– и β–твердых растворов расположены около вертикалей А и В, соответственно (рис. 15). Предельная растворимость В в А, т. е. максимальная концентрация В в α–твердом растворе, зависит от температуры и определяется линией DF, а предельная растворимость А в В, т. е. максимальная концентрация А в β–твердом растворе, определяется линией CG. Эти линии называются сольвус – линиями или кривыми растворимости. Точка D определяет максимальную концентрацию компонента В в α–твердом растворе (25 вес. % В). В свою очередь, т. С определяет максимальную концентрацию компонента А в β–твердом растворе (100 – 82 = 18 вес. % А).
Сплавы, находящиеся между линиями DF и CG, лежат за пределами растворимости и являются двухфазными, состоящими из механической смеси α + β. Эти двухфазные сплавы принято делить на:
• внеэвтектические: слева от точки D (в том числе, сплав I) и справа от точки С;
• доэвтектические: концентрация В – от точки D до точки Е (сплав II);
• эвтектический: концентрация точки Е;
• заэвтектические: концентрация В – от точки E до точки C.
Рассмотрим процессы кристаллизации сплавов I и II.
Кристаллизация сплава I начинается в точке 1 (линия ликвидус) и заканчивается в точке 2 (линия солидус). Кривая охлаждения и схема структур этого сплава показана на рис. 16. На отрезке 1–2 из жидкого сплава L выделяются и растут кристаллы α–твердого раствора. Концентрация В в растущих зернах α – фазы растет по линии солидус (а–2), а в жидкости L – по линии ликвидус (1–b). В точке 2 кристаллизация заканчивается, и полученные кристаллы должны иметь (для равновесной кристаллизации) концентрацию исходной жидкости. На отрезке 2–3 превращения отсутствуют. Ниже точки 3 α–твердый раствор является пересыщенным и выделяет избыточные атомы В. В результате внутри зерен α–твердого раствора образуются кристаллы β– твердого раствора по реакции α → βII. Эти кристаллы называют вторичными, поскольку они выделяются из твердого раствора, в отличие от первичных, выделяющихся из жидкости. Их обозначают симво-
лом βII. Процесс выделения вторичных кристаллов называется вторичной кристаллизацией.
Сплав с концентрацией В левее точки F не будет иметь вторичных выделений βII, т. е. будет иметь структуру α–твердого раствора.
На рис. 15 линия CG, в отличие от линии DF, изображена вертикальной, т. е. растворимость А в В не зависит от температуры. Поэтому вторичные выделения α–твердого раствора ниже линии ВС отсутствуют. Такие выделения возникли бы, если бы линия DF была наклонена вправо, т. е. растворимость А в В уменьшалась бы с понижением температуры.
Кристаллизация сплава II. Сплавы типа II называются доэвтектическими. Кривая охлаждения и схемы структур такого сплава показаны на рис. 16, справа. На отрезке 1–2 из жидкости выделяются и растут кристаллы α–твердого раствора. Концентрация В в α изменяется по линии солидус (растет от точки с до точки D). За счет образования α–зерен оставшаяся жидкость обогащается компонентом В по линии ликвидус (от точки 1 до точки Е). В точке 2 оставшаяся жидкость достигает горизонтальной линии DCE (эвтектическая температура tE), и концентрация В в жидкости соответствует эвтектической (точка Е). В этих условиях на участке 2–2′ оставшаяся жидкость кристаллизуется по эвтектической реакции:
LE → αD + βC, (6)
где αD – α–твердый раствор состава точки D, βC – β–твердый раствор состава точки С.
В общем виде эвтектическую реакцию записывают так:
L → α + β. (7)
В точке 2′ (конец кристаллизации жидкости) формируется структура, состоящая из кристаллов αD и эвтектики Е = α + β. При дальнейшем охлаждении сплава (отрезок 2′ –3) растворимость В в α–твердом растворе уменьшается по кривой DF (как в сплаве I). Поэтому из кристаллов α выделяются вторичные кристаллы βII по реакции α → βII (как в сплаве I).
Таким образом, конечная (при нормальной температуре) структура доэвтектического сплава II: αF + эвтектика (αF + βG) + βII.
Сплавы с концентрацией В в интервале от точки Е до точки С называются заэвтектическими. Они кристаллизуются аналогично доэвтектическим. Различие состоит в том, что на первом этапе (между линиями ликвидус и солидус) из жидкой фазы выделяют-
ся первичные кристаллы β. За счет этого концентрация В в оставшейся жидкости уменьшается по линии ВЕ. На втором этапе при эвтектической температуре (линия DEC) остаток жидкости кристаллизуется по эвтектической реакции: L → α + β. Конечная структура заэвтектического сплава: β + эвтектика (α + β).
Несмотря на многообразие структурных составляющих [первичные кристаллы α- и β – твердых растворов, вторичные кристаллы β – твердого раствора, эвтектика (α + β)], окончательно охлажденный сплав содержит только две фазы (α и β), в которых концен-
трация компонента В определяется точками F и G, соответственно.
Проверим правильность построения кривых охлаждения и диаграммы состояния (рис. 16 и 15) с помощью правила фаз (С = К – Ф + 1) на примере сплава II:
• отрезок 1–2: С = 2 – 2 + 1 = 1, следовательно, температура Т изменяется;
• отрезок 2–2′: С = 2 – 3 + 1 = 0, следовательно, температура Т = const;
• отрезок 2′ –3: С = 2 – 2 + 1 = 1, следовательно, температура Т изменяется.
Таким образом, кривая охлаждения построена правильно.
В качестве примера на рис. 17 приведена диаграмма состояния системы Pb–Sn. Здесь же показана микроструктура доэвтектического, эвтектического и эвтектического сплавов данной системы. Видно, что эвтектический сплав имеет структуру пластинчатой эвтектики Е = α + β, где α и β – ограниченные твердые растворы: α = Pb(Sn); β = Sn(Pb). Доэвтектический сплав содержит темные зерна первичного α–твердого раствора, окруженные колониями эвтектики. Внутри α–зерен видны выделения вторичной β–фазы (βII). Заэвтектический сплав состоит из зерен первичного β–твердого раствора, окруженных колониями эвтектики. Внутри светлых зерен β–фазы видны выделения вторичной
α–фазы (αII).

E = α+β β+αII E = α+β



Рис. 17. Диаграмма состояния и микроструктура сплавов системы Pb–Sn
Задача 2. Для сплава 60 %Pb – 40 %Sn (вес. %) (см. рис. 18) определить при Т = 150°С:
1) фазовый состав;
2) химический состав каждой фазы;
3) массовую долю каждой фазы.

Рис. 18. Диаграмма состояния системы Pb–Sn
Решение.
1) Находим на диаграмме состояния Pb–Sn (рис. 18) рабочую точку В, соответствующую условиям задачи. Так как точка В находится внутри (α + β) – области, то в данной точке присутствуют две фазы: α и β.
2) В точке В присутствуют две фазы. Через эту точку проводим горизонтальную линию (коноду), как показано на рис. 18. Состав α–фазы соответствует точке пересечения коноды с линией предельной растворимости А в В, т. е. с границей раздела областей α/α+β. Итак, состав α–фазы Сα: 89 % Pb – 11 % Sn. По аналогии находим состав β-фазы Сβ: 1 % Pb – 99 % Sn.
3) Поскольку сплав состоит из двух фаз, то для нахождения массовой доли каждой фазы необходимо использовать правило рычага [(см. п. 2.5, формулы (4) и (5)]. Обозначая общий состав сплава С1 (точка В), получим:
Wα = 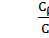 =
=  = 0,67 и Wβ =
= 0,67 и Wβ = 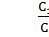 =
=  = 0,33.
= 0,33.



 =
= 
 , (3)
, (3)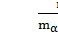 =
=  =
=  =
=  =
= 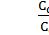 . (5)
. (5) = 0,27 и WL =
= 0,27 и WL =  = 0,73.
= 0,73.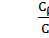 =
=  = 0,67 и Wβ =
= 0,67 и Wβ = 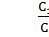 =
=  = 0,33.
= 0,33.


