Окислительно-восстановительные свойства координационных соединений определяются электронной конфигурацией комплексообразователя, то есть заселенностью его d e - и d g - орбиталей, что в свою очередь зависит от силы лигандов.
Если в результате потери или приобретения электронов образуется ион комплексообразователя с более симметричным распределением электронов, с большими ∆ и ЭСКП, то такое соединение участвует в окислительно-восстановительных реакциях при наличии, естественно, окислителя или восстановителя, в качестве сореагента.
Например, для ионов- восстановителей в октаэдрическом поле легко осуществляются следующие переходы:
[Cr(H2O)6]2+ + O2 +4H+ ® [Cr(H2O)6]3+ + 2H2O.
ВС d ε3 d γ1 - ē ® ВС d ε3 d γ0
[Co(NH3)6]2+ + O2 +2H2O ® [Co(NH3)6]3+ +4OH-
ВС d ε4 d γ3 - ē ® НС d ε6 d γ0
Очень сильные восстановители и потому неустойчивы низкоспиновые октаэдрические комплексы Co(II):

НС d ε6 d γ1 - ē ® НС d ε6 d γ0
Октаэдрические комплексные ионы проявляют окислительные свойства, если реализуются, например, такие переходы:
2[Fe(CN)6]3- + H2S® 2[Fe(CN)6]4- + S +2H+
НС d ε5 d γ0 +  ® НС d ε6 d γ0
® НС d ε6 d γ0
[Co(H2O)6]3+ +  ® [Co(H2O)6]2+, E0=1,84B
® [Co(H2O)6]2+, E0=1,84B
ВС d ε4 d γ2 +  ® ВС d ε5 d γ2
® ВС d ε5 d γ2
[Mn(CN)6]3- 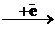 [Mn(CN)6]4-
[Mn(CN)6]4-
НС d ε4dγ0 +  ® НС d ε5 d γ0
® НС d ε5 d γ0
Вопросы для самопроверки
1. Определите: а) заряды комплексных ионов, б) заряды и электронные конфигурации комплексообразователей, в) координационные числа и г) тип комплексов в [Cu(NH3)4](OH)2, [Cr(H2O)6]Cl3, H[AuCl4], [Ni(CO)4].
2. Приведите диаграмму расщепления d- орбиталей для октаэдрической симметрии, предскажите образование низко- или высокоспиновой электронной конфигурации на примере комплексов [Co(NO2)6]3 -, [ CoF6]3-, [Fe(CN)6]3 -.
3. Определите энергию стабилизации кристаллическим полем в единицах D для высоко- и низкоспиновых октаэдрических комплексов Fe(III), Co(III).
4. С позиций ТКП объясните, почему гексааквакомплексы Cr(II) и Fe(II) легко окисляются.
5. Вычислите DG0 комплексообразования [Ni(en)3]2+ по реакции
[Ni(NH3)6]3+ +3en = [Ni(en)3]2+ + 6NH3, если b = 1010.
6. Какие изомеры возможны для [CoCl2(en)2]+?
7. Каким должно быть геометрическое строение комплексного катиона CoCl2×6H2O?
8. Ионы Sc3+, Cr3+ и Zn2+ находятся в октаэдрическом окружении лигандов. Какой из этих комплексов окрашен и почему?
9. Чем объясняется диамагнетизм комплексного иона [Pt(NH3)6]4+?
10. Почему октаэдрические комплексы Cr(III) всегда парамагнитны?
Экспериментальная часть
1. Растворение осадка с образованием комплексного соединения
В две пробирки налейте по 3 капли 0,01н раствора азотнокислого серебра AgNO3 и по 2 капли 10% раствора иодистого калия KI. К выпавшим осадкам в одну пробирку добавьте 5 капель 10%-ного раствора тиосульфата натрия (Na2S2O3), а в другую – 5 капель концентрированного раствора аммиака. Что наблюдается?
Напишите уравнение реакции образования тиосульфатного комплекса Na3[Ag(S2O3)2]. Сравните константы образования аммиачного и тиосульфатного комплексов серебра и объясните, почему иодид серебра плохо растворяется в аммиаке и энергично растворяется в тиосульфате натрия.
Напишите выражение для полной константы образования тиосульфатного комплекса. Какую функцию эта реакция выполняет в “серебряной” фотографии?
2. Взаимодействие медно-аммиачного комплекса с целлюлозой
Поместите в пробирку небольшой кусочек ваты и добавьте 3 мл свежеприготовленного медноаммиачного комплекса (реактива Швейцера), полученного растворением Cu(OH)2×CuCO3 в концентрированном водном аммиаке. При размешивании стеклянной палочкой вата постепенно растворяется, образуя вязкую жидкость. Не следует брать большой кусочек ваты, так как это удлиняет продолжительность растворения.



 + n[Cu(NH3)m](OH)2 ®
+ n[Cu(NH3)m](OH)2 ®
целлюлоза медно-аммиачный комплекс

 О
О
 ® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3
® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3
OH
Около одного мл прозрачного густого раствора целлюлозы отлейте в другую пробирку, добавьте в нее 4–5 мл воды и вылейте смесь в стаканчик с 10–12 мл 10% соляной кислоты. Смесь сразу почти совсем обесцвечивается и выделяется свободная целлюлоза в виде белого студенистого осадка.
Объясните изменение окраски раствора при этом.
3. Комплексные соединения в окислительно-восстановительных реакциях
а) В две пробирки налейте по 3 капли раствора сульфата меди CuSO4. В одну добавьте несколько капель концентрированного раствора аммиака до образования сульфата тетраамминмеди (II) с константой устойчивости b=1012. В обе пробирки добавьте по 2 капли иодистого калия, прилейте 5–6 капель хлороформа 1), закройте пробкой и энергично встряхните. Что наблюдается? Почему в одном случае реакция Cu2+ + 2I- ® CuI + 1/2 I2 возможна, а в другом нет?
б) К 3 каплям 1М раствора CoCl2 добавьте две капли раствора уксусной кислоты (50%), 14–15 капель 2н NaNO2 и через две–три минуты прилейте 5–6 капель насыщенного раствора KCl для осаждения труднорастворимой соли K3[Co(NO2)6].
Реакция протекает по уравнению
[Co(H2O)6]Cl2+7NaNO2+2CH3COOH+3KCl®
K3[Co(NO2)6] +5NaCl+2CH3COONa+7H2O+NO.
Какие функции выполняют Co2+ и NO2- в этой реакции?
Объясните вероятность этой реакции с позиций ТКП (схема расщеплённых d-орбиталей), подтвердите вывод расчетом ЭСКП, если известно, что [Co(H2O)6]2+ - BC, а [Co(NO2)6]3- - НС комплексы.
4. Влияние поля лигандов на окраску комплексов
В три пробирки налейте по 3–4 капли раствора хлорида гексааквакобальта(II) [Co(H2O)6]Cl2 и добавьте по 10 капель: в первую – воды, в остальные – насыщенных растворов ацетата натрия CH3COONa и роданистого аммония NH4NCS. Отметьте изменение окраски. Напишите уравнения реакций, принимая во внимание, что ацетатный комплекс имеет октаэдрическое, а роданидный – тетраэдрическое строение, и в обоих случаях образуются анионные комплексы:
Na4[Co(CH3COO)6] и (NH4)2[Co(NCS)4].
Изменение окраски комплексов объясните в рамках ТКП.
5. Гидратная изомерия
В две конические колбы налейте по 20 мл 1%-ного раствора соли CrCl3×6H2O, состав которой отвечает двухионному комплексному соединению [CrCl2(H2O)4]Cl×2H2O. Одну колбу закройте часовым стеклом и кипятите в течение 7–8 минут. Охладите раствор и перелейте его в мерный цилиндр, добавьте дистиллированной воды до первоначального объема. Обратите внимание на изменение окраски. Измерьте электропроводность первоначального и полученного растворов.
Исходя из величин электропроводности, напишите формулу образовавшегося гидратного изомера (см. раздел “Изомерия комплексных соединений”).
6. Спектрофотометрическое определение состава комплексного соединения и его первой константы образования (b)
Для комплексов с небольшими значениями b экспериментально, с достаточной степенью точности, можно определить первую константу образования (b1).
Изучим реакцию:
[Fe(H2O)6]3+ + NCS- ® [FeNCS(H2O)5]2+ + H2O,
в которой образуется окрашенный комплексный ион, и в оптическом спектре его появляется полоса поглощения при 720 нм.
Если для серии изомолярных растворов построить диаграмму: состав – оптическая плотность D(C), то
─ наличие максимума указывает на образование соединения;
─ наличие размытого максимума свидетельствует о заметной диссоциации комплекса.
Степень диссоциации комплекса (a) равна
 (1)
(1)
Для краткости процесс образования комплекса (I ступень) опишем уравнением
Fe3+ + NCS- = [Fe(NCS)]2+
и обозначим индексом [ ] – равновесные концентрации реагентов, а индексом [ ]0 – их исходные концентрации. Тогда при равенстве исходных концентраций Fe3+ и NCS - равновесные концентрации реагирующих веществ будут равны соответственно
[Fe3+] = [Fe3+]0 ×a, [NCS-] = [NCS-]0 ×a,
[Fe(NCS)2+] = [Fe3+]0 × (1– a) = [NCS-]0 × (1– a),
а для константы образования комплексного иона в этих условиях ([Fe3+]0=[NCS-]0) получим
 Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение
Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение
концентраций [Fe3+]0:[NCS-]0 должно быть больше (избыток Fe3+) или равно 1, чтобы предотвратить комплексообразование по следующим ступеням: [Fe(NCS)2]+, Fe(NCS)3 и т.д.,

(а) (б)
Рис. 9.5. Изменение оптической плотности изомолярных растворов при образовании комплекса
а) зависимость оптической плотности от концентрации комплекса в случае отсутствия диссоциации (Dтеор.)
б) зависимость оптической плотности от концентрации комплекса в случае заметной диссоциации (Dэкспер.)
что может иметь место при избытке роданид-ионов1). В случае избытка Fe3+ его равновесная концентрация будет складываться из избыточной (Dс=[Fe3+]0 –[NCS-]0) концентрации железа, не связанного в комплекс, и железа (III), перешедшего в раствор в результате диссоциации нестойкого комплексного иона [Fe3+] = Dс + [NCS-]0 ×a, и тогда

Зная константу образования иона (b1), можно рассчитать DG0 реакции комплексообразования.
DG0 = – RT ln b1. (3)
Работа выполняется в следующем порядке:
1. В 12 колбах приготовьте изомолярные смеси с различным соотношением [Fe3+]0: [NCS-]0 в соответствии с таблицей 9.4.
2. Проведите измерение оптической плотности растворов (светофильтр № 6), используя в качестве раствора сравнения 0,005М раствор Fe(NO3)3.
3. Постройте график зависимости оптической плотности от состава раствора.
4.Проведите касательную к экспериментальной кривой через точки, соответствующие оптической плотности растворов в колбах №1 (0,005М раствор Fe(NO3)3) и №2 1). Касательная к экспериментальной кривой определяет зависимость D(с) комплекса в отсутствии диссоциации.
5.Из графика для растворов с [Fe3+] ³ [NCS-]0 (колбы 5,6,7,8) определите DD=Dтеор.– Dэксп., рассчитайте:
а) a по формуле 1
б) b1 по формуле 2
в) DG0 по формуле 3.
6. Сделайте вывод о влиянии концентрации на степень диссоциации и на константу образования комплексного иона.
7. Объясните сдвиг максимума кривой D(с) в область [NCS-]0 > [Fe3+]0.
Таблица 9.4
| № колбы
| мл, р-ра Fe(NO3)3 0,005M
| мл, р-ра KNCS 0,005M
| конц. моль×л–1 [Fe3+]×103
| конц. моль×л–1 [NCS]×103
| Cоотнош. числа молей
| Оптическая плотность
|
|
|
|
| 5,0
| 0,0
| 20:0
|
|
|
|
|
| 4,75
| 0,25
| 19:1
|
|
|
|
|
| 4,25
| 0,75
| 17:3
|
|
|
|
|
| 4,0
| 1,0
| 16:4
|
|
|
|
|
| 3,75
| 1,25
| 15:5
|
|
|
|
|
| 3,5
| 1,5
| 14:6
|
|
|
|
|
| 3,0
| 2,0
| 12:8
|
|
|
|
|
| 2,5
| 2,5
| 10:10
|
|
|
|
|
| 2,0
| 3,0
| 8:12
|
|
|
|
|
| 1,5
| 3,5
| 6:14
|
|
|
|
|
| 1,0
| 4,0
| 4:16
|
|
|
|
|
| 0,5
| 4,5
| 2:18
|
|
|
|
|
|
|
|
|
|
РАБОТА 10. s - и p - ЭЛЕМЕНТЫ
Водород
Водород, кроме наиболее стабильных молекул Н2 и сольватированного иона Н+, существует в атомарном состоянии, в виде гидрид-иона Н–, молекулярных ионов Н2+ и Н2–. Из-за малого радиуса атома энергия связи в молекуле водорода наибольшая из всех двухатомных гoмoнуклеарных молекул VIIА и IА подгрупп:
|
| Н2
| F2
| Cl2
| Br2
| I2
| Li2
| Na2
| K2
|
| Ecв., кДж·моль–1
|
|
|
|
|
|
| 76,5
| 53,0
|
Образование иона Н+ сопровождается резким уменьшением эффективного радиуса, изменением кислотно-основных свойств и окислительно-восстановительных потенциалов некоторых соединений, гидратированием в водных растворах протона с образованием иона гидроксония Н3О+. Наличие вакантной s - орбитали способствует образованию водородной связи.
Водород следует рассматривать как не имеющий полных аналогов химический элемент. Его помещают либо в первую, либо в седьмую группу. К группе галогенов водород можно отнести из-за легкой замещаемости водорода галогенами в органических соединениях и способности к образованию аниона Н– (псевдогалогенид-иона). Сходство спектра водорода со спектрами щелочных элементов, способность взаимодействовать с неметаллами, образование Н+ в растворах, то есть восстановительная активность, позволяет помещать его в IА подгруппу.
Cоединения водорода
Соединения водорода c менее электроотрицательными элементами называют гидридами. Промежуточное значение ОЭО (2,1) позволяет водороду образовывать химические соединения с различной степенью полярности химической связи. По этому признаку различают: ионные (солеобразные) соединения (с s - элементами), ковалентно-полярные (с р - элементами), металлоподобные фазы внедрения с переходными металлами) (табл.10.1).
Переход от одного типа соединений к другому совершается постепенно. Так, гидриды меди и цинка занимают промежуточное положение между ионными и ковалентными, а гидриды серебра и золота сходны с гидридами переходных металлов.
10.2. s - Элементы
Элементы, у которых заполняются внешние s - оболочки, относят к IА (n s 1 - Li, Na, K, Rb, Cs, Fr) и IIА (n s 2 - Be, Mg, Ca, Sr, Ba, Ra) подгруппам. Степени окисления n s 1- и n s 2- элементов всегда равны номеру группы.
В основном состоянии атомы s 2 - элементов не имеют неспаренных электронов, поэтому образованию ковалентной связи в соединениях этих элементов предшествует возбуждение атомов
Евозб.
Э (n s 2) ––––––→ Э* (n s 1 n р 1).
Эти две валентные sр - гибридные орбитали определяют линейное строение трехатомных молекул ЭХ2 (Х = Н, F, Cl, Br, I).
Для s 1 - элементов характерно образование молекул Э2(s)2, для s 2 - элементов двухатомные молекулы не обнаружены – из-за равной заселенности связывающих и разрыхляющих орбиталей (s)2 (s*)2.
При одинаковом строении внешнего уровня атомов в подгруппе возрастающее влияние заряда ядра на валентные электроны частично компенсируется увеличением эффективных радиусов, приводя к снижению энергии ионизации атомов в группах сверху вниз и возрастанию ионности связи в однотипных соединениях. Вследствие небольшого радиуса
Таблица 10.1
Классификация соединений водорода
(численный индекс – относительная электроотрицательность ОЭО)
|
| I A
| II A
| IIIB
| IV B
| V B
| VI B
| VII В
| VIIIB
|
|
| I B
| II B
| III A
| IV A
| V A
| VI A
| VII A
|
|
| H2,1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Li1,0
| Be1,5
|
|
|
|
|
|
|
|
|
|
| B2,0
| C2,5
| N3,0
| O3,5
| F4,0
|
|
| Na0,9
| Mg1,2
|
|
|
|
|
|
|
|
|
|
| Al1,5
| Si1,8
| P2,1
| S2,5
| Cl3,0
|
|
| K0,8
| Ca1,0
| Sc1,3
| Ti1,5
| V1,6
| Cr1,6
| Mn1,5
| Fe1,8
| Co1,9
| Ni1,9
| Cu1,9
| Zn1,5
| Ga1,6
| Ge1,8
| As2,0
| Se2,4
| Br2,8
|
|
| Rb0,8
| Sr1,0
| Y1,2
| Zr1,4
| Nb1,6
| Mo1,8
| Tc1,9
| Ru2,2
| Rh2,2
| Pd2,2
| Ag1,9
| Cd1,7
| In1,7
| Sn1,8
| Sb1,9
| Te2,1
| I2,5
|
|
| Cs0,7
| Ba0,9
| La1,1
| Hf1,3
| Ta1,5
| W1,7
| Re1,9
| Os2,2
| Ir2,2
| Pt2,2
| Au2,4
| Hg1,9
| Tl1,8
| Pb1,8
| Bi1,9
| Po2,0
| At2,2
|
|
| Fr0,7
| Ra0,9
| Ac1,1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Ионные соединения
| Металлоподобные соединения
переменного состава
| Промежуточные соединения
| Ковалентно-полярные соединения
|
| | | | | | | | | | | | | | | | | | | |
и высокого значения энергии ионизации бериллий, как правило, не образует соединений с ионной связью.
Соединениям бериллия даже с наиболее электроотрицательными элементами (ВеО, BeF2) свойственен преимущественно ковалентный тип связи.
Величины стандартных окислительно-восстановительных потенциалов s- элементов указывают на их ярко выраженные восстановительные свойства. Все s - элементы вытесняют водород из кислот и воды:
Na + H2O = NaOH + ½H2
K + HCl = KCl + ½ H2
Ba + 2 H2O = Ba(OH)2 + H2,
восстанавливают металлы и неметаллы из оксидов и солей:
2Mg + SnО2 = 2MgO + Sn
2Mg + CО2 = 2MgO + C
Ca + РbCl2 = CaCl2 + Рb.
Химические соединения
Водородные соединенияs - элементов МН и МН2 называют солеподобными гидридами из-за их сходства с галогенидами. Они характеризуются ионным строением кристаллической решетки и высокими температурами плавления. Расплавы этих соединений – электролиты; при их электролизе водород выделяется на аноде (2Н – – 2ē ® Н2). При взаимодействии с водой реакция протекает по окислительно-восстановительному механизму практически необратимо:
LiH + Н2 O ® LiOH + Н2
Н– – ē ® 1/2 Н2
Н2O + ē® 1/2 Н2 + OН–
Отрицательный стандартный электродный потенциал системы ЕоH2/2Н– = –2,23 В указывает на большую склонность
гидрид-иона отдавать электрон, что делает гидриды хорошими восстановителями.
Таблица 10.2.
Энергии ионизации, Е0 и радиусы s- элементов
| Элементы,
ns1
| Энергия ионизации,
I, эВ
| Окислительно-восстановительный потенциал, Ео, В
| Металлический радиус, нм
|
| Li
| 5,39
| –3,02
| 0,155
|
| Na
| 5,14
| –2,71
| 0,189
|
| K
| 4,34
| –2,93
| 0,236
|
| Rb
| 4,18
| –2,99
| 0,248
|
| Cs
| 3,89
| –3,02
| 0,268
|
|
|
|
|
|
| Элементы,
ns2
| Энергия ионизации,
I, эВ
| Окислительно-восстановительный потенциал, Ео, В
| Металлический радиус,
нм
|
| Be
| 9,32
| –1,85
| 0,104
|
| Mg
| 7,65
| –2,37
| 0,128
|
| Ca
| 6,11
| –2,86
| 0,169
|
| Sr
| 5,69
| –2,89
| 0,184
|
| Ba
| 5,21
| –2,90
| 0,206
|
| Ra
| 5,28
| –2,92
| 0,235
|
Все солеобразные гидриды обладают высокой реакционной способностью:
3ВаН2 + N2 = Ba3N2 + 3Н2
LiH + Cl2 = LiCl + HCl
NaH + CO2 = HCOONa
Гидриды бериллия и магния имеют переходный характер между ионными и ковалентными и в твердом состоянии имеют полимерное строение.
При сжигании в атмосфере кислорода щелочных металлов образуются пероксиды М2O2 (молекулярный ион О22-). Только литий при обычных условиях сгорает в кислороде до
Li2O. Начиная с калия, наряду с М2O2, образуются надперок-
сиды КO2, RbO2, CsO2 (молекулярные ионы О2-).
Щелочноземельные элементы при взаимодействии с кислородом в аналогичных условиях дают оксиды. Пероксиды получаются труднее, чем для щелочных элементов. Оксиды s - элементов имеют основный характер, что подтверждается характером их взаимодействия с кислотными оксидами:
СO2 + Li2О = Li2СO3.
Исключение составляет ВеО – он амфотерен:
ВеО + Na2О = Na2ВеO2
ВеО + SO3 = BeSO4
Пероксиды проявляют окислительно-восстановительную двойственность за счет пероксид-иона O22–:
O22– + 2ē = 2O2–, O22– – 2ē = O2.
Окислительные свойства пероксидов выражены сильнее, чем восстановительные. Пероксиды и надпероксиды, как сильные окислители, легко разлагаются разбавленными кислотами и водой:
К2О2 + Н2О = КОН + Н2О2
4КO2 + 2H2S O4 = 2H2O + 3O2 + 2 K2SO4
Pеакция 2Na2O2 + 2CO2 = 2Na2CO3 + O2
используется для получения кислорода в подводных лодках и космических кораблях.
Гидроксиды s - элементов получают при взаимодействии оксидов с водой. Большой ионный радиус s - элементов (табл.10.2) делает их гидроксиды сильными основаниями, а увеличение радиуса в группе сверху вниз приводит к усилению основного характера гидроксидов в рядах от Li к Cs и от Ве к Ва.
10.3. р - Элементы
р- Элементы имеют общую конфигурацию ns2 np1–6 и образуют IIIA, IVA, VA, VIA, VIIA, VIIIA подгруппы ПС.
В отличие от s -, р - элементы поливалентны (табл.10.3).
Таблица 10.3
Характерные степени окисления р – элементов
| Подгруппа
| IIIA
| IVA
| VA
| VIA
| VIIA
| VIIIA
|
| Валентные электроны
| s2p1
| s2p2
| s2p3
| s2p4
| s2p5
| s2p6
|
| Элемент
| B
| C
| N
| O
| F
| Ne
|
| Степени окисления
|
| 4, 2
–4
| 3, 5
–3
|
–2, –1
| –
–1
|
|
| Элемент
| Al
| Si
| P
| S
| Cl
| Ar
|
| Степени окисления
|
| 4, (2)
–4
| 5, 3
–3
| 6, 4, (2)
–2
| 1, 3, 5, 7
–1
|
|
| Элемент
| Ga
| Ge
| As
| Se
| Br
| Kr
|
| Степени окисления
|
| 4, 2
| 5, 3
–3
| 6, 4
–2
| 1, 3, 5, 7
–1
| 2, 4, 6
|
| Элемент
| In
| Sn
| Sb
| Te
| I
| Xe
|
| Степени окисления
| 3 (1)
| 4, 2
| 5, 3
(-3)
| 6, (4)
| 1, 3, 5, 7
–1
| 2, 4, 6, 8
|
| Элемент
| Tl
| Pb
| Bi
| Po
| At
| Rn
|
| Степени окисления
| 1, (3)
| 2, (4)
| 3, (5)
| 4, 6, 2
| 5, 7 –1
| 2, 4, 6, 8
|
| Гидроксиды
| H3ЭО3 сл.к.
НЭО2 сл.к.
ЭОН сл.осн.
Э(ОН)3осн.
| H2ЭО3 сл.к.
Н4ЭО4 сл.к.
Э(ОН)2осн.
| HЭО3 с.к.
НЭО2 сл.к.
Н3ЭО4 сл.к.
Н3ЭО3 сл.к.
Э(ОН)3сл.осн.
| H2ЭО4 с.к.
Н2ЭО3 сл.к.
Э(ОН)2сл.осн.
| HЭО4 с.к.
НЭО3 с.к.
НЭО2 сл.к.
НЭО оч.сл.к.
| H2XеO4 с.к.
Н6ХеО6 сл.к.
|
с.к. – сильная кислота; сл.к. – слабая кислота; оч.сл. к.– очень слабая кислота;
осн. – основание;; сл.осн. – слабое основание;
Низшие степени окисления проявляются за счет неспаренных р - электронов, высшие, равные номеру группы – за счет s - и р - электронов. По мере перехода сверху вниз в группах возрастает разница энергии s - и р - подуровней. Поэтому для элементов, стоящих вверху группы, устойчивы высшие степени окисления, внизу – низшие. Например, в IVA подгруппе стабильность соединений со степенью окисления +4 уменьшается в последовательности Ge – Sn – Pb. В той же последовательности увеличивается устойчивость соединений со степенью окисления +2. Изменение устойчивости соединений элементов высших степеней окисления подтверждается, в частности, значениями стандартных электродных потенциалов (ESn4+/Sn2+=0,15В, EoPb4+/Pb2+=1,80B) и температурами разложения водородных соединений:
| Соединение
| CH4
| SiH4
| GeH4
| SnH4
| PbH4
|
| tразл., 0С
|
|
|
|
|
|




 ® НС d ε6 d γ0
® НС d ε6 d γ0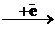 [Mn(CN)6]4-
[Mn(CN)6]4-


 + n[Cu(NH3)m](OH)2 ®
+ n[Cu(NH3)m](OH)2 ®
 О
О ® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3
® [C6H7O2 –– O –– Cu(NH3)z(OH)2]n + (m–z)NH3 (1)
(1) Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение
Заметим, что для определения константы образования роданидного комплекса Fe(III) по 1-й ступени соотношение



