Кроме многочисленных гальванических элементов, составленных из различных пар полуэлементов, практическое значение имеют еще концентрационные. топливные и ХИТ многоразового действия (аккумуляторы).
Концентрационные элементы состоят из одинаковых электродов, отличающихся активностями потенциалопределяющего иона aMn+. При a1> a2 схема концентрационного элемента запишется в виде:
(–) M | Mn+ (a2) || Mn+ (a1) |M (+),
а ЭДС
будет равна

ЭДС этих элементов очень мала. Обычно они используются при определении pH и концентраций труднорастворимых солей.
В топливных гальванических элементах процесс окисления некоторых видов топлива используется для непосредственного получения электрической энергии. Основным их преимуществом является принципиальная возможность достижения очень высоких КПД использования топлив.
В настоящее время достигнуты значительные успехи в разработке водородно-кислородного топливного элемента, схема которого приведена на рис.7.3. В этом элементе протекает реакция, которая описывается уравнением:
2H2 + O2 = 2H2O (+ электроэнергия + Q)
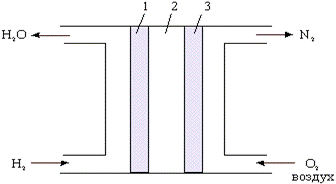
Рис. 7.3. Схема кислородно-водородного топливного элемента: 1 - анод (Pt), 3 - катод (Pt), 2 - электролит (раствор KOH).
К аноду подводится топливо (H2) - восстановитель, к катоду − окислитель (чистый кислород или кислород воздуха). Между электродами находится электролит (ионный проводник), в качестве которого используется раствор щелочи. Схема ТЭ записывается в виде:
(-) H2, Me | KOH | Me, O2 (+),
где Me - проводник первого рода, играющий роль катализатора электродного процесса и токоотвода
На аноде протекает реакция окисления водорода:
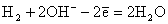
На катоде протекает реакция восстановления кислорода:
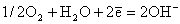
Во внешней цепи происходит движение электронов от анода к катоду, а в растворе движение OH-- ионов − от катода к аноду. Таким образом, в результате реакции генерируется электрический ток, и химическая энергия непосредственно превращается в электрическую энергию.
Эффективность работы топливного элемента определяется скоростями соответствующих электродных процессов, которые, в свою очередь, зависят от электрохимической активности электродов и величины их поверхности. Высокая электрохимическая активность электродов достигается введением в них соответствующих катализаторов. В качестве катализаторов электродных процессов в ТЭ используются металлы платиновой группы (Pt, Pd, Ir), Ag, специально обработанные Ni, Co, активированный уголь.
Так как величина тока, протекающего через электрод, зависит от его поверхности, то в топливных элементах применяют пористые электроды, обладающие развитой поверхностью. Пористый электрод представляет собой систему контактирующих друг с другом твердых частиц, обладающих электронной проводимостью, и пустот между частицами. При подаче газообразного окислителя и восстановителя электрохимические реакции протекают на участках пористого электрода, легкодоступных как для газа, так и для электролита.
Важное значение для эффективной работы ТЭ имеет подбор электролита. Он должен обладать высокой ионной электропроводностью и стабильностью. В качестве электролитов широко используются, например, водные растворы KOH, NaOH, H3PO4, расплавы карбонатов.
Батарея топливных элементов с устройствами для подвода топлива и окислителя, вывода продуктов реакции, поддержания и регулирования температуры называется электрохимическим генератором. Кислородно-водородные генераторы применяются на космических кораблях. Они обеспечивают космический корабль и космонавтов не только электроэнергией, но и водой, которая является продуктом реакции в топливном элементе.
Сухой элемент
Разновидность гальванических элементов, называемая сухим элементом, получила широкую распространенность благодаря тому, что этот элемент используется для питания ручных электрических фонариков и радиоприемников. В одном из вариантов анод выполнен в виде цинковой оболочки элемента, контактирующей с влажной пастой из

|
| Рис. 7.4 Сухой гальванический элемент
|
MnO2, NH4Cl и угля. В пасту погружен инертный катод, представляющий собой графитовый стержень, как показано на рис. 7.4.
Снаружи сухой элемент имеет оболочку из картона или металла, предохраняющую его от атмосферных воздействий
В этом гальваническом элементе протекают довольно сложные электродные реакции:
на аноде: Zn (т) - 2ē = Zn2+ (р),
на катоде:
2NH4+ (р) + 2MnO2 (т) + 2ē = Mn2O3 (т) + 2NH3 (р) + H2O (ж.).
Из-за ограниченной подвижности реагентов в сухом элементе электрохимически активна лишь часть катодного пространства, находящаяся в непосредственной близости от электрода.
Аккумуляторами называются обратимые гальванические элементы многоразового действия. При пропускании через них электрического тока (зарядке) они накапливают химическую энергию, которую потом при их работе (разрядке) отдают потребителю в виде электрической энергии. Наиболее распространены два вида аккумуляторов: кислотный (свинцовый) и щелочные.
Анод свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39%), в котором PbSO4 и PbO2 практически не растворимы.
Схему аккумулятора можно изобразить так:
(–) Pb│PbSO4│H2SO4│PbSO4│PbO2│Pb (+).
Анодный процесс работающего аккумулятора
Pb + SO42– – 2  = PbSO4 , Е0PbSO4/Pb = 0,36 B.
= PbSO4 , Е0PbSO4/Pb = 0,36 B.
Катодный процесс
PbO2 + 4H+ + SO42– + 2  = PbSO4 + 2H2O,
= PbSO4 + 2H2O,
Е0РbO2/PbSO4 = 1,69 B.
Таким образом, в свинцовом аккумуляторе осуществляется
обратимая реакция:
работа
 Pbтв. + PbO2тв. + 2H2SO4 2PbSO4тв. + 2H2O.
Pbтв. + PbO2тв. + 2H2SO4 2PbSO4тв. + 2H2O.
зарядка
В обратном направлении протекает реакция при зарядке аккумулятора от генератора, и электроды в этом случае меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активностей кислоты и воды:

В процессе работы аккумулятора концентрация кислоты падает, а, следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются толстым слоем PbSO4 иаккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
В щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-ный раствор КОН:
(–) Fe │Fe(OH)2 │KOH│Ni(OH)2│Ni(OH)3│ Ni (+).
При работе аккумулятора на аноде происходит окисление железа:
Fe – 2  + 2OH– = Fe(OH)2, Е0 Fe(OH)2/Fe = -0,44 B,
+ 2OH– = Fe(OH)2, Е0 Fe(OH)2/Fe = -0,44 B,
на катоде – восстановление гидроксида никеля (III):
2Ni(OH)3 + 2  = 2Ni(OH)2 + 2OH–,
= 2Ni(OH)2 + 2OH–,
E0Ni(OH)3/Ni(OH)2 = 0,49 B.
Суммарная реакция процесса:
работа
 Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2
Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2
зарядка
В уравнении Нернста для данного аккумулятора под знаком логарифма стоят не концентрации, а произведения растворимости (ПР) участвующих в этой реакции труднорастворимых веществ:

ЭДС щелочного аккумулятора не зависит от концентрации щелочи, поскольку в выражении под знаком логарифма стоят постоянные величины.
Аналогично работают щелочные кадмий-никелевый и серебряно-цинковый аккумуляторы:
 Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2,
Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2,
 Zn + 2AgOH Zn(OH)2 + 2Ag.
Zn + 2AgOH Zn(OH)2 + 2Ag.
Примеры решения задач.
1. Пользуясь таблицей потенциалов, определите, будут ли протекать следующие окислительно-восстановительные реакции:
а) 2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
ox red
2Fe3++ 2  ® 2Fe2+, E0Fe3+/Fe2+ = +0,77B
® 2Fe2+, E0Fe3+/Fe2+ = +0,77B
2I– – 2  ® I2, E0I2 /2I– = +0,53B
® I2, E0I2 /2I– = +0,53B
E0 = E0ох – E0red = 0,77 – 0,53 = 0,24B > 0 ® реакция возможна.
б) 2FeCl3 + 2KBr = 2FeCl2 + Br2 + 2KCl
ox red
Fe3+ + 2  ® 2Fe2+, E0Fe3+/Fe2+ = +0,77B
® 2Fe2+, E0Fe3+/Fe2+ = +0,77B
2Br– - 2  ® Br2 , E0Br2/2Br– = +1,07B
® Br2 , E0Br2/2Br– = +1,07B
E0ох – E0red =0,77 – 1,07 = –0,3B < 0,
т.е. реакция восстановления Fe3+ ионами Br– невозможна в стандартных условиях.
2. Для гальванического элемента, составленного из электродов
Pt ½Ti3+, Ti2+ и Co2+½ Co,
а) запишите схему, исходя из значений электродных потенциалов полуэлементов;
б) укажите типы электродов;
в) напишите уравнения реакций, протекающих на электродах, суммарную реакцию процесса, уравнение Нернста для нее;
г) рассчитайте E0 реакции и оцените порядок Кравн;
д) определите направление электрохимической реакции, если
aTi3+ = aTi2+ = 10–2 моль·л –1, aCo2+ = 10–4 моль·л –1.
Решение.
а) В соответствии с табличными значениями стандартных электродных потенциалов
E0Ti3+/Ti2+ = – 0,37B, E0Co2+/Co = – 0,29B
электрод Pt ½Ti3+, Ti2+ будет выполнять в гальваническом элементе функции анода (восстановителя), а электрод Co2+½ Co – функции катода (окислителя), и тогда схема элемента запишется следующим образом:
(–) Pt |Ti3+, Ti2+ || Co2+| Co (+).
б) Анод (–)Pt ½Ti3+, Ti2+ – redox – электрод.
Катод (+) Co2+½ Co– металлический электрод.
|
| в) Анодная реакция
| Катодная реакция
|
|
| 2Ti2+ – 2  = 2Ti3+ = 2Ti3+
| Co2+ + 2  = Co = Co
|
Уравнение Нернста для суммарной реакции:
 Сo2+ +2Ti2+ 2Ti3+ + Co
Сo2+ +2Ti2+ 2Ti3+ + Co

г)

д) Значение ЭДС гальванического элемента в нестандартных условиях при заданных концентрациях будет равна

то есть при указанных концентрациях электрод Co2+½Co будет анодом, а электрод Pt ½Ti3+, Ti2+ – катодом, схема ГЭ запишется в виде
(–) Co2+| Co || Ti3+, Ti2+ | Pt (+),
а электрохимическая реакция будет протекать в направлении
Co + 2 Ti3+ ® Co2+ + 2 Ti2+.
Вопросы для самопроверки
1. Напишите электрохимические уравнения полуреакций, происходящих на электродах гальванического элемента:
(–) Mo | Mo2+ || KCI || Cu 2+ | Cu (+)
Где здесь анод, а где катод? На каком электроде происходит процесс окисления, а на каком – процесс восстановления?
2. Как была составлена таблица стандартных электродных потенциалов?
3. Какие типы электродов вы знаете?
4. Почему электроды 2 рода используются в качестве электродов сравнения?
5. Составьте схемы гальванических элементов на основе реакций:
 Ni + 2Ti4+ Ni2+ + 2Ti3+,
Ni + 2Ti4+ Ni2+ + 2Ti3+,
 2MnO
2MnO  + 5SO
+ 5SO  + 6H+ 2Mn2+ + 5SO
+ 6H+ 2Mn2+ + 5SO  + 3H2O
+ 3H2O
Напишите уравнение Нернста для этих элементов.
Оцените величину константы равновесия этих реакций.
6. Пользуясь таблицей стандартных электродных потенциалов, составьте гальванический элемент с ЭДС, равной 1,2 В. Приведите схему этого элемента. Напишите уравнение реакции, происходящей в этом элементе, и уравнение Нернста для неё.
7. В каком направлении будет протекать реакция в элементе
(–) Ni | Ni2+ || Sn2+ | Sn (+);
если aNi2+ = 1 моль×л–1, aSn2+ = 10–4 моль×л–1?
8. На чем основан принцип работы концентрационных гальванических элементов?
9. Принцип работы топливных элементов. В чем их преимущество перед другими типами гальванических элементов?
10. Напишите уравнения реакций, происходящих на электродах свинцового аккумулятора при его работе и зарядке. Напишите уравнение Нернста для этого аккумулятора.
11. Что вы знаете о щелочных аккумуляторах? Каковы здесь электродные процессы? Напишите уравнение Нернста для щелочного аккумулятора.
Экспериментальная часть





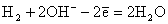
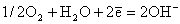

 = PbSO4 , Е0PbSO4/Pb = 0,36 B.
= PbSO4 , Е0PbSO4/Pb = 0,36 B. Pbтв. + PbO2тв. + 2H2SO4 2PbSO4тв. + 2H2O.
Pbтв. + PbO2тв. + 2H2SO4 2PbSO4тв. + 2H2O.
 + 2OH– = Fe(OH)2, Е0 Fe(OH)2/Fe = -0,44 B,
+ 2OH– = Fe(OH)2, Е0 Fe(OH)2/Fe = -0,44 B, Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2
Fe + 2Ni(OH)3 Fe(OH)2 + 2Ni(OH)2
 Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2,
Cd + 2Ni(OH)3 Cd(OH)2 + 2Ni(OH)2, Zn + 2AgOH Zn(OH)2 + 2Ag.
Zn + 2AgOH Zn(OH)2 + 2Ag. Сo2+ +2Ti2+ 2Ti3+ + Co
Сo2+ +2Ti2+ 2Ti3+ + Co



 2MnO
2MnO  + 5SO
+ 5SO  + 6H+ 2Mn2+ + 5SO
+ 6H+ 2Mn2+ + 5SO  + 3H2O
+ 3H2O

