С неорганическими анионами в фармацевтической практике встречаются как неорганические лекарственные вещества, так и соли органических оснований.
Бораты. Кислота борная является слабой. Поэтому при добавлении к водному раствору борной кислоты раствора метилового оранжевого желтый цвет индикатора изменяется до слабо-оранжевого. После добавления к этому раствору глицерина цвет раствора изменяется до красно-оранжевого. Это происходит в результате образования довольно сильной одноосновной глицероборной кислоты.

Куркумовая бумажка, смоченная раствором бората, предварительно подкисленная разведенной соляной кислотой, окрашивается в красно-коричневый цвет. После обработки этой бумажки раствором аммиака цвет становится голубым или серо-голубым.
Бромиды. Общей реакцией на хлориды, бромиды и иодиды является реакция с раствором серебра нитратом. В растворе, предварительно подкисленном разведенной азотной кислотой, с раствором серебра нитрата образуется желтоватый осадок, нерастворимый в азотной кислоте, трудно растворимый в растворе аммиака.
NaBr + AgNO3  AgBr↓ + NaNO3
AgBr↓ + NaNO3
AgBr + 2 NH3  Ag(NH3)2 Br
Ag(NH3)2 Br
Специфичной реакцией для бромидов является их окисление с помощью хлорамина в кислой среде в присутствии хлороформа. Свободный бром переходит в хлороформный слой и окрашивает его в желто-бурый цвет.

CI2 + 2 NaBr  Br2 + 2NaCI
Br2 + 2NaCI
Йодиды. С раствором серебра нитрата йодиды образуют желтый осадок, нерастворимый в разведенной азотной кислоте и растворе аммиака.
NaI + AgNO3  AgI↓ + NaNO3
AgI↓ + NaNO3
С окислителями йодид-ионы окисляются до свободного йода, который переходит в хлороформный слой, окрашивая его в фиолетовый цвет. В качестве окислителей можно использовать натрия нитрит или железа(III) хлорид.
2NaI + 2NaNO2 + 4HCI  I2 + Na2SO3
I2 + Na2SO3
Хлориды. Для определения хлорид-ионов обычно используется реакция с раствором серебра нитрата. Предварительно подкисленный азотной кислотой раствор, содержащий хлорид-ионы дает белый осадок с раствором серебра нитрата, нерастворимый в азотной кислоте и легко растворимый в растворе аммиака.
NaCI + AgNO3  AgCI↓ + NaNO3
AgCI↓ + NaNO3
AgCI + 2NH3  Ag(NH)2CI
Ag(NH)2CI
Нираты и нитриты. Общей реакцией на нитраты и нитриты является реакция с дифениламином в среде концентрированной серной кислоты.
К раствору, содержащему нитраты или нитриты добавляют 2-3 капли дифениламина в концентрированной серной кислоте – появляется синее окрашивание.

Нитраты восстанавливаются до нитритов в присутствии металлической меди в концентрированной серной кислоте при нагревании, при этом выделяются бурые пары диоксида азота. Упрощенное уравнение реакции можно записать так:
4NaNO3 + 4Cu + 6H2SO4 + O2  4NO2↑ + 4CuSO4 +6 H2O +2 Na2SO4
4NO2↑ + 4CuSO4 +6 H2O +2 Na2SO4
Нитриты разлагаются с выделением диоксида азота бурого цвета при подкислении серной кислотой.
2NaNO2 + H2SO4  Na2SO4 +NO↑ +NO2↑ + H2O
Na2SO4 +NO↑ +NO2↑ + H2O
2NO + O2  2NO2↑
2NO2↑
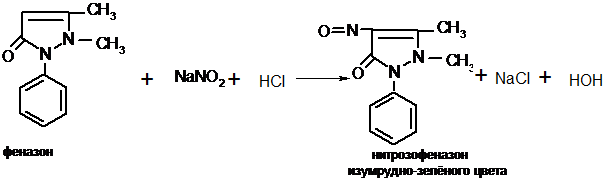
Для отличия нитритов от нитратов используют реакцию с феназоном. Для этого к подкисленному разведенной кислотой раствору феназона добавляют несколько кристалликов вещества, содержащего нитрит-ионы – появляется зеленое окрашивание.
Сульфаты. Для определения сульфатов используется реакция образования белого осадка сульфата бария.
Na2SO4 + BaCI2  BaSO4↓ +2NaCI
BaSO4↓ +2NaCI
Cульфиты. Сульфиты разлагаются под действием минеральных кислот с выделением диоксида серы, имеющего характерный запах
Na2SO3 + 2HCI  2NaCI + SO2↑ + H2O
2NaCI + SO2↑ + H2O
C бария хлоридом сульфиты образуют белый осадок, но растворимый в разведенной хлористоводородной кислоте.
Na2SO3 + BaCI2  BaSO3↓ + 2 NaCI
BaSO3↓ + 2 NaCI
BaSO3 + 2HCI  BaCI2 + SO2 + H2O
BaCI2 + SO2 + H2O
Сульфиты обладают восстановительными свойствами, поэтому обесцвечивают раствор йода.
Na2SO3 +I2 + H2O  Na2SO4 + 2HI
Na2SO4 + 2HI
Фосфаты. Для определения фосфатов можно использовать несколько реакций.
С раствором серебра нитрата в нейтральной среде фосфаты образуют желтый осадок, растворимый в азотной кислоте и в растворе аммиака.
Na2HPO4 + AgNO3  Ag3PO4↓ + 2 NaNO3 + HNO3
Ag3PO4↓ + 2 NaNO3 + HNO3
Ag3PO4 + 6NH3  [ Ag(NH3)2 ]3PO4
[ Ag(NH3)2 ]3PO4
С раствором соли магния в присутствии аммония хлорида и аммиака, фосфаты образуют белый осадок, растворимый в разведенных минеральных кислотах.
NH4Ci
Na2HPO4 + NH3 + MgSO4  MgNH4PO4↓ + Na2SO4
MgNH4PO4↓ + Na2SO4
Хлорид аммония здесь используется для предотвращения образования магния гидроксида, который искажает результат реакции.
С раствором аммония молибдата в азотной кислоте образуется желтый осадок, растворимый в растворе аммиака.
Na2HPO4+12(NH4)2MoO4+23HNO3  (NH4)3[P(Mo3O10)4]·H2O↓ +21NH4NO3 + 2NaNO3+11H2O.
(NH4)3[P(Mo3O10)4]·H2O↓ +21NH4NO3 + 2NaNO3+11H2O.




 AgBr↓ + NaNO3
AgBr↓ + NaNO3
 Br2 + 2NaCI
Br2 + 2NaCI

 BaSO4↓ +2NaCI
BaSO4↓ +2NaCI (NH4)3[P(Mo3O10)4]·H2O↓ +21NH4NO3 + 2NaNO3+11H2O.
(NH4)3[P(Mo3O10)4]·H2O↓ +21NH4NO3 + 2NaNO3+11H2O.


