Вычисление результатов весовых анализов сводится к формуле
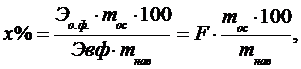 где
где
Эо.ф. – эквивалент осаждаемой формы;
Эв.ф. – эквивалент весовой формы;
mос - масса осадка (г); mнав. - масса навески в (г).
Примеры:
1). Определить содержание бария в 0,4765 г BaSO4.
Решение:
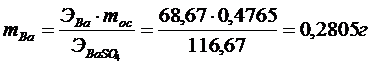
Ответ: 0,2805 г.
2).Сколько процентов алюминия в сплаве, если из 0,4524 г сплава было получено 0,0984 г осадка Al2O3?
Решение:
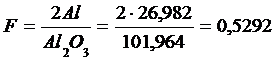
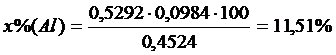
Ответ: 11,51%.
1. Для анализа хлорида бария взяли навеску 0,6878 г. Из неё получили осадок BaSO4 0,6556 г. Сколько процентов бария в образце?
2. Взяли навеску 1,0150 г каменного угля. После обработки её получили осадок BaSO4 0,2895 г. Сколько процентов серы в образце?
3. Взяли навеску 0,3212 г серной кислоты. После осаждения и прокаливания получили осадок BaSO4 0,2642 г. Определить процентную концентрацию серной кислоты.
4. Из навески пирита 0,2794 г после обработки получилим 0,4524 г осадка BaSO4. Сколько процентов серы в образце?
5. Из навески мрамора 1,8710 г получили осадок 1,9650 г CaSO4. Сколько процентов кальция в образце?
6. Из навески мрамора 1,8710 г получили осадок 0,0827 г Mg2P2O7. Сколько процентов магния в образце?
7. Из навески магнезита 2,4110 г получили 2,1710 г прокаленного осадка Mg2P2O7. Сколько процентов магния в образце?
8. Из навески суперфосфата 1,4010 г получили 0,1932 г прокаленного осадка CaO. Сколько процентов кальция в образце?
9. Сколько процентов Al2(SO4)3 в образце технического сульфата алюминия, если из навески 0,5278 г получили 0,1552 г осадка Al2O3.
10. Из навески криолита 0,5872 г образовалось 0,1060 г осадка Al2O3. Сколько процентов Na3AlF6 в образце?
11. Из FeCO3 после обработки получили 1,0000 г Fe2O3. Сколько процентов железа содержал образец, если навеска была 1,5200 г?
12. Для анализа магнитного железняка взяли навеску 0,6012 г. Железняк превратили в Fe2O3 массой 0,4520 г. Сколько процентов Fe3O4 в образце?
13. Из 0,3006 г технического сульфата кадмия после обработки получили 0,1986 г осадка Cd2P2O7. Сколько процентов кадмия в образце?
14. При анализе латуни из её навески 0,6500 г получили 0,0030 г осадка PbSO4. Сколько процентов свинца в образце?
15. При анализе латуни из её навески 0,6500 г получили 0,5200 г осадка ZnNH4PO4. Сколько процентов цинка в образце?
ПРИЛОЖЕНИЯ
Таблица 1
Плотность растворов кислот и щелочей при 200 С, г/см3
| №
| Массовая доля, %
| H2SO4
| HNO3
| HCl
| KOH
| NaOH
| NH3
|
|
|
|
|
|
|
|
|
|
| 1.
|
| 1,013
| 1,011
| 1,009
| 1,016
| 1,023
| 0,992
|
| 2.
|
| 1,027
| 1,022
| 1,019
| 1,033
| 1,046
| 0,983
|
| 3.
|
| 1,040
| 1,033
| 1,029
| 1,048
| 1,068
| 0,973
|
| 4.
|
| 1,055
| 1,044
| 1,039
| 1,065
| 1,092
| 0,967
|
| 5.
|
| 1,069
| 1,056
| 1,049
| 1,082
| 1,115
| 0,960
|
| 6.
|
| 1,083
| 1,068
| 1,059
| 1,100
| 1,137
| 0,953
|
| 7.
|
| 1,098
| 1,080
| 1,069
| 1,118
| 1,159
| 0,946
|
| 8.
|
| 1,112
| 1,093
| 1,079
| 1,137
| 1,181
| 0,939
|
| 9.
|
| 1,127
| 1,106
| 1,083
| 1,156
| 1,213
| 0,932
|
| 10.
|
| 1,143
| 1,119
| 1,100
| 1,176
| 1,225
| 0,926
|
| 11.
|
| 1,158
| 1,132
| 1,110
| 1,196
| 1,247
| 0,919
|
| 12.
|
| 1,174
| 1,145
| 1,121
| 1,217
| 1,268
| 0,913
|
| 13.
|
| 1,190
| 1,150
| 1,132
| 1,240
| 1,289
| 0,908
|
| 14.
|
| 1,205
| 1,171
| 1,142
| 1,263
| 1,310
| 0,903
|
| 15.
|
| 1,224
| 1,184
| 1,152
| 1,286
| 1,332
| 0,898
|
| 16.
|
| 1,238
| 1,198
| 1,163
| 1,310
| 1,352
| 0,893
|
| 17.
|
| 1,255
| 1,211
| 1,173
| 1,334
| 1,374
| 0,889
|
| 18.
|
| 1,273
| 1,225
| 1,183
| 1,358
| 1,395
| 0,884
|
| 19.
|
| 1,290
| 1,238
| 1,194
| 1,384
| 1,416
|
|
| 20.
|
| 1,307
| 1,251
|
| 1,411
| 1,437
|
|
| 21.
|
| 1,324
| 1,264
|
| 1,437
| 1,458
|
|
| 22.
|
| 1,342
| 1,277
|
| 1,460
| 1,478
|
|
| 23.
|
| 1,361
| 1,290
|
| 1,485
| 1,499
|
|
| 24.
|
| 1,380
| 1,303
|
| 1,511
| 1,519
|
|
| 25.
|
| 1,399
| 1,316
|
| 1,538
| 1,540
|
|
| 26.
|
| 1,419
| 1,328
|
| 1,564
| 1,560
|
|
| 27.
|
| 1,439
| 1,340
|
| 1,590
| 1,580
|
|
| 28.
|
| 1,460
| 1,351
|
| 1,616
| 1,601
|
|
| 29.
|
| 1,482
| 1,362
|
|
| 1,622
|
|
| 30.
|
| 1,503
| 1,373
|
|
| 1,643
|
|
| 31.
|
| 1,525
| 1,384
|
|
|
|
|
| 32.
|
| 1,547
| 1,394
|
|
|
|
|
| 33.
|
| 1,571
| 1,403
|
|
|
|
|
| 34.
|
| 1,594
| 1,412
|
|
|
|
|
| 35.
|
| 1,617
| 1,421
|
|
|
|
|
| 36.
|
| 1,640
| 1,429
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 37.
|
| 1,664
| 1,437
|
|
|
|
|
| 38.
|
| 1,687
| 1,445
|
|
|
|
|
| 39.
|
| 1,710
| 1, 453
|
|
|
|
|
| 40.
|
| 1,732
| 1,460
|
|
|
|
|
| 41.
|
| 1,755
| 1,467
|
|
|
|
|
| 42.
|
| 1,776
| 1,474
|
|
|
|
|
| 43.
|
| 1,808
| 1,486
|
|
|
|
|
| 44.
|
| 1,819
| 1,491
|
|
|
|
|
| 45.
|
| 1,830
| 1,496
|
|
|
|
|
| 46.
|
| 1,837
| 1,500
|
|
|
|
|
| 47.
|
| 1,841
| 1,510
|
|
|
|
|
| 48.
|
| 1,838
| 1,522
|
|
|
|
|
Таблица 2
Константы диссоциации слабых электролитов
в водных растворах при 25 0С
| №
| Электролит
| Формула
| К
| рК = -lg K
|
|
| Азотистая кислота
| HNO2
| 5,4·10-4
| 3,40
|
|
| Гидроксид аммония
| NH4OH
| 1,8·10-5
| 4,75
|
|
| Муравьиная кислота
| HCOOH
| 1,8·10-4
| 3,74
|
|
| Сернистая кислота
| H2SO3
| К1 = 1,4·10-2 K2=6,2∙10-8
| 1,80 7,20
|
|
| Сероводородная кислота
| H2S
| К1= 1·10-7 K2=2,5·10-13
| 6,99 12,6
|
|
| Угольная кислота
| H2CO3
| К1= 4,5·10-7 К2= 4,7·10-11
| 6,35 10,33
|
|
| Уксусная кислота
| CH3COOH
| 1,74·10-5
| 4,76
|
|
| Фосфорная кислота (орто)
| H3PO4
| К1= 7,5·10-3 К2= 6,3·10-8 К3= 5·10-13
| 2,12 7,20 12,00
|
|
| Фтористоводородная кислота
| HF
| 6,2·10-4
| 3,21
|
|
| Щавелевая кислота
| H2C2O4
| К1= 5,4·10-2 К2= 5,4·10-5
| 1,27 4,27
|
|
| Борная кислота (орто)
| H3BO3
| К1= 7,1·10-10
К2= 1,8·10-13
К3= 1,6·10-14
| 9,15
12,74
13,80
|
|
| Цианистоводородная
| HCN
| K1=7,9·10-7
| 9,1
|
|
| Мышьяковая кислота (орто)
| H3AsO4
| K1=5,6·10-3
K2=1,7·10-7
K3=2,95·10-12
| 2,25
6,77
11,53
|
|
| Хлорноватистая кислота
| HOCl
| K1=5·10-8
| 7,3
|
|
| Фенол
| C6H5OH
| K1=1,4·10-10
| 9,85
|
|
| Малеиновая
| C2H2(COOH)2
| K1=1,2·10-2
K2=6,0·10-7
| 1,92
6,22
|
|
| Малоновая
| CH2(COOH)2
| K1=1,4·10-3
K2=2,2·10-6
| 2,85
5,66
|
Таблица 3
Константы диссоциации некоторых оснований
при 25 0С
| Гидроксиды
| Формула
| К1
| К2
| К3
| рК=(-lg K)
|
| Алюминия
| Al(OH)3
| -
| -
| 1,38·10-9
| 8,86
|
| Аммония
| NH4OH
| 1,79·10-5
| -
| -
| 4,75
|
| Галлия
| Ga(OH)3
| -
| 1,6·10-11
| 4·10-12
| 10,80
11,40
|
| Железа (II)
| Fe(OH)2
| -
| 1,3·10-4
| -
| 3,89
|
| Железа (III)
| Fe(OH)3
| -
| 1,8·10-11
| 1,3·10-12
| 10,74
11,87
|
| Кадмия
| Cd(OH)2
| -
| 5·10-3
| -
| 2,3
|
| Кобальта
| Co(OH)2
| -
| 4·10-5
| -
| 4,40
|
| Магния
| Mg(OH)2
| -
| 2,5·10-3
| -
| 2,60
|
| Марганца
| Mn(OH)2
| -
| 5·10-4
| -
| 3,30
|
| Меди
| Cu(OH)2
| -
| 3,4·10-7
| -
| 6,47
|
| Никеля
| Ni(OH)2
| -
| 2,5·10-5
| -
| 4,60
|
| Свинца
| Pb(OH)2
| 9,6·10-4
| 3·10-8
| -
| 3,02
2,30
|
| Хрома
| Cr(OH)3
| -
| -
| 1,1·10-10
| 9,9
|
| Цинка
| Zn(OH)2
| 4,4·10-5
| 1,5·10-9
| -
| 4,35; 8,82
|
| Гидроксиламин
| NH2OH·H2O
| 9,33·10-9
|
|
| 8,03
|
| Гидразин
| NH2NH2
| 1,0·10-6
|
|
|
|
| Пиридин
| C5H5N
| 1,5·10-9
|
|
| 8,82
|
| Этаноламин
| HOCH2 · CH2NH2
| 2,8·10-5
|
|
| 4,55
|
Таблица 4
Области перехода важнейших рН-индикаторов
| Индикатор
| Растворитель
| Концентрация, %
| Характер индикатора
| Окраска
| Область перехода рН
|
| кислотной формы
| щелочной формы
|
| Ализариновый желтый
| Вода
| 0,1
| Кисл.
| Желтая
| Фиолетовая
| 10,1-12,0
|
| Тимолфталеин
| 90%-ный спирт
| 0,1
| Кисл.
| Бесцветная
| Синяя
| 9,3-10,5
|
| Фенолфталеин
| 60%-ный спирт
| 0,1 и 1,0
| Кисл.
| Бесцветная
| Красная
| 8,0-10,0
|
| Крезоловый пурпурный
| 20%-ный спирт
| 0,05
| Кисл.
| Желтая
| Пурпурная
| 7,4-9,0
|
| Нейтральный красный
| 60%-ный спирт
| 0,1
| Основн.
| Красная
| Желто-коричневая
| 6,8-8,0
|
| Феноловый красный
| 20%-ный спирт
| 0,1
| Кисл.
| Желтая
| Красная
| 6,4-8,0
|
| Бромтимоловый синий
| 20%-ный спирт
| 0,05
| Кисл.
| Желтая
| Синяя
| 6,0-7,6
|
| Лакмус (азолитмин)
| Вода
| 1,0
| Кисл.
| Красная
| Синяя
| 5,0-8,0
|
| Метиловый красный
| 60%-ный спирт
| 0,1 и 0,2
| Основн.
| Красная
| Желтая
| 4,2-6,2
|
| Метиловый оранжевый
| Вода
| 0,1
| Основн.
| Розовая
| Желтая
| 3,1-4,4
|
| Бромфениловый синий
| Вода
| 0,1
| Кисл.
| Желтая
| Синяя
| 3,0-4,6
|
| Тропеолин 00
| Вода
| 0,01; 0,1 и 1,0
| Основн.
| Красная
| Желтая
| 1,4-3,2
|
| Кристаллический фиолетовый
| Вода
| -
|
| Зеленая
| Фиолетовая
| 0,0-2,0
|
Таблица 6
Области перехода и φо некоторых ОВ индикаторов
|
Индикатор
|
φоInd, B
| Окраска индикатора
|
| окисленная форма
| Восс форма
|
| Нитро- о -фенантролин+FeSO4
| 1,25
| Бледно-голубая → красная
|
| 2,2'-Дипиридил (комплекс с Fe2+)
| 1,14 (кислая среда)
| Бледно-голубая → красная
|
| Фенилантраниловая кислота
| 1,08 (1 М р-р H2SO4)
| Красно-фиолетовая → бесцветная
|
| о -Фенантролин+FeSO4 (ферроин)
| 1,06 (1 М р-р H2SO4)
| Бледно-голубая → красная
|
| 5,6-Диметил-1,10-фенантролин (комплекс с Fe2+)
| 0,97
| Желто-зеленая → красная
|
| Дифениламин-4-сульфонат бария или натрия
| 0,84 (кислая среда)
| Красно-фиолетовая → бесцветная
|
| Дифениламин
| 0,76 (кислая среда)
| Фиолетово-синяя → бесцветная
|
| N,N' - Дифенилбензидин
| 0,76 (кислая среда)
| Фиолетовая → бесцветная
|
| Индиго-5,5'-дисульфонат натрия
| 0,29 (рН=0)
| Синяя → желтая
|
| 2,6-Дибромфенол-индофенолят натрия
| 0,218 (рН=7)
| Фиолетовая → бесцветная
|
| 2,6-Дихлорфенол-индо- о -крезолят натрия
| 0,181 (рН=7)
| Фиолетовая → бесцветная
|
| Тионин
| 0,06 (рН=7)
| Фиолетовая → бесцветная
|
| Метиленовый голубой
| 0,011 (рН=7)
| Синяя → бесцветная
|
| Индиго-5,5'; 7,7'- тетрасульфонат калия
| -0,046 (рН=7)
| Синяя → бесцветная
|
| Индиго-5-сульфоат калия
| -0,160 (рН=7)
| Синяя → бесцветная
|
| Сафранин T
| -0,289 (рН=7)
| Коричневая → бесцветная
|
| Нейтральный красный
| -0,33 (рН=7)
| Красно-фиолетовая → бесцветная
|
| Метилвиологен дихлорид
| -0,446 (рН=8÷12)
| Бесцветная → темно-синяя
|
Таблица 7
Константы нестойкости комплексных ионов
| Комплекс
| оС
| К
| Комплекс
| оС
| К
|
| Комплексы с аммиаком
|
| [Ag(NH3)2]+
|
| 9,3·10-8
| [Cu(NH3)2]2+
|
| 2,24·10-8
|
| [Co(NH3)6]2+
|
| 7,75·10-6
| [Cu(NH3)]2+
|
| 7,1·10-5
|
| [Co(NH3)6]3+
|
| 3,1·10-33
| [Hg(NH3)4]2+
|
| 5,3·10-20
|
| [Cu(NH3)4]2+
|
| 2,14·10-13
| [Mg(NH3)6]2+
|
| 2,1·10-13
|
| [Cu(NH3)3]2+
|
| 2,89·10-11
| [Ni(NH3)4]2+
|
| 1,12·10-8
|
| [Zn(NH3)3]2+
|
| 3,5·10-10
| [Ni(NH3)6]2+
|
| 1,86·10-9
|
| Бромидные комплексы
|
| [AgBr2]-
|
| 7,8·10-8
| [HgBr4]2-
|
| 2·10-22
|
| [AgBr3]2-
|
| 1,3·10-9
| [PbBr4]2-
|
| 1·10-3
|
| [CuBr2]-
|
| 1,3·10-6
| [ZnBr3]-
|
|
|
| Йодидные комплексы
|
| [AgI4]3-
|
| 1,8·10-14
| [HgI4]2-
|
| 1,5·10-30
|
| [BiI6]3-
|
| 3,1·10-12
| [PbI4]2-
|
| 1,4·10-4
|
| Роданидные комплексы
|
| [Ag(SCN)2]-
|
| 2,7·10-8
| [Hg(SCN)4]2-
|
| 5,9·10-22
|
| [Ag(SCN)4]3-
|
| 8,3·10-11
| [Ni (SCN)3]-
|
| 1,5·10-2
|
| Тиосульфатные комплексы
|
| [Ag(S2O3)2]3-
|
| 2,5·10-14
| [Hg(S2O3)2]2-
|
| 3,6·10-30
|
| [Cu(S2O3)2]3-
|
| 6,0·10-13
| [Hg(S2O3)3]4-
|
| 1,3·10-32
|
|
|
|
| [Hg(S2O3)4]6-
|
| 5,8·10-34
|
| Хлоридные комплексы
|
| [AgCl2]-
|
| 1,76·10-5
| [CuCl3]2-
|
| 5,0·10-6
|
| [AgCl4]3-
|
| 1,2·10-6
| [HgCl3]2-
|
| 8,5·10-15
|
| [BiCl6]3-
|
| 3,8·10-7
| [PbCl4]2-
|
| 7,1·10-3
|
| [PtCl4]2-
|
| 1,8·10-16
| [HgCl4]2-
|
| 8,5·10-16
|
| Цианидные комплексы
|
| [Ag(CN)2]-
|
| 8·10-22
| [Hg(CN)4]2-
|
| 4,0·10-42
|
| [Fe(CN)6]4-
|
| 1,0·10-24
| [Ni(CN)4]2-
|
| 1,8·10-14
|
| [Fe(CN)6]3-
|
| 1,0·10-31
| [Zn(CN)4]2-
|
| 1,3·10-17
|
| [Cu(CN)4]2-
|
| 5·10-28
|
|
|
|
| Гидроксокомплексы
|
| [Al(OH)4]-
|
| 1·10-33
| [Cu(OH)4]2-
|
| 7,6·10-17
|
| [Cr(OH)4]-
|
| 1,02·10-30
| [Zn(OH)4]2-
|
| 3,6·10-16
|
Таблица 8
Произведение растворимости некоторых
малорастворимых электролитов при 25 оС
| Электролит
|
| Электролит
|
| Электролит
|
|
| AgBr
| 5,3·10-13
| CaSO4
| 2,5·10-5
| MnS
| 2,5·10-10
|
| Ag2CO3
| 8,2·10-12
| Ca3(PO4)2
| 1,0·10-29
| Ni(OH)2
| 6,3·10-18
|
| AgCl
| 1,8·10-10
| CdS
| 1,6·10-28
| PbBr2
| 9,1·10-6
|
| Ag2CrO4
| 1,1·10-12
| CoCO3
| 1,5·10-10
| PbCO3
| 7,5·10-14
|
| AgI
| 8,3·10-17
| Co(OH)2
| 2·10-16
| PbCl2
| 1,56·10-5
|
| Ag2S
| 5,3·10-50
| CrPO4
| 2,4·10-23
| PbF2
| 2,7·10-8
|
| Ag2SO4
| 1,6·10-5
| CuCO3
| 2,5·10-10
| PbI2
| 1,1·10-9
|
| Ag3PO4
| 1,3·10-20
| Cu(OH)2
| 1,6·10-19
| PbS
| 2,5·10-27
|
| Al(OH)3
| 5·10-33
| CuS
| 6,3·10-36
| PbSO4
| 1,6·10-8
|
| AlPO4
| 5,7·10-19
| Fe(OH)2
| 8·10-16
| Pb3(PO4)2
| 7,9·10-43
|
| BaCO3
| 5,1·10-9
| Fe(OH)3
| 6,3·10-38
| Sb2S3
| 1,6·10-93
|
| BaCrO4
| 1,2·10-10
| FePO4
| 1,3·10-22
| SrCO3
| 1,1·10-10
|
| BaSO4
| 11·10-10
| FeS
| 5·10-18
| SrCrO4
| 3,6·10-5
|
| Ba3(PO4)2
| 6,0·10-39
| HgS
| 1,6·10-52
| SrF2
| 2,5·10-9
|
| BeCO3
| 1·10-3
| MgCO3
| 2,1·10-5
| SrSO4
| 3,2·10-7
|
| CaCO3
| 4,8·10-9
| Mg(OH)2
| 6·10-10
| ZnCO3
| 1,4·10-14
|
| CaF2
| 4,0·10-11
| Mg3(PO4)2
| 1·10-13
| Zn(OH)2
| 1·10-17
|
| CaHPO4
| 2,7·10-7
| MnCO3
| 1,8·10-11
| α-ZnS
| 1,6·10-24
|
| Ca(H2PO4)2
| 1·10-3
| Mn(OH)2
| 1,9·10-13
| Zn3(PO4)2
| 9,1·10-33
|
Таблица 9
Аналитические и стехиометрические множители (факторы)
| Определяют
| Взвешено
| Множитель, f
| Lg f
|
|
|
|
|
|
| Ag
| AgBr
| 0,5745
| 75 925
|
|
| AgCl
| 0,7526
| 87 658
|
|
| AgI
| 0,4595
| 66 229
|
| Al
| Al(C9H6ON)3 (оксихинолят)
| 0,05872
| 76 876
|
|
| Al2O3
| 0,5292
| 72 370
|
|
| AlPO4
| 0,2212
| 34 479
|
| Ba
| BaCrO4
| 0,5421
| 73 410
|
|
| BaSO4
| 0,5884
| 76 967
|
| BaCl2
| BaSO4
| 0,8923
| 95 049
|
| BaCl2·2H2O
| BaSO4
| 1,0466
| 01 978
|
| CO2
| CaCO3
| 0,4397
| 64 317
|
| CO3
| BaCO3
| 0,3041
| 48 295
|
| CaCO3
| CO2
| 2,274
| 35 683
|
|
| CaO
| 1,785
| 25 158
|
| Cd
| Cd(C7H6O2N)2 (антранилат)
| 0,2922
| 46 568
|
|
| Сd(C9H6ON)3 (оксихинолят)
| 0,2805
| 44 796
|
| Cu
| Cu(C10H6O2N)2 (хинальдинат)
| 0,1492
| 17 377
|
|
| (C13H9N)2HCdI4 (β-нафтохинолин)
| 0,1149
| 06 025
|
| Cd
| CdO
| 0,8754
| 94 220
|
|
| Cd2P2O7
| 0,5638
| 75 110
|
| Cl
| AgCl
| 0,2474
| 39 334
|
| ClO3
| AgCl
| 0,5822
| 76 510
|
| Co
| Co2P2O7
| 0,4039
| 60 631
|
| Cr
| BaCrO4
| 0,2053
| 31 233
|
| Cu
| CuO
| 0,7989
| 90 246
|
| Cu
| Cu(C5H5N)2(CNS)2 (..-пиридин-..)
| 0,1880
| 27 439
|
| Cu
| Cu(C9H6ON)2 (оксихинолят)
| 0,1806
| 25 668
|
| Cu
| CuC14H11O2N (купронат)
| 0,2200
| 34 246
|
| Mo
| PbMoO4
| 0,2613
| 41 719
|
| Ni
| NiC8H14N4O4 (диметилглиоксимат)
| 0,2032
| 30 790
|
| P
| Mg2P2O7
| 0,2783
| 44 453
|
| P
| (NH4)3PO4·12MoO3
| 0,01651
| 21 775
|
| P
| P2O5·24MoO3
| 0,01722
| 23 613
|
| SO4
| BaSO4
| 0,4115
| 61 441
|
| Sn
| SnO2
| 0,7877
| 89 634
|
| Sr
| SrC2O4·H2O
| 0,4525
| 65 559
|
| Sr
| SrO
| 0,8456
| 92 716
|
| Sr
| SrSO4
| 0,4770
| 67 854
|
| Zn
| Zn(C7H6O2N)2 (антранилат)
| 0,1936
| 28 698
|
| Zn
| Zn(C9H6ON)2 (оксихинолят)
| 0,1848
| 26 681
|
| Zn
| Zn[Hg(CNS)4]
| 0,1312
| 11 792
|
| Zn
| ZnO
| 0,8034
| 90 493
|
| Zn
| Zn2P2O7
| 0,4291
| 63 257
|
Если g – навеска вещества, взятого для анализа, α – вес высушенного для прокаленного осадка и f – множитель, найденный в данной таблице, то процентное содержание искомого вещества находят по формуле
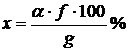 ;
; 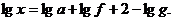
где a и g выражены в одинаковых единицах.
Вычисления надо производить, отбрасывая характеристики логарифмов и оставляя только их мантиссы. Тогда каждый расчет сводится к сложению трех чисел: 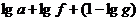 .
.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК.
1. Основы аналитической химии. /Под редакцией Золотова Ю.А. – М.: Высшая школа, 1999 – кн.1.2.
2. Аналитическая химия. Гравиметрический и титрометрический методы анализа. Том 1 – Васильев В.П. – М.: Высшая школа, 1989.
3. Основы аналитической химии. Количественный анализ. Крешков А.Н. Том 2.-М.: Химия. 1986.
4. Количественный анализ. Алексеев В.Н./Под редакцией док. Хим. наук Агасяна П.К. – М.: Химия, 1972.
5. Теоретические основы аналитической химии. Янсон Э.Ю. – М.: Высшая школа, 1987.
6. Химический анализ. Лайтинен Г.А., Харрис В.Е. – М.: Химия, 1979.
7. Сборник вопросов и задач по аналитической химии./Под ред. Проф. Васильева В.П. – М.: Высшая школа, 1976.
8. Справочник по аналитической химии. Лурье Ю.Ю. – М.: Химия, 1979.
9. Задачник по количественному анализу. /Под редакцией Мусакина А.П. – Л.: Химия, 1972.
10. Задачник по количественному анализу. Толстоусов В.Н., Эфрос С.М. – Л.: Химия, 1986.
11. Аналитическая химия. Кн. 1 и 2. Количественный анализ. Физико-химические методы анализа. Харитонов Ю.Я. – М.: Высшая школа, 2001.
12. Основы аналитической химии. Практическое руководство. Фадеева В.И. /Под редакцией Золотова Ю.А. – М.: Всшая школа, 2001.
13. Основы аналитической химии 1. Скут Д., Уэст Д. – М.: Мир, 1979.
СОДЕРЖАНИЕ
Введение__________________________________________________1
1. Метод кислотно-основного титрования.___________________________6
Расчеты в методе кислотно-основного титрования._________________7
Лабораторные работы. Метод кислотно-основного титрования._______8
Задачи и примеры решений.____________________________________20
2. Методы редоксиметрии (перманганатометрия и иодометрия).________30
Метод перманганатометрии.____________________________________34
Лабораторные работы. Метод перманганатометрии.________________36
Задачи и примеры решений._____________________________________45
Варианты домашних заданий.___________________________________72
3. Метод комплексонометрии._____________________________________73
Лабораторные работы. Метод комплексонометрии._________________76
Задачи и примеры решений._____________________________________80
Варианты домашних заданий.___________________________________86
4. Метод гравиметрии.____________________________________________87
Лабораторная работа. Метод гравиметрии.________________________88
Задачи и примеры решений._____________________________________91
5. Приложение__________________________________________________97
6. Библиографический список____________________________________110



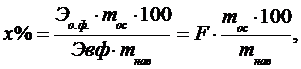 где
где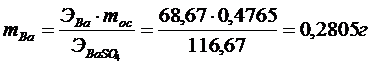
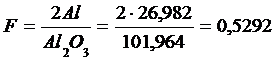
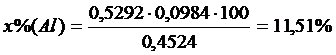
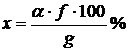 ;
; 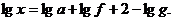
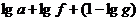 .
.

