При любой температуре частицы жидкости переходят со свободной поверхности жидкости в паровую фазу. Этот процесс называется испарением.наряду с процессом испарения происх и конденсация. Если скорость испарения равна скорости обратного процесса — конденсации, то жидкость в закрытой системе находится в равновесии со своим насыщенным паром. Давление насыщенного пара не зависит от количества жидкости, а зависит только от ее природы и температуры. Чем слабее межчастичные взаимодействия в жидкости (т. е. чем более летучей она является), тем выше давление насыщенного пара и тем более легко и при более низкой температуре она начнет кипеть.
Относительное понижение давления насыщенного пара растворителя над раствором (Iзакон Рауля): « относительное понижение давления насыщенного пара растворителя над раствором нелетучего неэлектролита равно мольной доле растворенного вещества в растворе»:  где РАо – давление насыщенного пара над чистым растворителем, Па; РА – давление насыщенного пара над раствором, Па; nВ – число молей растворенного вещества; nА – число молей растворителя.
где РАо – давление насыщенного пара над чистым растворителем, Па; РА – давление насыщенного пара над раствором, Па; nВ – число молей растворенного вещества; nА – число молей растворителя.
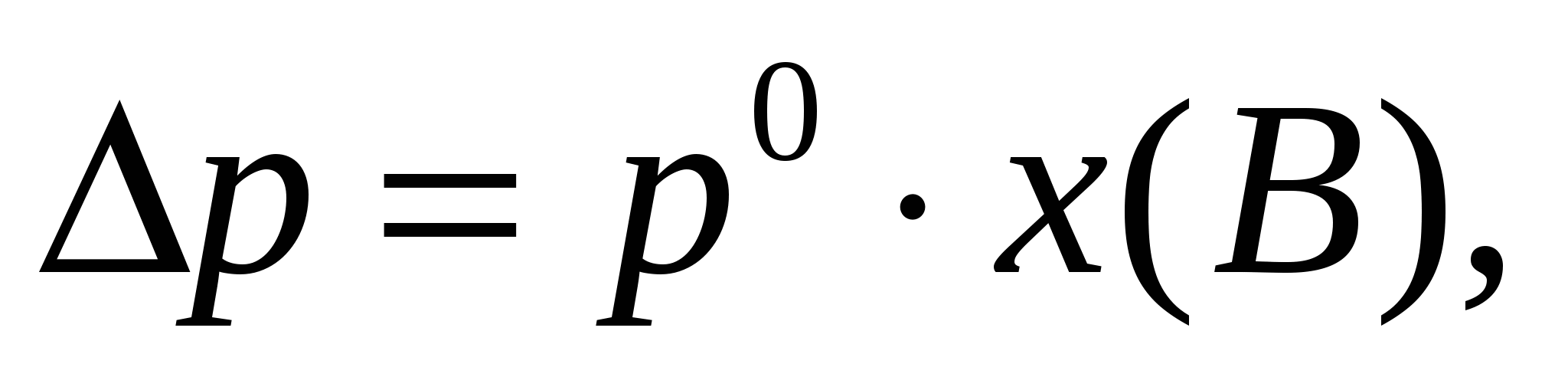 Как видно из уравнения, относительное понижение давления пара для данного раствора не зависят от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора. Причем давление насыщенного пара над чистым растворителем всегда больше, чем давление насыщенного пара над раствором (РАо > РА), это связано с тем, что испарение идет с поверхностного слоя. У чистого растворителя на поверхности находятся только молекулы растворителя, а в растворе в поверхностном слое находятся еще и молекулы растворенного вещества, понижая содержание молекул растворителя; также растворенные частицы сольватированы (гидратированы), что затрудняет переход молекул растворителя в пар. Или Дельта р – относительное понижение давления пара над р-ром р0- давление насыщенного пара над чистым растворителем, Па; р – давление насыщенного пара над раствором неэлектролита, Па; х(В) – молярная доля неэлектролита в растворе;
Как видно из уравнения, относительное понижение давления пара для данного раствора не зависят от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора. Причем давление насыщенного пара над чистым растворителем всегда больше, чем давление насыщенного пара над раствором (РАо > РА), это связано с тем, что испарение идет с поверхностного слоя. У чистого растворителя на поверхности находятся только молекулы растворителя, а в растворе в поверхностном слое находятся еще и молекулы растворенного вещества, понижая содержание молекул растворителя; также растворенные частицы сольватированы (гидратированы), что затрудняет переход молекул растворителя в пар. Или Дельта р – относительное понижение давления пара над р-ром р0- давление насыщенного пара над чистым растворителем, Па; р – давление насыщенного пара над раствором неэлектролита, Па; х(В) – молярная доля неэлектролита в растворе;
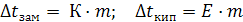 Математическое выражение второго закона Рауля имеет вид: (8.3) где К – криоскопическая константа, град/моль, Е − эбулиоскопическая константа, град/моль m – моляльная концентрация растворенного вещества. Согласно второму закону Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально моляльной концентрации неэлектролита и не зависит от его природы.
Математическое выражение второго закона Рауля имеет вид: (8.3) где К – криоскопическая константа, град/моль, Е − эбулиоскопическая константа, град/моль m – моляльная концентрация растворенного вещества. Согласно второму закону Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально моляльной концентрации неэлектролита и не зависит от его природы.
Первый и второй законы Рауля справедливы для разбавленных растворов неэлектролитов. В случае электролитов число частиц в растворе за счет электролитической диссоциации резко возрастает и в расчетные формулы следует вводить поправки. Если n – число ионов, образующихся из одной молекулы в растворе электролита, N – число молекул растворенного вещества, то общее число частиц в растворе составляет:
, если  ,где i – изотонический коэффициент, коэффициент Вант – Гоффа. Таким образом в случае растворов электролитов уравнение второго закона Рауля имеет вид:
,где i – изотонический коэффициент, коэффициент Вант – Гоффа. Таким образом в случае растворов электролитов уравнение второго закона Рауля имеет вид:  ;(8.9)
;(8.9)  Отсюда
Отсюда  ; (8.10)
; (8.10) 
Криоскопическая постоянная показывает абсолютное понижение температуры замерзания раствора неэлектролита, который в одном кг растворителя содержит один моль растворенного вещества. Для воды Ек = 1,86 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды замерзает при температуре -1,86 оС.
Эбулиоскопическая постоянная показывает абсолютное повышение температуры кипения раствора неэлектролита, который в одном кг растворителя содержит 1 моль растворенного вещества. Для воды Eэ = 0,52 кгК/моль, следовательно, раствор 1 моля неэлектролита в 1 кг воды кипит при 100,52 оС. Уравнения (7.9) и (7.10) используют для определения молярной массы вещества.
Следствие из закона Рауля. 1) Растворы кипят при более высокой температуре, чем чистый растворитель;
2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
Осмос - преимущественно одностороннее проникновение молекул растворителя (диффузия) через полунепроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией в раствор с большей концентрацией.
Осмотическое давление - величина, измеряемая минимальным гидравлическим давлением, которое нужно приложить к раствору, чтобы осмос прекратился. Его измеряют с помощью приборов, называемых осмометрами. Простейший осмометр состоит из широкого сосуда с растворителем и осмотической ячейки с раствором, дно ячейки затянуто полупроницаемой мембраной. Мембраны способны пропускать частицы растворителя и задерживать частицы растворенного вещества.
В осмометре действуют две противоположно направленные силы: сила осмотического давления, которая способствует всасыванию растворителя внутрь осмометра, и гидростатическое давление столба жидкости в осмометре, которая препятствует, и в конечном счете, прекращает осмотическое всасывание растворителя. В момент равновесия осмотическое давление можно рассчитать по уравнению: p = rh, где r – плотность раствора; h – высота поднятия коллоидного раствора в осмометре.
Закон Вант-Гоффа: Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффиценту пропорциональности и абсолютной температуре Или осмотическое давление растворенного вещества в разбавленном растворе равно тому газовому давлению, которое производило бы это вещество, если бы оно в виде газа при той же температуре, занимало бы тот же объем, что и раствор. закон Вант-Гоффа: pосм= С×R×T, Па R= 8,314 л×кПа/моль×К, Т – температура, К с – молярная концентрация неэлектролита, моль/л
Осмотическое давление зависит от концентрации растворенного вещества и температуры.
Подставим формулу (2) для моляльной концентрации в формулу (1) ⇒ 

Определение молекулярной массы растворенного вещества по повышению температуры кипения раствора называется эбулиоскопией. Определение молекулярной массы растворенного вещества по понижению температуры замерзания раствора называется криоскопией.
 Эбулиоскопия — метод исследования температур кипения растворов. Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т 0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества. Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
Эбулиоскопия — метод исследования температур кипения растворов. Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т 0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества. Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
 , (28)где М 1 — молекулярная масса растворителя, Dисп Н 1 — энтальпия испарения растворителя, m 2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя). Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
, (28)где М 1 — молекулярная масса растворителя, Dисп Н 1 — энтальпия испарения растворителя, m 2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя). Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
Криоскопия – метод исследования температур замерзания (кристаллизации) растворов. Растворы в отличие от чистого растворителя жидкости не отвердевает при одной температуре. При охлаждении растворов наблюдается их замерзание или кристаллизация. Температура замерзания – температура, при которой образуются первые кристаллы твердой фазы. Опыт показывает, что температура замерзания раствора (Т) всегда ниже температуры замерзания чистого растворителя (Т пл). Разность температур замерзания растворителя и раствора называют понижением температуры замерзания раствора. Количественная зависимость понижения температуры замерзания от концентрации раствора выражается следующим уравнением:
 , (29) где М1 — молекулярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
, (29) где М1 — молекулярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
Тогда молекулярная масса растворенного вещества определяется как  ,
,
 где g2- масса растворенного вещества, g1- масса растворителя, К- криоскопическая постоянная. На рис. 8 представлены температурные зависимости давления насыщенного пара над чистыми жидким и твердым растворителем (кривые ОА и ОD), а также давления насыщенного пара над растворами разных составов (кривые ВО ¢ и СО ¢¢) для случая, когда растворенное вещество нелетучее.
где g2- масса растворенного вещества, g1- масса растворителя, К- криоскопическая постоянная. На рис. 8 представлены температурные зависимости давления насыщенного пара над чистыми жидким и твердым растворителем (кривые ОА и ОD), а также давления насыщенного пара над растворами разных составов (кривые ВО ¢ и СО ¢¢) для случая, когда растворенное вещество нелетучее.
Кривые ОА ¢, O ¢ B ¢, O ¢¢ C показывают ход с температурой давления паров над переохлажденным чистым растворителем (ОА ¢) и переохлажденными растворами соответствующих составов (О ¢ B ¢, O ¢¢ C).
Кристаллы растворителя будут находиться в равновесии с раствором, если давления пара растворителя над твердой и жидкой фазами будут равны, т.е. когда кривая ОD пересечет кривые ВВ ¢, CC ¢ при соответствующих температурах T кр¢ и T кр¢¢. Температуры, отвечающие этому условию, будут ниже температуры замерзания чистого растворителя (T пл –температура плавления растворителя).
Понижение точки замерзания и повышение точки кипения растворов, их осмотическое давление не зависят от природы растворенных веществ. Такие свойства растворов называют коллигативными. Эти свойства зависят от природы растворителя и концентрации растворенного вещества. Как правило, коллигативные свойства проявляются, когда в равновесии находятся две фазы, одна из которых содержит растворитель и растворенное вещество, а вторая – только растворитель.
К коллигативным свойствам относится и осмотическое давление, которое по Вант-Гоффу равно для разбавленных и концентрированных растворов соответственно: π=с2RT, π= a 2RT, где с2 и а 2 – крнцентрация и активность растворенного вещества. Осмотическим давлением называют давление, заставляющее переходить растворитель через полунепроницаемую перегородку в раствор, находящийся при том же внешнем давлении, что растворитель. Коллигативные свойства растворов используются для определения молекулярных масс, а при известных молекулярных массах – для определения степени диссоциации и ассоциации этих веществ в растворах, коэффициентов активности растворенных веществ



 где РАо – давление насыщенного пара над чистым растворителем, Па; РА – давление насыщенного пара над раствором, Па; nВ – число молей растворенного вещества; nА – число молей растворителя.
где РАо – давление насыщенного пара над чистым растворителем, Па; РА – давление насыщенного пара над раствором, Па; nВ – число молей растворенного вещества; nА – число молей растворителя.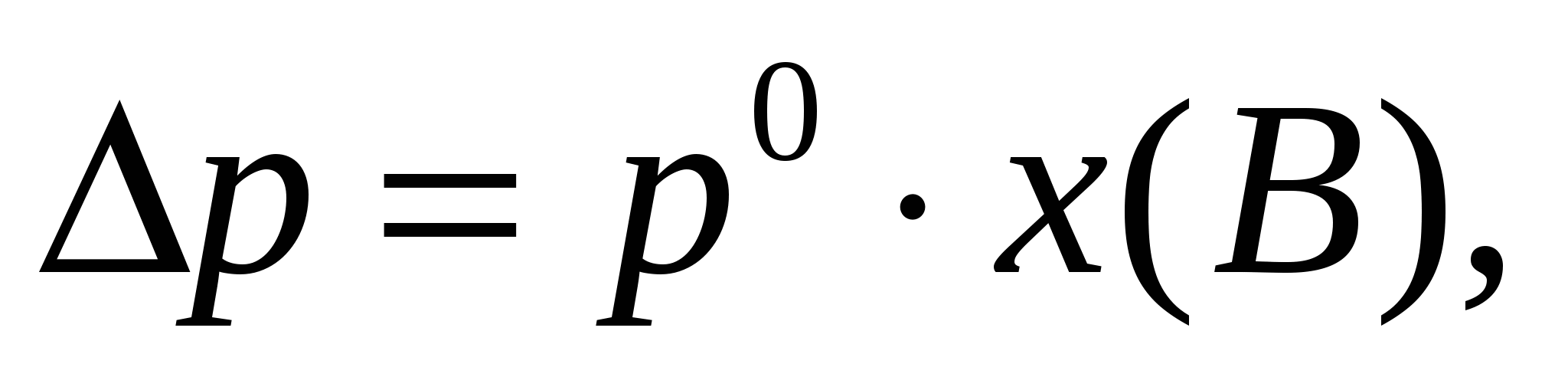 Как видно из уравнения, относительное понижение давления пара для данного раствора не зависят от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора. Причем давление насыщенного пара над чистым растворителем всегда больше, чем давление насыщенного пара над раствором (РАо > РА), это связано с тем, что испарение идет с поверхностного слоя. У чистого растворителя на поверхности находятся только молекулы растворителя, а в растворе в поверхностном слое находятся еще и молекулы растворенного вещества, понижая содержание молекул растворителя; также растворенные частицы сольватированы (гидратированы), что затрудняет переход молекул растворителя в пар. Или Дельта р – относительное понижение давления пара над р-ром р0- давление насыщенного пара над чистым растворителем, Па; р – давление насыщенного пара над раствором неэлектролита, Па; х(В) – молярная доля неэлектролита в растворе;
Как видно из уравнения, относительное понижение давления пара для данного раствора не зависят от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора. Причем давление насыщенного пара над чистым растворителем всегда больше, чем давление насыщенного пара над раствором (РАо > РА), это связано с тем, что испарение идет с поверхностного слоя. У чистого растворителя на поверхности находятся только молекулы растворителя, а в растворе в поверхностном слое находятся еще и молекулы растворенного вещества, понижая содержание молекул растворителя; также растворенные частицы сольватированы (гидратированы), что затрудняет переход молекул растворителя в пар. Или Дельта р – относительное понижение давления пара над р-ром р0- давление насыщенного пара над чистым растворителем, Па; р – давление насыщенного пара над раствором неэлектролита, Па; х(В) – молярная доля неэлектролита в растворе;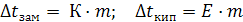 Математическое выражение второго закона Рауля имеет вид: (8.3) где К – криоскопическая константа, град/моль, Е − эбулиоскопическая константа, град/моль m – моляльная концентрация растворенного вещества. Согласно второму закону Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально моляльной концентрации неэлектролита и не зависит от его природы.
Математическое выражение второго закона Рауля имеет вид: (8.3) где К – криоскопическая константа, град/моль, Е − эбулиоскопическая константа, град/моль m – моляльная концентрация растворенного вещества. Согласно второму закону Рауля: понижение температуры замерзания и повышение температуры кипения растворов прямо пропорционально моляльной концентрации неэлектролита и не зависит от его природы. ,где i – изотонический коэффициент, коэффициент Вант – Гоффа. Таким образом в случае растворов электролитов уравнение второго закона Рауля имеет вид:
,где i – изотонический коэффициент, коэффициент Вант – Гоффа. Таким образом в случае растворов электролитов уравнение второго закона Рауля имеет вид:  ;(8.9)
;(8.9)  Отсюда
Отсюда  ; (8.10)
; (8.10) 


 Эбулиоскопия — метод исследования температур кипения растворов. Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т 0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества. Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению
Эбулиоскопия — метод исследования температур кипения растворов. Если растворенное вещество нелетуче, то пар над раствором состоит из молекул растворителя. Такой раствор начинает кипеть при более высокой температуре (Т) по сравнению с температурой кипения чистого растворителя (Т 0). Разность между температурами кипения раствора и чистого растворителя при данном постоянном давлении называется повышением температуры кипения раствора. Эта величина зависит от природы растворителя и концентрации растворенного вещества. Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. При кипении жидкий раствор и пар находятся в равновесии. Можно показать, что в случае, если растворенное вещество нелетуче, повышение температуры кипения раствора подчиняется уравнению , (28)где М 1 — молекулярная масса растворителя, Dисп Н 1 — энтальпия испарения растворителя, m 2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя). Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества.
, (28)где М 1 — молекулярная масса растворителя, Dисп Н 1 — энтальпия испарения растворителя, m 2 — моляльность раствора (количество моль растворенного вещества в расчете на 1 кг растворителя). Е – эбулиоскопическая постоянная, равная повышению температуры кипения одномоляльного раствора по сравнению с температурой кипения чистого растворителя. Величина Е определяется свойствами только растворителя, но не растворенного вещества. , (29) где М1 — молекулярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице.
, (29) где М1 — молекулярная масса растворителя, DплН1 — энтальпия плавления растворителя, m2 — моляльность раствора; K – криоскопическая постоянная, зависящая от свойств только растворителя, равная понижению температуры замерзания раствора с моляльностью растворенного в нем вещества, равной единице. ,
, где g2- масса растворенного вещества, g1- масса растворителя, К- криоскопическая постоянная. На рис. 8 представлены температурные зависимости давления насыщенного пара над чистыми жидким и твердым растворителем (кривые ОА и ОD), а также давления насыщенного пара над растворами разных составов (кривые ВО ¢ и СО ¢¢) для случая, когда растворенное вещество нелетучее.
где g2- масса растворенного вещества, g1- масса растворителя, К- криоскопическая постоянная. На рис. 8 представлены температурные зависимости давления насыщенного пара над чистыми жидким и твердым растворителем (кривые ОА и ОD), а также давления насыщенного пара над растворами разных составов (кривые ВО ¢ и СО ¢¢) для случая, когда растворенное вещество нелетучее.


