Окислительно-восстановительные реакции состоят н переносе электронов от восстановителя к окислителю. Чтобы правильно составить уравнение окислительно-восстановительной реакции, необходимо точно знать состав как веществ, вступающих в реакцию, так и продуктов реакции. В окислительно-восстановительном процессе, происходящем в растворе, принимают участие ионы или недиссоциированные молекулы. При выводе уравнения реакции можно не учитывать степень окисления данного элемента, входящего в состав молекул или ионов (например, кислорода в пероксиде водорода, марганца в перманганат-ионе, серы в сульфит-ионе), а принимать во внимание только заряд иона.
В водных растворах в реакциях окисления-восстановления могут участвовать также ионы водорода и гидроксида. Преобладание того или иного указывает, какая среда наиболее благоприятна для протекания реакции. В процессе перераспределения в системе атомов кислорода или водорода ионы водорода или гидроксида образуют виду.
Составим уравнения некоторых окислительно-восстановительных реакций.
Пример 1. Составить ионно-электронное уравнение по схеме

В этой схеме элементный иод переходит в иодид-ион' приобретая электрон, следовательно, восстанавливается; Тиосульфат-ион окисляется, т. е. теряет электроны. Стадия восстановления протекает следующим образом: из молекулы иода образуется два иона иода
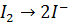 ,
,
 .
.
Электроны, приобретаемые атомами иода, должны быть отданы тиосульфат-ионами. Стадия окисления протекает при переходе
 .
.
Чтобы поставить знак равенства, необходимо уравнять заряды
 .
.
Суммарное уравнение принимает вид
 ,
,
или, по приведении подобных членов,
 ,
,
Пример 2. Составить ионно-электронное уравнение по схеме
 .
.
Стадия окисления очень проста
Fe2+  Fe3+
Fe3+
Fe2+ - e  Fe3+. (3.1)
Fe3+. (3.1)
Стадия восстановления значительно сложнее
 + 8H+
+ 8H+  Мn2+.
Мn2+.
Атомы кислорода должны быть перераспределены ¦ в системе так, чтобы образовалась вода (наименее диссоциированное соединение); для этого следует в реакционную смесь ввести достаточное количество ионов водорода
 + 8Н+
+ 8Н+  Мn2++ 4Н20.
Мn2++ 4Н20.
Чтобы можно было поставить знак равенства, уравниваем заряды
 + 8Н+ + 5е = Мп2+ + 4Н20. (3.2)
+ 8Н+ + 5е = Мп2+ + 4Н20. (3.2)
Чтобы на основании частных уравнений (3.1) и (3.2) составить суммарное, отвечающее заданной в условии схеме, нужно принять во внимание, что в реакции (3.1) теряется один электрон, а в реакции (3.2) необходимо пять электронов; поэтому, чтобы система осталась электронейтральной, следует все члены уравнения (3.1) умножить на пять и после этого суммировать оба уравнения
5Fe2+ - 5е = 5Fe3+
+
 + 8Н+ + 5е = Мn2++ 4Н20
+ 8Н+ + 5е = Мn2++ 4Н20
–––––––––––––––––––––––––––––––
5Fe2++  " + 8H+ = 5Fe3+ + Mn2+ + 4Н20
" + 8H+ = 5Fe3+ + Mn2+ + 4Н20
Получено ионно-электронное уравнение, отвечающее заданной схеме
Fe2+ +  Fe3+ + Мп2+
Fe3+ + Мп2+
В выведенном суммарном уравнении принимают участие ионы водорода; следовательно, реакцию надо вести в кислой среде.
Пример 3. Вывести ионно-электронное уравнение ПО схеме
Mn2+ + Pb02  + Pb2+.
+ Pb2+.
Стадия окисления
Мп2+ 
 ,
,
Мп2++ 80Н-  + 4Н20,
+ 4Н20,
Мп2+ + 80Н- - 5е 
 + 4Н20. (3.3)
+ 4Н20. (3.3)
Стадия восстановления
РЬ02  РЬ2+,
РЬ2+,
РЬО2 + 4Н+  — Pb2+ + 2Н20,
— Pb2+ + 2Н20,
Pb02 + 4H++ 2e  Pb2+ + 2H20. (3.4)
Pb2+ + 2H20. (3.4)
Для образования электронейтральной системы все члены уравнения (3.3) надо умножить на 2, а все члены уравнения (3.4) —на 5.
2Мп2+ + 160Н+ - 10е = 2  + 8Н20
+ 8Н20
+
5РЬ02 + 20Н+ + 10е = 5РЬ2+ + 10Н2О
_________________________________________________
2Мп2+ + 5РЬ02 + 160Н- + 20Н+ == 2  + 5РЬ2+ + 18Н20
+ 5РЬ2+ + 18Н20
В левой части теперь находятся одновременно ионы водорода и гидроксид-ионы. Так как ионы водорода находятся в избытке, то образуется соответствующее число молекул воды, и уравнение примет вид
2Мп2+ + 5РЬ02 + 4Н+ = 2  - 5РЬ2+ + 2Н20.
- 5РЬ2+ + 2Н20.
В частных реакциях при выводе этого окончательного уравнения участвуют ионы водорода и гидроксид-ионы, но из суммарного уравнения видно, что реакция проводится в кислой среде.
Задачи




 ,
, .
. .
. .
. ,
, ,
, .
. Fe3+
Fe3+ Fe3+. (3.1)
Fe3+. (3.1) + 8H+
+ 8H+  Fe3+ + Мп2+
Fe3+ + Мп2+ + Pb2+.
+ Pb2+.


