РАВНОВЕСИЯ В ГОМОГЕННЫХ СИСТЕМАХ
Задачи
Вычисление рН растворов сильных кислот и оснований
1. Вычислить рН 0,1%-ного раствора хлороводородной кислоты.
2. В 150 мл раствора содержится 0,05 г HNO3. Вычислить рН.
3. Вычислить рН 0,1 %-ного раствора хлорной кислоты.
4. Вычислить рН раствора, в 250 мл которого содержится 0,05 г иодистоводородной кислоты.
5. В 300 мл раствора содержится 0,2 г гидроксида натрия. Вычислить рН.
6. В 250 мл раствора содержится 0,2 г гидроксида калия. Вычислить рН.
7. Вычислить рН 0,15%-ного раствора гидроксида лития.
8. Вычислить рН раствора, полученного прибавлением 1 капли (0,05 мл) 0,01 М раствора гидроксида натрия к 90 мл чистой воды.
9. Вычислить рН раствора, полученного прибавлением 1 капли (0,05 мл) 0,05%-ного раствора гидроксида натрия к 183 мл чистой воды.
10. К 3,5 л воды прибавлен 1 мл хлороводородной кислоты (ρ =1,12). Вычислить рН раствора.
11. Вычислить рН раствора, полученного прибавлением к 3,5 л воды 1 г азотной кислоты (ρ = 1,4).
12. К 3,5 л воды прибавлен 1 мл азотной кислоты (ρ = 1,4). Вычислить рН раствора.-
13. К 1500 мл воды прибавлено 0,25 мл 10%-ной хлороводородной кислоты. Вычислить рН раствора.
14. К 1750 мл воды прибавлено 2 г 5%-ной хлороводородной кислоты. Вычислить рН раствора.
15. Смешано 25 мл 0,22 М раствора хлороводородной кислоты и 24 мл 0,25М раствора гидроксида калия. Вычислить рН полученного раствора.
Буферные растворы
Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие: рН таких растворов мало изменяется при разбавлении и добавлении к ним небольших количеств сильной кислоты или щелочи.
Для вычисления концентрации водородных ионов в буферных растворах применимы уравнения (1.29) и (1.30)
 ; (1.29)
; (1.29)
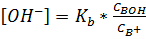 , (1.30)
, (1.30)
рН буферного раствора, содержащего слабую кислоту и ее соль, будет равен
 . (1.31)
. (1.31)
Для рН буферной смеси, состоящей из слабого основания и его соли, имеем следующее выражение:
 (1.32)
(1.32)
Если буферная смесь состоит из средней соли (М2А) и кислой соли (МНА) двухосновной кислоты, то
 , (1.33)
, (1.33)
где  и
и  —концентрации солей М2А и МНА,
—концентрации солей М2А и МНА,  —показатель константы диссоциации кислоты Н2О по второй ступени.
—показатель константы диссоциации кислоты Н2О по второй ступени.
Если буферная смесь образована кислыми солями (М2НА, МН2А) трехосновной кислоты, то для расчета рН применимо уравнение
 . (1.34)
. (1.34)
Буферное действие характеризуется буферной емкостью ( ). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты (
). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты ( ), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
 , (1.35)
, (1.35)
 . (1.36)
. (1.36)
В области максимального буферного действия буферная емкость раствора, содержащего слабую кислоту (НА) и ее соль (МА), выражается уравнением
 , (1.37)
, (1.37)
СА - общая концентрация раствора (СА = [НА] + [А -]). Максимальное значение буферная емкость при данной концентрации СА имеет при [Н+] = 
 . (1.38)
. (1.38)
Достаточное буферное действие проявляется в интервале
pH = p  ±1. (1.39)
±1. (1.39)
При определении буферной емкости раствора, состоящего из слабого основания и его соли, в формулу (1.37) вместо  вводится константа сопряженной кислоты
вводится константа сопряженной кислоты  .
.
Пример 11. К 15 мл 0,03 М раствора муравьиной кислоты прибавлено 12 мл 0,15 М раствора формиата калия. Вычислить рН этой смеси.
Решение. Найдем концентрацию кислоты и ее аниона после смешения двух растворов
СА- =  = 0,066 М,
= 0,066 М,
СНА =  = 0,017 М.
= 0,017 М.
Подставляя эти значения в уравнение (1.29), найдем
 М,
М,
рН = 5 - 
Эту задачу можно решить более просто, если концентрацию кислоты и соли выразить в миллимолях (мМ), учитывая, что объем раствора после разбавления входит в числитель и знаменатель данного выраженя.
рН = р  + lg
+ lg  ;
;
СА- = 12*0,15 мМ; СНА= 15*0,03 мМ;
Подставляя эти значения в выражения для рН, получим
рН = 3,75 + lg  = 3,75 + lg 4 = 4,35.
= 3,75 + lg 4 = 4,35.
Пример 12. Смешано 10 мл 0,3 М раствора НСl и 20 мл 0,2 М раствора аммиака. Определить рН полученного раствора.
Решение. В данном примере буферная смесь образовалась в результате реакции

Концентрация соли NH4Cl (Св+) равна взятой концентрации НСl с учетом разбавления раствора

Концентрацию NH3 (СBOH) находим по разности между начальной концентрацией CNH (с учетом разбавления) и концентрацией НСl
 .
.
Подставляя эти значения в уравнение (1.30), найдем [OH-]
 ,
,
рН = 14 – 6 +  = 8,72.
= 8,72.
Если выразить концентрацию НСl и NH3 в мМ, то решение можно провести следующим образом:
СB+ = 10 * 0,3 = 3 мМ; Свон =20 * 0,2 – 10 * 0,3 = 1 мМ.
рН = 14 - 4,75 + lg  = 9,25 + lg0,3 = 8,72.
= 9,25 + lg0,3 = 8,72.
Пример 13. К 20 мл 0,2 М раствора гидрофосфата калия добавлено 10 мл 0,25 М раствора HCl. Определить рН полученного раствора.
Решение. При смешении данных растворов происходит следующая реакция:
К2НР04 + HCl = КН2Р04 + KCl.
В результате образовалась буферная смесь, состоящая из КН2Р04 и К2НР04. Концентрации анионов Н2Р  и НР
и НР  равны
равны
[Н2Р  ] = 10 * 0,25 = 2,5 мМ;
] = 10 * 0,25 = 2,5 мМ;
[HP  ] = 20 * 0,2 -10 * 0,25 = 1,5 мМ.
] = 20 * 0,2 -10 * 0,25 = 1,5 мМ.
Используя уравнение (1.34), находим рН
рН = 7,21 + lg  = 7,21 +
= 7,21 + 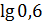 = 6,99.
= 6,99.
Пример 14. Сколько г ацетата натрия надо добавить к 200 мл 0,2 М раствора НСl, чтобы рН = 4,5?
Решение. Напишем уравнение реакции
CH3COONa + НСl = СН3СООН + NaCl.
В результате данной реакции образовалась уксусная кислота, концентрация которой равна концентрации HCl (СНА = 0,2). Равновесная концентрация анионов CH3СОО- определяется по разности между начальной концентрацией соли (х) и концентрацией HCl

Подставляем данные значения в уравнение (1.31) и находим х
 ,
,
4,5 = 4,76 + lg  ,
,
-0,26 = lg 
 lg
lg  ,
,
0,5495* 0,2 = х - 0,2,
х= 0,5495 * 0,2 + 0,2 = 0,1099 + 0,2 = 0,3099 М.
Количество CH3COONa в г на 200 мл (В) равно
B  г.
г.
Пример 15. Вычислить буферную емкость раствора, состоящего из 1,140 М СН3СООН и 0,205 М CH3COONa, рН=4.
Решение. Находим общую концентрацию компонентов
СА = 1,140 + 0,205 = 1,345 М.
Подставив в формулу (1.37), получим
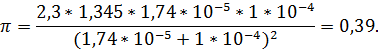
Пример 16. Буферный раствор, приготовленный из раствора аммиака и хлорида аммония, имеет рН = 10. Вычислить буферную емкость этого раствора, если общая концентрация СА = 0,336 М.
Решение. Константа диссоциации сопряженной кислоты согласно реакции
 + H20
+ H20 
 + ОН-
+ ОН-
равна

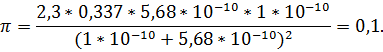
Задачи
Составление буферных смесей
131. Сколько мл 0,2 М раствора гидроксида натрия надо добавить к 20 мл 0,2 М раствора уксусной кислоты, чтобы получить раствор с рН =4?
132. Сколько мл 1%-ного раствора гидроксида натрия надо добавить к 25 мл 0,1 М раствора муравьиной кислоты, чтобы получить раствор с рН = 3,75?
133. Сколько мл 0,1 М раствора НСl надо добавить к 50 мл 0,25 М раствора аммиака, чтобы получить раствор с рН = 9?
134. Сколько мл 0,2 М раствора гидроксида натрия надо добавить к 25 мл 0,1 М раствора H3As04, чтобы получить раствор с рН=2?
135. Сколько мл 0,2 М раствора гидроксида натрия надо добавить к 20 мл 0,2М раствора фосфорной кислоты, чтобы получить раствор с рН = 7?
136. Сколько мл 1%-ного раствора гидроксида натрия надо добавить к 25 мл 0,3 М раствора фосфорной кислоты, чтобы получить раствор с рН = 2,5?
137. Сколько г ацетата натрия надо добавить к 100 мл 0,15 М раствора НСl, чтобы получить раствор С рН = 5?
138. Сколько г ацетата натрия надо добавить к 250 мл 0,2 М раствора НСl, чтобы получить раствор с рН = 4,5?
139. Сколько мл 1%-ного раствора формиата натрия надо добавить к 50 мл 0,1 М раствора муравьиной кислоты, чтобы получить раствор с рН = 3,75?
140. Сколько мл 1%-ного раствора формиата натрия надо добавить к 100 мл 0,05 М раствора НCl, чтобы получить раствор с рН = 3,7?
141. Сколько г дигидрофосфата натрия надо добавить к 250 мл 0,15 М раствора гидроксида натрия, чтобы получить раствор с рН = 7?
142. Сколько мл 0,1 М раствора НСl надо добавить к 50 мл 0,15 М раствора гидрофосфата калия, чтобы получить раствор с рН = 7,2?
143. Сколько мл 0,5 М раствора нитрата аммония надо добавить к 10 мл 0,2 М раствора аммиака, чтобы получить раствор с рН = 9,8?
144. Сколько мл 0,1 М раствора гидроксида натрия надо добавить к 50 мл 0,2 М раствора дигидрофосфата натрия, чтобы получить раствор с рН =7?
145. Сколько мл 0,15 М раствора гидроксида натрия надо добавить к 50 мл 0,1 М раствора дигидрофосфата натрия, чтобы получить раствор с рН = 7?
146. Сколько г карбоната натрия надо добавить» к 50 мл 0,25 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10?
Задачи
205. В 12 л поды растворили 0,01 г бромида калия и прибавили 1 мл 0,1 М раствора нитрата серебра. Будет ли образовываться осадок?
206. Смесь 10 мл 0,1 М раствора хлорида натрия и 1 мл 0,01 М раствора бромида калия доведена водой до 10 л и прибавлен 1 мл 0,01 М раствора нитрата серебра. Будет ли образовываться осадок и какого состава?.- -
207. При каком значении рН начнется образование осадка гидроксида марганца (II) из раствора, в котором концентрация хлорида марганца (II) равна1*10-2 М?
208. При какой концентрации ионов магния начнется образование осадка гидроксида магния из раствора, содержащего 0,5 М хлорид аммония и 0,5 М аммиак?
209. Образуется ли осадок сульфата стронция, если к 0,2 М раствору хлорида стронция прибавить равный объем насыщенного раствора сульфата кальция?
210. Выпадет ли осадок гидроксида магния, если к 20 мл 5*10-2 М раствора хлорида магния прибавить аммиак до концентрации 0,3 М и 8 г хлорида аммония?
211. Образуется ли осадок гидроксида марганца (II), если к 20 мл раствора, содержащего 2*10-1 М хлорид марганца, прибавить 10 мл 2 М раствора аммиака?
212. При какой концентрации ионов магния начнется образование осадка гидроксида магния из раствора, имеющего рН = 8,5?
213. Образуется ли осадок гидроксида железа (II), если к 20 мл 5*10-3 М раствора сульфата железа (II) прибавить 10 мл 0,5 М аммиака?
214. Сколько г хлорида аммония необходимо прибавить к 20 мл раствора, содержащего 2*10-2 М сульфат железа (II) и 5*10-2 М аммиак, чтобы не образовался осадок гидроксида железа (II)?
215. Сколько г едкого натра надо прибавить к 20 мл раствора, содержащего 5*10-3 М хлорид магния, чтобы образовался осадок гидроксида магния?
216. Сколько мл 15%-ного раствора хлорида аммония необходимо добавить к 20 мл раствора, содержащего 1 М аммиак и 2*10-2 М' хлорид магния, чтобы предупредить образование осадка гидроксида магния?
217. Сколько мл 2 М раствора соляной кислоты необходимо прибавить к 20 мл 3*10-2 М раствора нитрата свинца, чтобы образовался осадок хлорида свинца?
218. При какой концентрации ионов стронция в растворе можно осадить их действием насыщенного раствора сульфата кальция?
219. Будет ли происходить осаждение сульфата кальция, если к 0,1 М раствору хлорида, кальция добавить равный объем 0,1 М раствора серной кислоты?
220. Образуется ли осадок гидроксида свинца, если к насыщенному раствору хлорида свинца прибавить равный объем 2 М раствора аммиака?
221. Образуется ли осадок сульфата свинца, если к насыщенному раствору хлорида свинца прибавить равный объем 0,2 М серной кислоты?
222. Произойдет ли осаждение сульфата свинца, если к 150 мл насыщенного раствора хлорида свинца прибавить 5 г хлорида натрия и 5 мл 0,1 М раствора серной кислоты (комплексообразованием пренебречь)?
223. При каком значении рН начнется образование осадка гидроксида алюминия из 2*10-2 М раствора хлорида алюминия?
224. Будет ли осаждаться гидроксид железа (II), если в растворе содержится 0,5 М сульфат аммония, 0,01 М аммиак и 0,02 М сульфат железа (II)?
225. При какой концентрации ионов стронция в растворе можно их обнаружить с помощью насыщенного раствора карбоната лития?
226. При какой концентрации хромат-ионов начнется образование осадка хромата свинца из 0,08 М раствора нитрата свинца?
Задачи
ГРАВИМЕТРИЧЕСКИЙ АНАЛИЗ
Гравиметрический метод количественного анализа основан на точном измерении массы определяемого вещества. Для этого навеска анализируемого объекта переводится в раствор, определяемый компонент осаждается в виде малорастворимого соединения (осаждаемая форма). Выделившийся осадок после ряда аналитических операций (фильтрование, промывание, высушивание или прокаливание) взвешивается на аналитических весах в виде соединения строго определенного состава (весовая форма). По весу высушенного или прокаленного осадка вычисляется содержание определяемого компонента в данном образце.
4 .1. Расчет минимальной навески
Величина навески не может быть выбрана произвольно. При расчете минимальной навески необходимо учитывать ошибку взвешивания. Погрешность обычных аналитических весов составляет ±1*10-4 г. Эта величина не должна превышать 0,1% от минимального количества весовой формы (х), поскольку допустимая относительная ошибка гравиметрического метода составляет 0.1%. Следовательно,

Для вычислений минимальной навески (𝑎мин) должно быть приблизительно известно процентное содержание определяемого элемента (р).
Пусть весовой форме определяемого элемента М соответствует формула МnAm. Обозначим молекулярную массу МnAm через Мв, а атомную массу М через Ам. Минимальное количество М может быть вычислено по следующей формуле:
 .
.
Минимальная навеска будет равна
 . (4.2)
. (4.2)
Пример 1. Рассчитать минимальную навеску технического хлорида бария, содержащего около 20% Ва, при определении Ва гравиметрическим методом в виде BaSO4.
Решение. По условию количество весовой формы (BaS04) должно быть не менее 0,1 г; Мв = 233,40; Ам =137,33.
По уравнению (4.1) находим минимальное количество. Ва (

Минимальная навеска а будет равна

Пример 2. Найти минимальную навеску руды, содержащей около 10% железа, при определении его гравиметрическим методом — осаждением в виде гидроксида.
Решение. Весовой формой в указанном методе определения Fe является оксид Fe203; МВ = 159,7; Ам = 55,85.
Вычисляем минимальную навеску по формуле (4.2)

Пример 3. Какую минимальную навеску Al2(S04)31*8Н20 следует взять для определения алюминия осаждением в виде гидроксида?
Решение. В данном- случае известен состав анализируемого образца; M(Al2(S04)3*18 Н20) равен 666,5, а МВ(Аl203) = 102. Учитывая, что количество весовой формы не должно превышать 0,1 г, находим минимальную навеску (𝑎) из следующего соотношения:

Задачи
467. Рассчитать минимальную навеску технического хлорида бария, содержащего 10% Ва, для определения его в виде BaSO4.
468. Какую навеску технического сульфата алюминия, содержащего около 4% алюминия, следует взять для определения алюминия в виде Al (C9H6NO)3?
469. Какую навеску известняка, содержащего около 35% Са, нужно взять для определения кальция в виде СаО?
470. Рассчитать навеску известняка, содержащего около 35% Са для определения кальция в виде СаС03.
471. Рассчитать навеску известняка, содержащего около 4% Mg, для определения магния в виде Mg2P2О7.
472. Какую навеску карналлита, содержащего около 3% Mg, следует взять для определения магния в виде Mg(C9H6NO)2?
473. Вычислить навеску сплава, содержащего около 70% железа если железо определяется в виде Fe203.
474. Какова должна быть навеска чугуна, содержащего 0,1% серы, чтобы после соответствующей обработки определить серу в виде BaS04?
475. Рассчитать навеску чугуна, содержащего около 2% кремния, для анализа на содержание кремния в виде Si02.
476. Какова должна быть навеска сплава, содержащего около 5% магния, для анализа на содержание магния в виде Mg2P207?
477. Какую навеску сплава, содержащего около 65% свиниа, нужно взять для определения в нем свинца в виде PbS04?
478. Какова должна быть минимальная навеска пирита, содержащего около 40% железа, для определения в нем железа в виде Fe203?
479. Какую навеску мрамора, содержащего около 10% примесей, следует взять для определения в нем кальция в виде СаО?
480. Рассчитать минимальную навеску известняка, содержащего около 80% СаС03 для анализа на содержание С02.
481. Какую минимальную навеску нитрата серебра, содержащего 5% примесей, нужно взять для анализа на содержание серебра в виде AgCl?
482. Рассчитать минимальную навеску фосфорита, содержащего около 20% Р205, для Определения фосфора в виде Mg2P207.
483. Какую навеску полевого шпата, содержащего около 8% алюминия, необходимо взять для определения в нем оксида алюминия?
484. Техническая поваренная соль содержит около 5% примесей. Какую нужно взять навеску для определения в ней хлора в виде AgCl?
485. Какова должна быть навеска угля, содержащего около 1% серы, для анализа на содержание серы в виде BaS04?
Задачи
486. Сколько 8,4%-ного раствора серной кислоты надо взять для осаждения бария из 0,4859 г дигидрата хлорида бария?
487. Навеска 0,2783 г карбоната бария растворена в хлороводородной кислоте. Сколько 4%-ного раствора серной кислоты надо взять для осаждения бария?
488. Взята навеска 5,0000 г вещества, содержащего около 1% серы, и проведено окисление всей серы в серную кислоту. Сколько 5%-ного раствора хлорида бария потребуется для осаждения образовавшегося сульфат-иона?
489. Сколько 3,3%-ного раствора аммиака надо взять для осаждения гидроксида алюминия из раствора 0,9865 г алюминиево-калиевых квасцов?
490. Сколько 0,1 н раствора щавелевой кислоты надо взять для осаждения кальция из навески гипса 0,2723 г?
491. Сколько 4%-ного раствора гидрофосфата натрия надо взять, чтобы осадить Mg в виде MgNH4P04 из 0,4456 г гептагидрата сульфата магния?
492. Сколько 4,2%-ного раствора нитрата серебра надо взять, чтобы осадить хлорид-ион из 0,1777 г КCl?
493. Сколько 2,8%-ного раствора аммиака надо взять для осаждения железа из навески 0,5263 г руды, содержащей 12% железа?
494. Сколько 4%-ного раствора гидроксида калия надо взять для осаждения оксида меди из раствора 0,7267 г медного купороса?
495. Сколько 10%-ного раствора карбоната натрия надо взять для осаждения цинка в виде карбоната из навески 0,6543 г латуни, содержащей около одной трети цинка?
496. Сколько 7,7%-ного раствора серной кислоты надо взять для осаждения стронция в виде сульфата из навески 0,6327 г безводного хлорида стронция?
497. 1 г серебряного сплава, содержащего около 80% серебра-, растворили в 250 мл. Сколько мл хлороводородной кислоты плотностью 1,020 необходимо взять для осаждения серебра в 25 мл полученного раствора?
498. Сколько 1%-ного раствора диметилглиоксима надо взять для осаждения никеля из навески 0,9531 г сплава, содержащего 0,5% никеля?
499. Сколько 5%-ного раствора оксихинолина надо взять для осаждения алюминия из раствора 0,5173 г сплава, содержащего 3% алюминия?
4.2.2. Вычисление избытка реактива для практически полного осаждения. В гравиметрическом анализе осаждение считается практически полным тогда, когда количество осаждаемой формы в данном объеме раствора не будет превышать 1 *10-4 г.
Во избежание заметных потерь осадка за счет растворимости его как при осаждении, так и последующем промывании вводят некоторый избыток осадителя, определяемый константой растворимости осадка и зависящий от объема раствора.
Допустим, что осаждение ионов Мz+ в виде МуAz проводится в объеме V мл. По условию содержание МуAz в V мл не должно превышать 1 *10-4 г (можно задаться и меньшей величиной).
Найдем концентрацию Mz+([Мz+]) в этом растворе, выраженную в М,
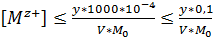 M,
M,
М0 —молекулярная масса МуAz.
Зная константу растворимости осадка (KS,) вычислим концентрацию ионов осадителя ([Аy-]), которую необходимо иметь в избытке для практически полного осаждения МуAz.
 (4.8)
(4.8)
Общее количество реактива равно сумме эквивалентного количества, вычисляемого по уравнениям (4.4) или (4.6), и избытка его [Аy-], рассчитываемого но уравнению (4.8).
Пример 6. Какой избыток H2S04 необходимо ввести для практически полного осаждения PbS04 из 200 мл раствора?  = 1,6*10-8.
= 1,6*10-8.
Решение. В 200 мл раствора должно содержаться не более 1*10-4 г PbS04 (M0 = 303,3). Концентрация РЬ2+ не должна превышать следующую величину:
[РЬ2+]  1,65*10-6 М.
1,65*10-6 М.
Определим концентрацию SO42-, необходимую для практически полного осаждения,
[SO42- ]  9,6 * 10-3 M.
9,6 * 10-3 M.
Следовательно, избыток H2S04, превышающий эквивалентное количество ее, должен составлять 9,6 * 10-3 М.
Пример 7. Вычислить количество H2SO4 (в г), которое необходимо ввести в промывную жидкость для промывания сульфата стронция с тем, чтобы потеря осадка за счет растворения не превышала 1 * 10-4 г в 300 мл;  =3,2*10-7.
=3,2*10-7.
Решение. Вычислим концентрацию Sr2+ в М (М. м. SrS04=183,68)
[Sr2+]=  10-6 M
10-6 M
Найдем концентрацию S042-
[S042] =[  = 1,78*10-1 М.
= 1,78*10-1 М.
Количество H2S04 в г/л (b) будет равно
b = 1,78*10-1 *98,08 = 17,4 г.
В 300 мл должно содержаться
 .
.
Задачи
500. Какой объем 10,56%-ного раствора серной кислоты надо добавить к 200 мл раствора соли бария, чтобы в нем могло остаться не более 0,00001 г сульфата бария?
501. Сколько 5%-ного раствора хлорида бария надо взять, чтобы при осаждении сульфата бария из 150 мл раствора потеря за счет растворения не превышала 0,00001 г серы?
502. Сколько 4%-ного раствора оксалата аммония надо взять, чтобы в 400 мл фильтрата при осаждении оксалата кальция оставалось не более 0,00001 г оксида кальция?
503. Сколько 2%-ного раствора оксалата аммония надо взять, чтобы в 300 мл фильтрата при осаждении оксалата кальция оставалось не более 0,00001 г кальция?
504. Сколько мл 5%-ного раствора нитрата аммония следует взять, чтобы в 500 мл фильтрата при осаждении MgNH4P04 потеря осадка за счет растворения в пересчете на оксид магния составляла не более 0,0002 г?
505. Какой избыток 7,7%-ного раствора серной кислоты необходим для практически полного осаждения сульфата стронция из 250 мл раствора?
506. Сколько мл 5,5%-ного раствора серной кислоты надо взять, чтобы после осаждения сульфата бария содержание его в 250 мл фильтрата не превышало 0,0001 г?
507. Сколько 10%-ного раствора серной кислоты надо взять для практически полного осаждения стронция из навески 0,6327 г безводного хлорида стронция, растворенного в 250 мл воды?
508. Какова должна быть концентрация раствора нитрата аммония в промывной жидкости для промывания осадка MgNH4P04, чтобы потеря от растворения составляла не более 0,00001 г MgO в 200 мл?
509. Какой общий объем 3%-ного раствора оксалата аммония надо взять для осаждения оксалата кальция из навески карбоната кальция, равной 0,3745 г, чтобы в 300 мл фильтрата оставалось не более 0,00001 г кальция?
510. Сколько г сульфата аммония нужно добавить к 250 мл воды, чтобы при, промывании осадка сульфата бария потеря за счет растворения не превышала 0,001 мг?
511. Сколько г хромата калия нужно добавить к 300 мл воды, чтобы при промывании осадка хромата бария в фильтрат перешло не более 0,003 мг этой соли?
Расчет результатов анализа
4.3.1. Вычисление процентного содержания определяемого вещества. Расчет процентного содержания вещества в анализируемом образце по данным гравиметрического метода основан на точном знании состава весовой формы.
Допустим, требуется определить процентное содержание элемента М в некотором образце. Взята навеска образца, равная а г. Весовая форма имеет состав МnАm, масса ее равна b г. Обозначим через Мв молекулярную массу МnАm, а через Ам— атомную массу элемента М. Найдем количество определяемого элемента в г (х) ос следующей формуле:
 (4.9)
(4.9)
Содержание М в % будет равно
% M 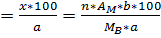 . (4.10)
. (4.10)
Если требуется найти содержание какого-либо соединения элемента в образце (например, MqLp), то расчет может быть проведен так:
% MqLp=  (4.11)
(4.11)
Mq — молекулярная масса MqLp
В некоторых случаях (при большом содержании определяемого вещества) проводят анализ не всей навески, а только некоторой ее части (аликвоты). Для этого после растворения навески переносят раствор в мерную колбу и разбавляют водой до объема V мл, затем берут для анализа пипеткой определенную часть раствора (v мл). Расчет проводится аналогично, с учетом того, что навеска будет, равна
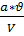 г.
г.
% M=  . (4.12)
. (4.12)
Пример 8. Найти процентное содержание алюминия в сплаве, если из навески его, равной 0,5618 г, получено 0,1012 г оксида алюминия.
Решение. Молекулярная масса Аl2О3 равна 101,96, атомная масса алюминия —26,98. По формуле (4.9) находим содержание Аl в г (х)
 0,5354 г.
0,5354 г.
Определяем % алюминия в сплаве
% Al 
Пример 9. Вычислить процентное содержание карбоната кальция в известняке по следующим данным. Навеска известняка равна 0,5120 г. После растворения ее, осаждения кальция в виде оксалата и прокаливания осадка получено 0,2160 г оксида кальция.
Решение. Процентное, содержание СаС03 можно вычислить по формуле (4.11). В данном случае МСа0 = 56,08; МСаСОз = 100,09: n = 1; q = 1.
% СаС03 
Задачи
Рассчитать процентное содержание
512. Бария в барите, если навеска его 0,3115 г. В результате анализа получено 0,2318 г сульфата бария.
513. Алюминия в криолите, если навеска его 0,6118 г. В результате анализа получено 0,1502 г оксида алюминия.
51.4. СаС03 в доломите, если навеска его 1,0000 г. В результате анализа получено 0,3515 г оксида кальция.
515. Карбоната магния в доломите, если навеска его 0,5000 г. В результате анализа получено 0,2856 г дифосфата.магния.
516. Серы в чугуне, если навеска его 13,7400 г. В результате Анализа получено 0,1086 г сульфата бария.
517. Серы в каменном угле, если навеска его 2,9440 г.В результате анализа получено 0,1526 г сульфата бария.
518. Магния в сплаве, если навеска его 4,3700 г. В результате анализа получено 0,1323 г дифосфата магния.
519. Серной кислоты в растворе (объемные проценты), если для анализа было взято 10 мл этой кислоты и разбавлено в мерной колбе до 100 мл. При осаждении сульфат-иона хлоридом бария из 10 мл разбавленного раствора было получено 0,2377 г сульфата бария.
520. Полуторных оксидов (R203) в силикате, если навеска его 0,5692 г. Фильтрат после отделения кремниевой кислоты разбавлен в мерной колбе до 250 мл. При осаждении гидроксидов из 150 мл этого раствора получено 0,0688 г полуторных оксидов.
521. Оксида кальция в силикате, если навеска его 0,5692 г. Фильтрат после отделения кремниевой кислоты и полуторных оксидов (Fe203 + Al203) доведен в мерной колбе до 250 мл. После осаждения кальция оксалатом из 150 мл этого раствора было получено 0,0725 г оксида кальция.
522. Фосфора в чугуне, если навеска его 10,8160 г. j В результате анализа получено 0,1218 г дифосфата магния.
523. Магния в сплаве, если для анализа бы.ла взята навеска 5,2160 г. После растворения сплава раствор доведен в мерной колбе-до 250 мл. Магний определялся из?0 мл этого раствора и в результате анализа было получено 0,1218 г дифосфата магния.
524. Марганца в сплаве, если для анализа была взята навеска 10,1800 г. После растворения сплава раствор был доведен в мерной колбе до 250 мл. Марганец определялся из 50 мл этого раствора и в результате анализа было получено 0,1628 г дифосфата марганца.
525. Цинка в сплаве, если навеска его 5,8160 г. После растворения сплава раствор доведен в мерной колбе до 250 мл. Для определения цинка взято 100 мл этого раствора, и в результате анализа получено 0,1125 г дифосфата цинка.
526. Серебра в сплаве, если навеска, его 0,5868 г. В результате анализа получено 0,1556 г хлорида серебра.
527. Si02, полуторных оксидов (Аl2O3 + Fe203), СаО и MgO в силикате, если навеска его 0,5686 г. В результате анализа получено: Si02 — 0,3184 г, полуторных оксидов — 0,1192 г, СаО — 0.0856 г, Mg2P207— 0,1104 г.
528. Карбонатов кальция и магния в известняке, если навеска его 0,9866 г. В результате анализа получено оксида кальция 0,3755 г и дифосфата магния 0,4105 г.
529. Железа в красном железняке, если навеска его 0.6114 г. В результате анализа было
4.3.2. Вычисление аналитических множителей. При серийных анализах для ускорения расчетов часто используют так называемый аналитический множитель, или фактор пересчета (F). Эта величина входит в качестве постоянного множителя в уравнения (4.10) и (4.11)
F= 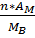 -. (4.13)
-. (4.13)
Для однотипных расчетов уравнение (4.10) можно преобразовать следующим образом:
 (4.14)
(4.14)
Пример 10. Вычислить аналитический множитель при определении магния в виде Mg2P207.
Решение. В данном случае Ам= 24,31; Мв = 222,55; n = 2.
F =  0,5885.
0,5885.
Задачи
Задачи
Вычислить навеску
564. Нитрата бария для получения не менее 0,2 г сульфата бария.
565. Медного купороса, чтобы при определении сульфат-иона получилось 0,1 г сульфата бария.
566. Каменного угля, содержащего 0,7% серы, чтобы после соответствующей обработки и осаждения хлоридом бария получилось 0,15 г сульфата бария.
567. Чугуна, содержащего 0,1% серы, чтобы после соответствующей обработки и осаждения хлоридом бария получилось 0,1 г сульфата бария.
568. Вещества, содержащего серу, чтобы после необходимой обработки и осаждения хлоридом бария вес полученного сульфата бария численно равнялся процентному содержанию серы.
569. Вещества, содержащего алюминий, чтобы вес полученного оксида алюминия, умноженный на 100, численно равнялся проценту алюминия в исходном веществе.
570. Вещества, содержащего железо, чтобы вес полученного оксида железа, умноженный на 50, численно равнялся проценту железа в исходном веществе.
571. Вещества, содержащего хром, чтобы вес полученного оксида хрома, умноженный на 200, численно равнялся проценту хрома в исходном веществе.
572. Вещества, содержащего магний, чтобы вес полученного дифосфата магния, умноженный на 100, численно равнялся проценту оксида магния в исходном веществе.
573. Дещества, содержащего • магний, чтобы вес полученного дифосфата магния, умноженный на 10, численно равнялся проценту магния в исходном веществе. *
5,74. Вещества, содержащего бром, чтобы вес полученного бромида серебра, умноженный на 5, численно равнялся проценту брома в исходном веществе.
575. Доломита, содержащего 60% CaCО3, чтобы в результате анализа получилось 0,3620 г оксида кальция.
576. Доломита, содержащего 45% карбоната магния, чтобы в результате анализа получалось 0,2056 г дифосфата магния.
577. Сплава, содержащего 25% железа, чтобы в результате анализа получилось 0,2518 г оксида железа (III).
578. Сплава, содержащего 9,5% алюминия, чтобы в результате анализа получилось 0,1469 г оксида алюминия.
579. Вещества, содержащего 4% фосфора, чтобы в результате анализа получилось 0,1662 г дифосфата магния.
580. Бронзы, содержащей 0,8% свинца, чтобы при определении его в результате анализа получить 0,1595 г сульфата свинца.
4.3.4. Пересчет на сухое вещество. Если анализируемый образец наряду с основными определяемыми частями содержит воду, процент которой определен, то результат анализа может быть пересчитан на абсолютно сухое вещество.
Пример 11. При анализе хлорида бария было определено 55,22% бария и 14,73% кристаллизационной воды. Сколько процентов бария в абсолютно сухом веществе?
Решение. В 100 г анализируемого вещества содержится 14,73 г воды; следовательно, 56,22 г бария содержится в 85,27 г абсолютно сухого вещества,
% Ва=  = 65,93.
= 65,93.
Задачи
581. При анализе карбоната магния было определено 17,39% магния и 39,13% кристаллизационной воды. Сколько % магния в абсолютно сулим образце?
582. При анализе сульфата марганца было определено 21,23% марганца и 41,70% кристаллизационной воды. Сколько % марганца в абсолютно сухом образце?
583. При анализе хромата натрия было определено 15,21% хрома и 52,64% кристаллизационной воды. Сколько % хрома в абсолютно сухом образце?
584. При анализе каменного угля было определено 2,85% воды, 8,73% золы и 1,37% серы. Сколько % золы и серы в абсолютно сухом образце? I
585. При анализе каменного угля было определено 1,87% воды, 6,28% золы и 0,72% серы. Сколько % золы и серы в абсолютно сухом образце?
586. При анализе бетона было определено 15,28% воды, 70,12% нерастворимого остатка, 2,62% су



 ; (1.29)
; (1.29)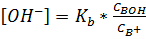 , (1.30)
, (1.30) . (1.31)
. (1.31) (1.32)
(1.32) , (1.33)
, (1.33) и
и  —концентрации солей М2А и МНА,
—концентрации солей М2А и МНА,  —показатель константы диссоциации кислоты Н2О по второй ступени.
—показатель константы диссоциации кислоты Н2О по второй ступени. . (1.34)
. (1.34) ). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты (
). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты ( ), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу. , (1.35)
, (1.35) . (1.36)
. (1.36) , (1.37)
, (1.37)
 . (1.38)
. (1.38) .
. = 0,066 М,
= 0,066 М, = 0,017 М.
= 0,017 М. М,
М,
 ;
; = 3,75 + lg 4 = 4,35.
= 3,75 + lg 4 = 4,35.

 .
. ,
, = 8,72.
= 8,72. = 9,25 + lg0,3 = 8,72.
= 9,25 + lg0,3 = 8,72. и НР
и НР  равны
равны ] = 10 * 0,25 = 2,5 мМ;
] = 10 * 0,25 = 2,5 мМ; = 7,21 +
= 7,21 + 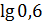 = 6,99.
= 6,99.
 ,
, lg
lg  г.
г.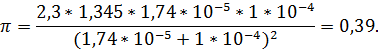
 + H20
+ H20 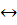
 + ОН-
+ ОН-
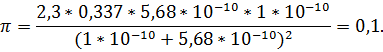

 .
. . (4.2)
. (4.2)




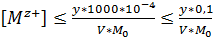 M,
M, (4.8)
(4.8) = 1,6*10-8.
= 1,6*10-8. 1,65*10-6 М.
1,65*10-6 М. 9,6 * 10-3 M.
9,6 * 10-3 M. =3,2*10-7.
=3,2*10-7. 10-6 M
10-6 M = 1,78*10-1 М.
= 1,78*10-1 М. .
. (4.9)
(4.9)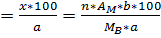 . (4.10)
. (4.10) (4.11)
(4.11)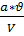 г.
г. . (4.12)
. (4.12) 0,5354 г.
0,5354 г.

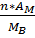 -. (4.13)
-. (4.13) (4.14)
(4.14) 0,5885.
0,5885. = 65,93.
= 65,93.


