Предмет и задачи АХ. Значение АХ в совр.науке. анализ в биологии и службе охраны природы.
АХ-наука о методах определения качественного и количественного состава ве-ва, АХ явл.составной частью единой хим.науки.
Предмет АХ- разработка методов анализа, их практич.выполнение, опр-е состава ве-в, изучение физ.св-в ве-в.
Задачи-1. развитие теории методов анализа.
2. разработка и совершенствование методов анализа.
3. обеспечение хим.-аналитич.контроля в процессе проведения научно-исследовательских работ.
Большое место отводится в АХ поиску новых совр.методов анализа, с использованием новых достижений науки и техники. Анализ имеет большое значение для промышленности, медицины. Определяется состав вод, почв. В пром-ти исп-ся состав как количественный так и качественный сплавов материалов и т.д.
Концентрация и активность. Ионная сила раствора.
Концентрацию, в завист-ти от раствора выражают след.способами5
 молярная
молярная
 эквивалентн.
эквивалентн.
Т-титр.
Если использумые ве-ва явл.электролитами, то их состояние хар-ся степенью диссоциации L.
Активность- та эффективная кажущаяся концентрация ионов в р-ре, в соотношении с кот.он проявляет себя в химич.реакции
Активность связана с концентрацией в соотношении: a=f*c, где f- коэф-т активности.
Значение коэф-та активных ионов опр-ся только ионной силой раствора, и не зависит от природы других ионов, присутствующих в растворе- закон ионной силы Льюиса и Рэндала.
Ионная сила при этом хар-т общее содержание ионов в растворе и рассчитывается как
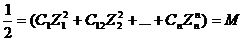
Хим.равновесие. константа хим.равновесия (концентрационная, термодинамическяа, условная). Равновесная концентрация. Понятие об аналитич.концентрации.
Концентрация ве-в, имеющая место в системе с момента наступления равновесия, наз-ся равновесными []. эти концентрации остаются неизменными столько долго, сколько не изменяется внешнее условие.
Равновесная концентр.ве-ва зависти от его исходной концентрации ве-ва и расхода ве-ва на протекание р-ции до момента установления равновесия.

т.о аналитич.концентр.-это общая концентрация ве-ва в р-ре, независимо от формы его содержания (ионы, молекулы).
Для обратимых р-ции з-н действ.масс запис-ся в виде конст.равновесия А+В↔С+Д

Равновесие в водных растворах сильных и слабых кислот и оснований. Расчет рН.
1.Когда слабые к-ты диссоциируют в незначит.степени, то в р-ре наступает равновесие.
НА↔Н++А-
Оно опис-ся  наз-т константой диссоциации и зн-е смотрят в справочнике
наз-т константой диссоциации и зн-е смотрят в справочнике
2. сильные к-ты в водн.р-рах дисс-т практич.нацело
НА→Н++А- концентрация ионов водорода совпадает с общей конц.кислоты в р-ре, а рН=-
[H+]=Cк, рН=-lg[H+]=-lgCk
3. сильные основания (щелочи) дис-т нацело
ВОН→В++ОН-
4. слабые основания-дис-т в незначит.степени и этот процесс опис-ся соответствующей константой, и наз-ся константой диссоциации слаб.основания.
ВОН↔В++ОН-

Константа равновесия ОВР.
Возможность протекания ОВР в противоположн.направлении свидетельствует о ее обратимости. Обратимые хим.р-ции хар-ся константой равновесия. ОВ потенциалы соответствующих редоксопар опр-ся Ур-ем Нернста.

где, n- общее число электронов переходящих от ок-ля к восст-лю.
Применение ОВР в анализе многообразно: для обнаружения ионов, для количественного обнаружения ионов, разделения ионов, устранения мешающих анализу ионов.
Классификация методов анализа. Требования к методам анализа и к результатам.
Анализ ве-в проводится для установления количественного и качественного состава ве-в.
Качественный анализ- позволяет установить, из каких эл-тов состоит ве-во.
Количественный – позволяет установить количественное содержание составных частей в анализируемой среде.
Методы м/классифицироваться в зависимости от кол-ва анализируемого ве-ва:
v Макрометоды,
v Полумикрометоды
v Микрометоды
v Ультрамикрометоды
v Субмикрометоды (очень важны в медицине, биологии).
В зависимости от техники выполнения анализа:
v Химические- в основе хим.реакция.
v Физико-химические- о составе анализируемого ве-ва судят по физ.св-ву продукта (плотность)
v Физические- судят по физическому свойству.
Четкой границы м/у физич. и физич.-хим. р-ции нет, а объединяет их то, что и там и там исследуются св-ва при пом.прибора.
17.аналитич.реакции и реагенты, требования к ним. Сп-бы повышения селективности и чувствительности
Реагент- ве-во, вызвавшее аналитическую реакцию.
Аналитические р-ции м/осуществляться двумя способами:
v Мокрым- хим.р-ция осуществляемая м/у растворами исследуемого ве-ва и реагента. Она проводится на фильтр.бумаге, предметном стекле с посследующим рассмотрением формы образовавшихся кристаллов.
v Сухим- прокаливание, пирохимические р-ции.
Хим.методы количественного анализа: гравиметрические (весовые), титриметрические (объемные).
Требования методов анализа: 1.чувствительность- определение возможно меньших количеств ве-в.
2. силективность-из большого кол-ва находящихся в образце метод д/определить одно единственное.
3. экспрессность- время затраченное на анализ д/быть минимальным
Сущность титриметрического.метода анализа. Требования к реакциям в титриметрии. СП-бы фиксирования точки экв.
Титриметрический метод анализа основан на точном измерении объема реагента, затрачиваемого на реакцию с определяемыми ионами.

Виды титр.м-да анализа:
v кислотно-основное
v окислительно-восстановительное
v комплексо-метрическое
v осадительное.
По способу титрования: прямое, обратное, заместительное.
В ходе анализа требуется точно заметить момент наступления эквивалента, или зафиксировать точку экивалентности.
1 индикаторный- в реакц.смесь + индикатор, кот.в точке экв.меняют цвет.
2 безиндикаторный- если титрант окрашен, то добавляют или его избыток, и появляется неисчезающее окрашивание р-ра.
В титр.методе р-ции должны: протекать быстро, количественно, д/существовать возм-ть фиксировать точку эквивалентности, д/отсутствовать побочные реакции.
Предмет и задачи АХ. Значение АХ в совр.науке. анализ в биологии и службе охраны природы.
АХ-наука о методах определения качественного и количественного состава ве-ва, АХ явл.составной частью единой хим.науки.
Предмет АХ- разработка методов анализа, их практич.выполнение, опр-е состава ве-в, изучение физ.св-в ве-в.
Задачи-1. развитие теории методов анализа.
2. разработка и совершенствование методов анализа.
3. обеспечение хим.-аналитич.контроля в процессе проведения научно-исследовательских работ.
Большое место отводится в АХ поиску новых совр.методов анализа, с использованием новых достижений науки и техники. Анализ имеет большое значение для промышленности, медицины. Определяется состав вод, почв. В пром-ти исп-ся состав как количественный так и качественный сплавов материалов и т.д.



 молярная
молярная эквивалентн.
эквивалентн.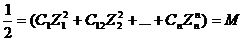


 наз-т константой диссоциации и зн-е смотрят в справочнике
наз-т константой диссоциации и зн-е смотрят в справочнике




