Буферная емкость зависит от природы и общих концентраций компонентов буферного раствора, а также от отношения их концентраций. Чем больше концентрация компонентов буферного раствора и чем ближе отношение сНА/сВА и сВОН/сВА к единице, тем больше буферная емкость.. При сНА/сВА и свон/сВА, равных единице, буферная емкость максимальна.
37) Термодинамическое произведение растворимости и факторы, влияющие на его величину. Реальное и условное произведение растворимости. Электролиты и их влияние на растворимость веществ.
Термодинамическое произведение растворимости – это величина, равная произведению равновесных активностей (или равновесных концентраций) ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам (обозн.: ПР; К0s;)
Растворимость – это концентрация насыщенного раствора данного в-ва при определенной температуре.
Массовая растворимость – это масса растворенного в-ва в граммах, содержащаяся в 1 литре его насыщенного р-ра (cm=m/V, где m– масса расвторенного в-ва в г, V – объём насыщенного р-ра в л, [г/л]).
Молярная растворимость – это кол-во растворенного в-ва (т.е. число молей этого в-ва), содержащееся в 1 литре его насыщенного р-ра (S=m/(MV), где m– масса расвторенного в-ва в г, М – молярная масса растворенного в-ва в г/моль, V– объём насыщенного р-ра в л, [моль/л]).
Растворимость малорастворимых сильных электролитов: BaSO4; AgCl; CaCO3 и т.д. (S<10-2моль/л).
BaSO4(тв) ß à Ba2++SO42- (вр-ре); BaSO4 – сильн. эл-лит, в р-ре полн. распад. на ионы. Непродиссоциировавшие молекулы BaSO4 в р-ре не существуют. По определению –
К0s(BaSO4)=a(Ba2+)*a(SO42-)=c(Ba2+)*c(SO42-)*f(Ba2+)*f(SO42-)
Т.к. р-римость BaSO4 в воде крайне мала (10-5моль/л), то конц-я ионов бария и сульфат-ионов ничтожно мала и их коэфф. акт-ти практич. равны единице, тогда К0s(BaSO4)=[Ba2+]*[SO42-]
Произведение растворимости – величина постоянная при постоянной температуре.
Растворимость малорастворимого сильного электролита зависит от его природы и природы р-ля, температуры, давления (обычно мала, если не поглощаются и не выделяются газообразные в-ва), присутствия др. электролитов в р-ре (как имеющих, так и не имеющих одноименные ионы с рассматриваемым малорастворимым электролитом), а также различных в-в (в том числе нейтральных молекул), способных образовывать комплексные соединения с данным малорастворимым электролитом или вступающих с ним в др. хим. р-ции).
Термодинамическое произведение растворимости подходит для описания идеальных систем либо систем близких к идеальным (нулевая или очень малая ионная сила, отсутствие побочных реакций). На практике чаще используют концентрационное произведение растворимости, которое может быть реальным или условным. Реальное концентрационное произведение растворимости (KS) выражается через равновесные концентрации ионов, образующихся при растворении осадка:
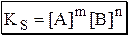
Условным концентрационным произведением растворимости (К’S) называется произведение (в степенях равных стехиометрическим коэффициентам) общей концентрации всех форм существования катиона малорастворимого электролита и всех форм существования его аниона:

не является постоянной величиной, а зависит от концентраций реагентов и др. в-в, присутствующих в системе; в формулу входят уже не равновесные конц-ии ионов, а суммы равновесных конц-й всех форм данного иона в р-ре, т.е. учитывается наличие побочных реакций.
Условное произведение растворимости удобно использовать в тех случаях, когда ионы, образовавшиеся при растворении малорастворимого электролита, вступают в побочные реакции (протолитические реакции, образование комплексных соединений и т.д.).

Условие выпадения осадка:


Электролиты и их влияние на растворимость в-в: влияние добавок электролита с одноименным ионом


Влияние добавок постороннего (индифферентного) электролита: на примере все той же системы с BaSO4


38) Основные типы химических реакций, используемых в аналитической химии. Химическое равновесие в гомогенных и гетерогенных системах. Скорость химических реакций, используемых в аналитической химии. Факторы, влияющие на скорость реакции.
Типы реакций: специфические (характерные) – для обнаруж. в-ва/иона в присутствии др. в-в/ионов, избирательные (селективные) – позволяют обнаружить несколько в-в/ионов, групповые (частный случай селективных) – позвол. обнаруж. ионы определенной аналитической группы.
Основные типы химических реакций в аналитической химии: кислотно-основные, комплексообразования, окисления-восстановления.
Ско́рость хими́ческой реа́кции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства (величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1).
Закон действующих масс: скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:природа реагирующих веществ,наличие катализатора,температура (правило Вант-Гоффа - при повышении температуры на каждые 10о скорость химической реакции увеличивается в 2-4 раза; ур-ние Аррениуса),давление(P), площадь поверхности реагирующих веществ.
Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией активации {\displaystyle E_{A}}чтобы этот барьер преодолеть. В результате скорость химической реакции представляется уравнением, которое было получено Аррениусом:
ур-ние Аррениуса - устанавливает зависимость константы скорости химической реакции от температуры: 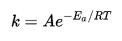 , где А – предэкспоненциальный множитель, характеризующий частоту столкновений реагирующих молекул, R – универс. газов. постоянная.
, где А – предэкспоненциальный множитель, характеризующий частоту столкновений реагирующих молекул, R – универс. газов. постоянная.
Химическое равновесие в гомогенных и гетерогенных сист.: гомогенная система – сист., состоящая только из одной фазы (жидкой, тв., газообр.), растворы – типичные гомогенные системы; гетерогенная система – сист., состоящ. из нескольких фаз, напр., из двух несмешивающихся жидких фаз, из тв. и жидк. фаз и т.д. ГЕТЕРОГЕННОЕ равновесие – это равновесие, устанавливающееся на границе раздела фаз; наиб. часто встречаются два типа гетерогенных сист. – 1. осадок (тв. фаза) к-либо в-ва, находящийся в равновесии с насыщенным р-ром того же в-ва (жидкая фаза): насыщ. водн. р-р BaSO4, наход. в равновесии с осадком сульфата бария; 2. две равновесные жидкие фазы, напр., водный р-р и органический р-ль, не смешивающиеся др. с др., между кот. распределено в-во, находящееся в равновесии с обеими жидкими фазами: экстракционная система, сост. из слоя жидкого тетрахлорида углерода CCl4, над которым расположен водный слой, причем в обеих контактирующих жидких фазах растворен молекулярный I2, из-за чего жидкая органическая фаза окраш. В фиолет. цв., а водная в желтый (I2(органическая фаза)ß à I2(водный р-р). В ГЕТЕРОГЕННОЙ системе при постоянной температуре рано или поздно самопроизвольно достигается состояние равновесия.
Хим. равновесие в гомогенных системах:
При равенстве энтальпийного и энтропийного факторов Δ Н = Т Δ S энергия Гиббса Δ G = 0, что является термодинамическим условием химического равновесия. Химическое равновесие имеет динамический характер. Скорость реакции (число частиц, образующихся в единицу времени в единице объема) в прямом направлении равна скорости реакции в обратном направлении. В этот момент концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. Они обозначаются символом вещества в квадратных скобках.



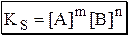








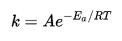 , где А – предэкспоненциальный множитель, характеризующий частоту столкновений реагирующих молекул, R – универс. газов. постоянная.
, где А – предэкспоненциальный множитель, характеризующий частоту столкновений реагирующих молекул, R – универс. газов. постоянная.

