Электролизом называется совокупность процессов, протекающих при прохождении постоянного электрического тока через систему, состоящую из двух электродов и расплава или раствора электролита. Во время электролиза положительно заряженные ионы перемещаются к катоду, который соединяется с отрицательным полюсом внешнего источника постоянного тока, а отрицательно заряженные ионы перемещаются к аноду, который соединяется с положительным полюсом источника постоянного тока. На поверхности катода идет процесс восстановления, на аноде – окисления.
Электролиз расплавов солей
Рассмотрим электролиз расплава хлорида натрия.
При погружении в расплав, состоящий из ионов Na+ и Cl-, двух графитовых электродов, подключенных к источнику тока, в электролите начнется направленное движение ионов, и на электродах будут протекать окислительно-восстановительные процессы.
Схема электролиза расплава натрия
NaCl =Na+ + Cl-


 катод (-) (+) анод
катод (-) (+) анод
Na+ + e-= Na◦ 2Cl- - 2e- = Cl2
Суммарное уравнение реакции:
 2Na+ + 2Cl-электролиз 2 Na + Cl2
2Na+ + 2Cl-электролиз 2 Na + Cl2
 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
Электролиз водных растворов солей
При электролизе водных растворов электролитов полярные молекулы воды притягиваются и к катоду, и к аноду и также могут участвовать в процессах на электродах.
Процессы на катоде
Последовательность восстановления ионов на катоде при электролизе растворов зависит от значений стандартных электродных потенциалов потенциала восстановления водорода из воды.
Первыми на катоде восстанавливаются частицы с бόльшим электродным потенциалом.
1)ионы металлов, электродный потенциал которых менее –1,18В (от Li до Mnв ряду стандартных электродных потенциалов,) не восстанавливаются из водных растворов, вместо них восстанавливается водород из воды по уравнению
2Н2О + 2е- = Н2 + 2ОН- рН >= 7
(в кислых средах- при рН < 7 восстановление водорода идет по уравнению 2Н+ + 2е- = Н2);
2)ионы металлов, электродный потенциал которых от –1,18В до 0,00В (от Mn до Н,) восстанавливаются одновременно с ионами водорода:
Men+ + ne- = Me0
2H2O + 2e- = H2 + 2OH- (рH>=7);
3) ионы металлов, электродный потенциал которых больше 0,00В (от H до Au), восстанавливаются без процесса восстановления водорода из воды:
Меn+ + ne- = Me0.
Процессы на аноде
Для электролиза используют растворимые (активные) и нерастворимые (инертные) аноды. Во время электролиза растворимые аноды растворяются и ионы металла – анода переходят в раствор. Обычно растворимые аноды изготавливаются из того металла, соль которого подвергается электролизу.
Нерастворимые аноды в окислительно-восстановительных реакциях не участвуют. Обычно это аноды из графита, золота, платины. Первыми на аноде окисляются частицы с меньшим электродным потенциалом. Это, как правило, ионы, не содержащие кислорода, такие как J-, Br- , Cl-, S2- и др. (исключение F-).
Кислородсодержащие кислотные остатки на аноде в водных растворах не окисляются, так как имеют очень высокий электродный потенциал. Вместо них окисляются молекулы воды:
2H2О - 4e- = O2 +4H+ (рH<=7)- нейтральная среда,
4OH- - 4e- = 2H2O + O2 (рH>7)- щелочная среда.
Рассмотрим несколько случаев электролиза водных растворов.
Пример 1.
Схема электролиза водного раствора хлорида меди с инертным анодом
CuCl2 = Cu2+ +2Cl-
H2O ↔ H+ + OH-

 катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
Cu2+ + 2e- = Cu0 2Cl- - 2e- = Cl 2
Суммарное уравнение процесса CuCl2→ Cu0 + Cl2.
У меди потенциал больше нуля (е◦Cu/Cu2+ = +0,34В), поэтому на катоде восстанавливается металл, на аноде окисляется безкислородный кислотный остаток.
Пример 2.
Схема электролиза раствора сульфата калия с инертным анодом.
K2SO4 = 2K+ + SO42-
H2O ↔H+ + OH-

 катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
2H2O + 2e- = H2 + 2OH- 2H2O – 4e- = O2 + 4H+.
Домножим катодный процесс на 2, чтобы уравнять количество электронов катодного и анодного процессов, суммируем уравнения и получим 4H2O+2H2O = 2H2+4OH- + O2 + 4H+
6 H 2 O = 2H2+ O2 + 4H 2 O (4OH- + 4H+),
2H2O = 2H2+ O2.
Так как калий в ряду стандартных электродных потенциалов стоит значительно раньше водорода, то на катоде идет восстановление водорода из воды и накопление ионов ОН-.
У анода будетидти окисление молекул воды вместо кислородсодержащего кислотного остатка и накопление ионов Н+. Таким образом, в катодном пространстве вторичным продуктом будет щелочь, а в анодном – кислота.
Пример 3.
Электролиз водного раствора сульфата никеля с никелевым (активным) анодом.
NiSO4 = Ni2+ + SO42-
H2O ↔ H+ + OH-

 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
Ni2+ +2e- = Ni0 Ni – 2e- = Ni2+
e◦Ni/Ni2+= -0,25B - больше потенциала восстановления ионов водорода из воды (2H2O + 2e- = H2 + 2OH-, e◦ 2H2O/ H2 + 2OH- = -0,41В), поэтому восстанавливается никель, а на аноде происходит окисление металла анода, так как потенциал никеля намного меньше потенциала окисления воды (е◦2H2O/O2 + 4H+ = +1,23В) и потенциала кислородсодержащего кислотного остатка SO42-.
Зако́ныэлектро́лизаФараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1836 году.
Масса электролита, подверженная химическому превращению, а также масса веществ, выделившихся на электродах по законам Фарадея прямо пропорциональны количеству прошедшего через электролит электричества и молярным массам эквивалентов веществ:
m =  или m =
или m = 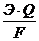 ,
,
где m –масса электролита, подвергшаяся электролизу, или масса веществ, выделившаяся на электродах;
J – сила тока, А; Q = J·t – количество электричества;
Э – молярная масса эквивалентов вещества, г/моль;
F – число Фарадея – 96500 Кл;
t – время электролиза, с.
Пример.
Какой объем водорода выделится при пропускании тока силой в 3 А в течение 1 часа через водный раствор серной кислоты.
Для расчета объема выделившегося газа закон Фарадея имеет вид:
V=  ,
,
где Vэ- эквивалентный объем газа.
Для водорода Vэ =  , где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
, где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
Таким образом, V(Н2) =  =1,25л.
=1,25л.
Применение в промышленности. Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. К числу металлов, получаемых электролизом расплавленных сред относятся алюминий, магний, цирконий, титан, уран, бериллий и ряд других металлов.
Электролиз применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
6.Радиоактивность. Изотопы и изобары. Виды излучений. Ядерные превращения. Ряды радиоактивных превращений. Ядерное деление и ядерный синтез.
Радиактивность- самопроизвольное превращение неустойчивого изотопа одного хим элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер.
В результате радиактивного распада происходят ядерные превращения, сопровождающиеся излучением.
Ядерные превращения описываются аналогично обычным химическим реакциями. При этом суммарные массы и атомные номера в левой и правой частях уравнений должны быть равны. Изотопы -атомы, ядра которых имеют одинаковое число протонов. Изобары - атомы имеющие одинаковые массовые числа.
Пример:
ПРИМЕРЫ ИЗОТОПОВ, ИЗОБАРОВ И ИЗОТОНОВ СРЕДИ ПРИРОДНЫХ НУКЛИДОВ.
(ТАБЛИЦА)
| ИЗОТОПЫ
| ИЗОБАРЫ
|
| Нуклиды
| Z
| A
| N
| Нуклиды
| Z
| A
| N
|

|
|
|
| 
|
|
|
|
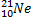
|
|
|
| 
|
|
|
|
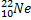
|
|
|
| 
|
|
|
|

|
|
|
| 
|
|
|
|

|
|
|
| 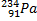
|
|
|
|
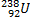
|
|
|
| 
|
|
|
|
Нуклиды с одинаковым 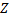 , но различными
, но различными  называются изотопами, нуклиды с одинаковым
называются изотопами, нуклиды с одинаковым  и различными
и различными  – изобарами
– изобарами
Виды излучений:
Альфа-излучение -представляет собой поток ядер гелия, с зарядом +2 и массой 4 а.е.м.альфа-лучи испускают ядра самых тяжелых элементов, менее стабильных.поскольку ядра гелия имеют положит заряд, они притягивают электроны и вследствии этого обладают высокой ионизирующей способностью.однако сравнительно большой размер ядер гелия ограничивает проникающую способность альфа излуч по сравнению с бета и гамма.
Бета излучение представляет собой поток электронов(позитронов), движущихся со скоростью света.электроны испускаются неустойчивыми ядрами в рез распада нейтрона.
Позитроны испускаются радиактивными ядрами. Они являются аналогами электронов, но в отличии от них имеют положительный заряд. они образуются в результате превращения протона в нейтрон.
Гамма излучения представляет собой электромагнитное излучение с высокой энергией, подобно рентгеновским лучам, но с меньшей длиной волн. Высокая энергия и малая длина волны обуславливает большую проникающую способность.испускание гамма происходит, когда нуклид испускает альфа и бета частицы.





 катод (-) (+) анод
катод (-) (+) анод 2Na+ + 2Cl-электролиз 2 Na + Cl2
2Na+ + 2Cl-электролиз 2 Na + Cl2 2NaCl электролиз 2Na + Cl2
2NaCl электролиз 2Na + Cl2
 катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
катод(-) Cu2+,H+(H2O) Cl-, OH- (H2O) (+)анод
 катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
катод(-) 2K+,H+(H2O) SО42-, OH(H2O) (+)анод
 катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод
катод(-) Ni2+, H+(H2O) SO42- , OH-(H2O) (+)анод или m =
или m = 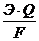 ,
, ,
, , где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2).
, где Vm- молярный объем газа - 22,4л/моль –постоянная величина для любого газа, 2 – количество электронов, затраченных в процессе восстановления водорода (2Н+ + 2е- = Н2). =1,25л.
=1,25л.

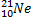

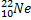




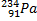
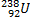
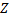 , но различными
, но различными  называются изотопами, нуклиды с одинаковым
называются изотопами, нуклиды с одинаковым  и различными
и различными  – изобарами
– изобарами

