Раскисление –это процесс удаления из металла избыточного кислорода.
Большинство металлов в жидком виде хорошо растворяют кислород. С повышением температуры растворяемость кислорода увеличивается.
 - эндотермическая реакция
- эндотермическая реакция 
 - экзотермическая реакция
- экзотермическая реакция 
 - эндотермическая реакция
- эндотермическая реакция
В процессе окислительного рафинирования металл максимально насыщают кислородом количество которого становится, в конце концов, адекватным концентрации примесей. Оставшийся кислород становится сам вредной примесью. Причинами этого является следующее:
1.При охлаждении металла растворимость кислорода в нем понижается, кислород выделяется в виде разных по размерам газовых пузырей. Часть пузырьков успевает выйти в атмосферу, а часть – остается в слитках в виде газовых раковин, и при обработке давлением она препятствует свариванию металла.
2.Т.к. реакции окисления примесей идут лучше при более низких температурах, то оставшиеся в металле примеси и кислород при охлаждении снова начинают между собой реагировать, образуя твердые оксидные включения, которые называют неметаллическими. Эти включения снижают металлические свойства изделий.
3.Часть газовых пузырей в металле образуется по причине реагирования растворенных углерода и кислорода с образованием газообразного СО. 
4.Часть кислорода остается в металле в твердом растворе, она не успевает не образовывать газовых пузырей, не прореагировать с примесями.
Затвердевшие растворы являются пересыщенными, а все пересыщенные растворы – неустойчивы, и со временем они распадаются. Это приводит к образованию мельчайших газовых пор. Все процессы распада пересыщенных растворов в науке и технике называют процессами «старения».
Избыточный кислород удаляют с помощью веществ, называемых раскислителями. В качестве раскислителей применяют чистые вещества или сплавы с высоким сродством к кислороду. (Обычно это Mn, Si, Al, FeMn, SiMn, FeSi, SiCa и др.).
Общие термодинамические принципы раскисления рассмотрим на примере реакции:

Где 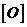 - кислород, растворенный в металле;
- кислород, растворенный в металле;
 - раскислитель.
- раскислитель.
Константа равновесия этой реакции имеет вид:

Для определения факторов, влияющих на остаточную концентрацию кислорода, запишем выражение для остаточной концентрации кислорода в следующем виде
Итак, видим, чтобы концентрация кислорода в металле была минимальной необходимо:

1.Концентрация оксида в шлаке должна быть малой, т.е. шлака должно быть достаточно. При раскислении шлак обычно периодически скачивают.
2.Коэффициент активности оксидов примесей должен быть малым, для этого необходимо, чтобы оксид раскислителя в шлаке был связан в устойчивые комплексы или устойчивые химические соединения, Если раскислителем является марганец, то им удобно раскислять под кислым шлаком, если раскислителем является кремний – под основным шлаком.
3.Константа равновесия должна быть большой. Ее величина зависит от средства раскислителя к кислороду и температуры. Чем выше сродство раскислителя к кислороду, тем выше  , значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше.
, значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше.
Реакции взаимодействия раскислителя с кислородом являются экзотермическими, т.е. с повышением температуры константа понижается и, наоборот. Значит, раскислять необходимо при умеренных температурах, металл не должен быть перегрет.
4.Коэффициент активности кислорода считается const
5.Концентрация раскислителя в жидком металле должна быть достаточной, но при этом раскислитель сам не должен стать вредной примесью.
6.Коэффициент активности раскислителя является величиной малорегулируемой, и ее обычно не учитывают.
Раскисление можно осуществлять двумя методами.
Осаждающий метод заключается в том, что в расплавленный металл задается пусковой раскислитель, раскислитель растворяется в металле и вступает в реакцию с растворенным кислородом во всем объеме жидкого расплава. Этот метод применяют только для случаев, когда кислород способен в большей или меньшей мере растворяться в металле.
Диффузионный метод основан на законе распределения кислорода между металлом и шлаком. В этом методе порошкообразный раскислитель задается на поверхность шлака. Раскислитель взаимодействует с малопрочными оксидами шлака и переводит их в прочные оксиды. Концентрация кислорода в шлаке остается неизменной, но коэффициент активности кислорода в шлаке уменьшается. Т.к. коэффициент распределения кислорода для заданной системы и температуры – величина постоянная, то это приводит к тому, что кислород из металла переходит в шлаковую фазу, где снова связывается с раскислителем в прочные оксиды. Этот метод пригоден для удаления кислорода из металлов, хорошо растворяющих в себе кислород, а также металлов, которые плохо растворяют его в себе. Существенным недостатком данного метода является малая скорость процесса.
Практическое задание
Для заданной реакции и температуры:
а) вычислить константу равновесия и рассчитать равновесные концентрации;
б) выбрать состав восстановительной газовой фазы.
Для решения практического задания воспользуемся энтропийным методом расчёта константы равновесия химических реакций.
Для расчета химических реакций используют понятие о химическом потенциале:
 (1)
(1)
Энтропийный метод расчета  основан на следующем:
основан на следующем:



Изменение энтальпии и энтропии реакции вычисляем по формулам:


Приведенные уравнения показывают, как может изменяться внутренняя энергия и энтропия произвольного вещества при изменении его температуры. В реакции участвуют разные вещества и для каждого из них, в зависимости от наличия или отсутствия модификационных и агрегатных превращений, зависимость внутренней энергии или энтропии от температуры может выражаться разными уравнениями. Например, если какое-либо вещество не претерпевает никаких изменений в интервале температур от 298 до Т, то для такого вещества:
 соответственно
соответственно 
В случае, если вещества претерпевают изменения в интервале температур от 298 до Т, величины 
 можно найти так:
можно найти так:


Рассмотрим качественный пример:
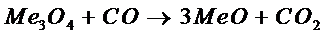

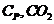



Итак, видим, что только одно вещество-участник реакции претерпевает превращение при  , значит весь интервал расчета разбиваем на два промежутка: от
, значит весь интервал расчета разбиваем на два промежутка: от  до
до  и от
и от  до искомой температуры. Получаем:
до искомой температуры. Получаем:


Так как теплоемкость у каждого вещества зависит от температуры, следующим образом  , то
, то  и
и  находятся для каждого температурного интервала с учетом тех значений и коэффициентов
находятся для каждого температурного интервала с учетом тех значений и коэффициентов  , которые справедливы для веществ в заданном интервале:
, которые справедливы для веществ в заданном интервале:

где 



где 


Подинтегральные выражения в уравнениях  и
и  в общем случае берутся так:
в общем случае берутся так:


 находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.
находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.

Если в реакции участвует простое вещество, то теплота его образования 
 находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.
находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.

Итак, вычисляем  и
и  , затем по уравнению (1) находим
, затем по уравнению (1) находим  , а потом из уравнения
, а потом из уравнения 
Находим константу равновесия.

Значение константы равновесия зависит только от природы веществ и температуры и не зависит от исходного состава системы. Величина константы равновесия показывает, насколько сильно смещается в ту или иную сторону состояние системы, после протекания процесса: каких веществ будет много, каких мало, или содержания их в системе окажутся сопоставимыми.
Для заданной реакции константа равновесия выражена:
 ;
;


откуда:  ;
;  .
.
Для выбора состава восстановительной газовой смеси руководствуемся простым правилом: восстановительная смесь для соответствующего оксида должна содержать более высокую долю газа-восстановителя (СО или Н2), чем та, которая соответствует равновесному состоянию при заданной температуре.
ПРИМЕР. Дана реакция  Т = 1100 К
Т = 1100 К
РЕШЕНИЕ. Воспользуемся справочными данными и представим термодинамические свойства веществ-участников реакции в виде табл. 1
Таблица 1 – Термодинамические свойства веществ-участников реакции
|
Вещество
|
Фаза
| 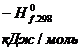
| 
| 
| 
| 
|

| 
| 
|
| Н2
| Г
| -
| 130,58
| 27,72
| 3,39
| -
| -
| -
|
| Н2О
| Ж
| 286,03
| 69,9
| 46,9
| 30,02
| -
|
| 40,90
|
|
| Г
| -
| -
| 90,9
| -
| -
| -
| -
|
| Fe3O4
| ТВ
|
| 146,6
| 51,83
| 6,78
| - 1,59
|
| -
|
| FeO
| ТВ
| 266,7
| 54,0
| 38,81
| 20,10
| -
|
| 31,4
|
|
| Ж
| -
| -
| 60,7
| -
| -
|
| 230,0
|
Константу равновесия и равновесные концентрации находим с
помощью уравнений

Вычисляем  по уравнению
по уравнению

Как показывают табличные данные, с одним из веществ в указанном интервале температур происходит агрегатное превращение – вода при 373 К переходит из жидкого в парообразное состояние. Поэтому формулы для расчета изменения энтальпии и энтропии реакции принимают вид:


Тепловой эффект при 298 К вычисляем как разность теплот образования веществ продуктов и веществ вступающих в химическую реакцию:

Величину  находим как разность абсолютных энтропий веществ участников реакции
находим как разность абсолютных энтропий веществ участников реакции

Вычисляем разность теплоемкостей для реакции

Интервал температур: 298 – 373 К:


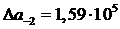
Интервал температур 373-1100 К:


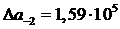
Находим тепловой эффект реакции: 
Вычисляем изменение энтропии реакции:

Определяем изменение энергии Гиббса для заданной реакции:

Вычисляем константу равновесия



Выбираем газовую смесь для восстановления, в которой содержание восстановителя выше чем в равновесии и составляет 40% Н2 и 60% Н  О.
О.



 - эндотермическая реакция
- эндотермическая реакция 
 - экзотермическая реакция
- экзотермическая реакция 
 - эндотермическая реакция
- эндотермическая реакция

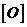 - кислород, растворенный в металле;
- кислород, растворенный в металле; - раскислитель.
- раскислитель.

 , значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше.
, значит, кремний лучший раскислитель, чем марганец, а алюминий – еще лучше. (1)
(1) основан на следующем:
основан на следующем:




 соответственно
соответственно 

 можно найти так:
можно найти так:

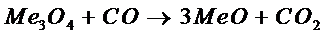

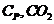



 , значит весь интервал расчета разбиваем на два промежутка: от
, значит весь интервал расчета разбиваем на два промежутка: от  до
до 

 , то
, то  и
и  находятся для каждого температурного интервала с учетом тех значений и коэффициентов
находятся для каждого температурного интервала с учетом тех значений и коэффициентов  , которые справедливы для веществ в заданном интервале:
, которые справедливы для веществ в заданном интервале:







 и
и  в общем случае берутся так:
в общем случае берутся так:

 находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.
находим, используя закон Гесса, как разность теплот образования веществ-продуктов и веществ, вступающих в реакцию.

 находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.
находим, как разность абсолютных энтропий веществ-продуктов и веществ, вступающих в реакцию.
 и
и  , затем по уравнению (1) находим
, затем по уравнению (1) находим  , а потом из уравнения
, а потом из уравнения 

 ;
;

 ;
;  .
. Т = 1100 К
Т = 1100 К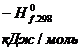








 по уравнению
по уравнению



 находим как разность абсолютных энтропий веществ участников реакции
находим как разность абсолютных энтропий веществ участников реакции



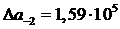








 О.
О.


