После начала реакции химический потенциал одних веществ уменьшается, других – увеличивается, наступает их равенство, а значит и химическое равновесие.
В равновесном состоянии 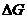 реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.
реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.
Для равновесного состояния можно записать:

и константа равновесия равна: 
В случае, если Кр>1 – это означает, что продуктов реакции больше, чем исходных веществ, если Кр<1, то соответственно, наоборот. Если же Кр=1, то концентрации веществ при равновесии соизмеримы.
По величине константы равновесия можно качественно судить о полноте протекания процесса. Помимо этого, зная величину Кр, можно рассчитать равновесные концентрации для большинства 2х и более компонентных смесей. В равновесной системе устанавливается постоянное соотношение между микрочастицами различных веществ участников реакции. Плотность материальных частиц и их энергий по объему системы или по отдельным фазам устанавливается постоянной. Константа равновесия, вычисляемая из уравнения (1), обязательно должна выражаться или через парциальное давление, или через активность веществ в растворе, или через то и другое. В то же время, концентрации веществ, особенно газов, часто удобно выражать другими величинами: через мольные доли, объемные проценты, молярность (число молей на литр). В этих случаях для одной и той же реакции в цифровом отношении константы могут отличаться, но между ними, естественно, существует взаимосвязь.
Пример: 


 - Равновесные парциональные давления веществ в газовой смеси.
- Равновесные парциональные давления веществ в газовой смеси.
 - общее давление смеси.
- общее давление смеси.
Выразим константу равновесия через мольные доли. В равновесном состоянии имеем  соответственно
соответственно  общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе
общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе




Связь между парциальными давлениями и молными долями имеет вид:



Из данных зависимостей найдем:

Таким образом, связь между константой равновесия, выраженной через парциальные давления, и константой равновесия, выраженной через мольные доли, носит следующий характер:

 - разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:
- разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:

Найдем константу равновесия через объемные проценты:

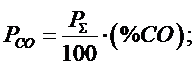


Таким образом, связь между Kp и Kc выглядит так: 
Найдем константу равновесия через молярность:
Используем равенство  ,
,
где  количество молей вещества,
количество молей вещества,
 общий объем, выраженный в литрах.
общий объем, выраженный в литрах.
Тогда 
Для каждого газа в равновесной системе имеем:


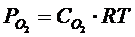

Таким образом, связь между Кр и Кс имеет вид: 
Итак, взаимосвязь между константами равновесия выглядит следующим образом:
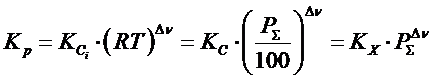
8. Основы теории металлотермии
Металлотермические процессы – процессы, вкоторых в качестве восстановителя используют другой металл, тот у которого сродство выше, чем у восстанавливаемого. При этом руководствуются следующим:
Желательно, чтобы различие в сродстве было максимально большим;
Металл – восстановитель должен быть доступным и относительно дешевым;
В металлотермии восстанавливаемая часть шихты и восстановитель максимально полно перемешиваются между собой, поэтому размеры частиц восстановителя и восстанавливаемой руды (концентрата) должны быть небольшими.
Наиболее широко распространена алюмотермия. Al применяют в гранулах или порошкообразный.
Распространение нашла и силикотермия. Si (сплавы на его основе Si-Mn, Fe-Si, Si-Cr, Si-Ca) – хрупкий материал, он легко измельчается.
Применяют также в качестве восстановителя и Mg, который используют в жидком виде.
В основном, выбор металла – восстановителя в в металлотермии осуществляют по величине удельной теплоты процесса. Все реакции металлотермии – экзотермические. Тепла реакций может оказаться достаточно для разогрева исходных веществ и продуктов, а может и не хватить. Принцип достаточности основан на практическом правиле Жемчужного, согласно которому реакция самообеспечивает себя теплом, если на 1 кг шихтовой смеси или продуктов выделяется не менее 550 ккал тепла:

где 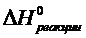 - тепловой эффект реакции при определенной температуре
- тепловой эффект реакции при определенной температуре
 - сумма молекулярных масс веществ, вступающих в реакцию или образующихся.
- сумма молекулярных масс веществ, вступающих в реакцию или образующихся.
 - критерий самообеспеченности процесса теплом, и одновременно критерий возможности протекания реакции, т.к.
- критерий самообеспеченности процесса теплом, и одновременно критерий возможности протекания реакции, т.к.  непосредственно корригируется с величиной
непосредственно корригируется с величиной  .
.
Реакция металлотермии в общем виде выглядит так:
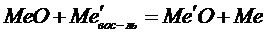
Вещества слева и справа от знака равенства подобны, поэтому разница DS невелика, и величина DG с практической приемлемостью совпадает с DH0.
Возможность реакции металлотермии можно было бы рассчитать по одному из известных методов:
Энтропийному: 
По приведенному потенциалу 

Также по методу Темкина – Шварцмана и другим. Если  , то такую реакцию называют автогенной, если же тепла не хватает, то необходимо принимать дополнительные меры (подводить тепло), в основном это энергия электрической дуги, реже – индукционный подогрев.
, то такую реакцию называют автогенной, если же тепла не хватает, то необходимо принимать дополнительные меры (подводить тепло), в основном это энергия электрической дуги, реже – индукционный подогрев.
В некоторых случаях в шихту добавляют легковосстановимые оксиды, но в этом случае получают сплав. Если же тепла много, то в шихту добавляют инертные материалы (флюсы): CaCO3; MgCO3; CaO; Ca,Mg(CO3)2 и т.д.
Металлотермические процессы могут быть таких типов:
· Плавка на выпуск
· Плавка на блок
Одним из видов металлотермии является процесс получения губчатого титана: на поверхность жидкого магния вдувается газообразный TiCl4

Широко используется металлотермия в урановой промышленности:




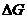 реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.
реакции становится равной нулю, концентрации веществ становятся равновесными, и их соотношение можно выразить через конкретную величину, которая называется константой равновесия.




 - Равновесные парциональные давления веществ в газовой смеси.
- Равновесные парциональные давления веществ в газовой смеси. - общее давление смеси.
- общее давление смеси. соответственно
соответственно  общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе
общее число молей в смеси. Найдем мольные доли каждого вещества в равновесном газе








 - разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:
- разность между стехиометрическими коэффициентами у газов, стоящих справа и слева от знака равенства в данном случае:

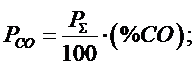



 ,
, количество молей вещества,
количество молей вещества, общий объем, выраженный в литрах.
общий объем, выраженный в литрах.


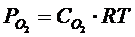


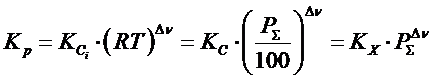

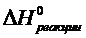 - тепловой эффект реакции при определенной температуре
- тепловой эффект реакции при определенной температуре - сумма молекулярных масс веществ, вступающих в реакцию или образующихся.
- сумма молекулярных масс веществ, вступающих в реакцию или образующихся. - критерий самообеспеченности процесса теплом, и одновременно критерий возможности протекания реакции, т.к.
- критерий самообеспеченности процесса теплом, и одновременно критерий возможности протекания реакции, т.к.  .
.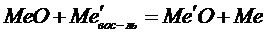



 , то такую реакцию называют автогенной, если же тепла не хватает, то необходимо принимать дополнительные меры (подводить тепло), в основном это энергия электрической дуги, реже – индукционный подогрев.
, то такую реакцию называют автогенной, если же тепла не хватает, то необходимо принимать дополнительные меры (подводить тепло), в основном это энергия электрической дуги, реже – индукционный подогрев.




